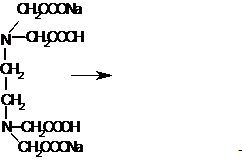Определение количественного содержания лекарственных веществ в субстанции и лекарственных препаратах ставит своей целью установление фактического содержания лекарственного вещества в исследуемых объектах.
При оценке количественного содержания речь идет, прежде всего, об индивидуальных лекарственных веществах, но при этом невозможно дать оценку содержания вспомогательных веществ: эмульгаторов, наполнителей, корригентов, консервантов или других вспомогательных веществ. В случае необходимости для определения их содержания требуется отдельная методика.
Методы количественного анализа делят на три основные группы: химические, физико-химические и биологические.
3.1. Химические методы.
Гравиметрия. Гравиметрический метод дает довольно точные результаты. Однако из-за того, что он требует больших затрат времени, он вытеснен другими химическими и физико-химическими методами. В настоящее время этот метод используется при определении потери в массе при высушивании золы и сульфатной золы. Потеря в массе при высушивании обычно определяется путем высушивания образца субстанции в сушильном шкафу до постоянной массы при указанной температуре. Иногда используют другие методы высушивания, особенно для термолабильных объектов: высушивание в эксикаторе над пятиоксидом фосфора при нормальном давлении и комнатной температуре, высушивание над пятиоксидом фосфора в вакууме, высушивание над пятиоксидом фосфора в высоком вакууме (0,1кРа).
Определение золы. Зола является показателем количества неорганических веществ в животном или растительном сырье. Для определения общей золы навеску образца сырья вначале сжигают в тигле на сетке. Сжигание проводят так, чтобы не было пламени. Затем остаток помещают в муфельную печь и прокаливают примерно при 500оС до постоянной массы.
Для определения золы нерастворимой в разведенной хлористоводородной кислоте, золу в тигле обрабатывают разведенной хлористоводородной кислотой (15 мл), нагревают на водяной бане 10 минут, прибавляют 5 мл горячей воды очищенной и фильтруют через беззольный фильтр. Фильтр помещают в тот же тигель, сжигают на сетке, затем помещают в муфельную печь и прокаливают до постоянной массы.
Сульфатную золу определяют в органических веществах примерно по иой же схеме. В тигель помещают необходимое количество вещества, добавляют 1 мл концентрированной серной кислоты, осторожно нагревают на сетке до удаления паров серной кислоты, затем прокаливают в муфельной печи до постоянной массы.
Титриметрические методы анализа.
Титрование кислот и оснований в водной среде. В водной среде возможно титрование кислот и оснований методом нейтрализации, если константа диссоциации кислот и оснований не менее 1· 10-8, т.е. в водных растворах возможно титрование сильных кислот и сильных оснований и слабых кислот и слабых оснований. Погрешность определения незначительна при правильном выборе индикатора. При титровании слабых оснований сильной кислотой точка эквивалентности находится при рН ниже 7,0. При титровании слабой кислоты сильным основанием точка эквивалентности находится выше 7,0. В соответствии с этим выбирается индикатор, у которого переход окраски соответствует пределам рН точки эквивалентности.
Некоторые кислоты и основания мало растворимы в воде. Поэтому для их определения используют спиртово-водные смеси. Наличие спирта не только улучшает растворимость кислот и оснований, но улучшает условия титрования. В фармацевтическом анализе такой прием используют при титровании бензойной, салициловой и других кислот, а также некоторых оснований (кодеин). Используют также обратное титрование, когда основание растворяют в избытке 0,1М хлористоводородной кислоты, который оттитровывают 0,1М раствором натрия гидроксида.
Титрование NH- и СН-ацидов. Такие соединения за редким исключением (барбитураты) невозможно оттитровать непосредственно. В этом случае используют титрование после добавления раствора серебра нитрата или же серебра нитрата в растворе пиридина. В качестве примера можно привести определение барбитуратов, теофиллина или теобромина.



Примером СН – ацидов являются производные стероидных гомонов с этинильной группой в 17 положении.
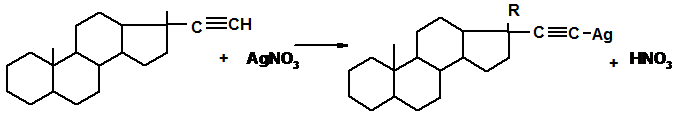
HNO3 + NaOH → H2O + NaNO3
Титрование слабых кислот и оснований в неводных растворителях.
Как было показано выше титрование по методу нейтрализации возможно, если рК кислот и оснований равно 8. Если же это значение выше, то титрование невозможно вследствие гидролиза образующихся солей.
Кислотность или основность соединений зависит от растворителя. Кислотность слабых кислот может повыситься, если в качестве растворителя использовать основный растворитель, основность слабых оснований повышается, если в качестве растворителя использовать кислый растворитель.
Выбор растворителя производится на основе величин констант титрования Кт или рКт. Чем больше величина рКт, тем лучше условия титрования.
Константа титрования определяется константой диссоциации кислоты или основания и константой автопротолиза растворителя:
 KТ = или рКТ = рКi – pKA,
KТ = или рКТ = рКi – pKA,
где: Кi – константа автопротолиза, КА – константа диссоциации кислоты.
Для оснований:
 КТ = или рКТ = рКi – рКВ или рКТ = рКi + рКА – 14.
КТ = или рКТ = рКi – рКВ или рКТ = рКi + рКА – 14.
Определение точки эквивалентности при титровании в неводных средах может
проводиться как с помощью индикаторов, так и с помощью потенциометров.
При титровании галогеноводородных солей оснований в реакционную смесь добавляют ацетат ртути для связывания галогеноводородов в недиссоциирующие соли ртути.
Приведем два примера титрования в неводной среде.
Титрование слабой кислоты – барбитурата. В качестве растворителя используют диметилформамид, в качестве индикатора – тимолфталеин.
Сравним условия титрования барбитурата (фенобарбитала) в воде и диметилформамиде.
Для водной среды:
рКТ = рКi – pKA
рКТ = 14 – 7,21 = 6,79
Для диметилфомамида:
рКТ = рКi – pKA = 25,3 – 13,4 = 11,9
Как видно из приведенных значений, во втором случае значение рКТ значительно больше, а значит и условия титрования лучше, чем в первом случае.


 Титрантом является раствор натрия метилата в растворе метанола и бензола или раствор натрия гидроксида в том же растворителе.
Титрантом является раствор натрия метилата в растворе метанола и бензола или раствор натрия гидроксида в том же растворителе.

Титрование слабого основания на примере кофеина. В качестве растворителя используется уксусный ангидрид.
Константа титрования кофеина в этих условиях определяется таким образом:
рКВ = 8,2; рКi = 14,5
рКТ = рКi – рКВ = 14,5 – 8,2 = 6,3
 Такое значение рКТ позволяет провести титрование кофеина как основания. В воде кофеин имеет значение рКВ = 13,4 и значение рКТ = 14,0 – 13,4 = 0,6, что не позволяет оттитровать его в водном растворе.
Такое значение рКТ позволяет провести титрование кофеина как основания. В воде кофеин имеет значение рКВ = 13,4 и значение рКТ = 14,0 – 13,4 = 0,6, что не позволяет оттитровать его в водном растворе.
В качестве индикатора используют кристаллический фиолетовый. Следует отметить, что при неводном титровании всегда проводят контрольный опыт. Это связано с тем, что переход окраски меняется не резко, а постепенно от фиолетового до желтого. В зависимости от силы основности титрование ведут до разного изменения индикатора, при этом затрачивается различное количество хлорной кислоты для изменения цвета индикатора.
Комплексонометрическое титрование солей металлов.
С 1945 г для определения солей металлов, за исключением одновалентных, стали широко применяться комплексонометрические методы титрования. Самым подходящим титрантом оказался комплексон III или динатриевая соль этилендиаминотетрауксусной кислоты (ЭДТА-Na). Стабильность комплексов в сильной степени зависит от рН среды. Так как во время титрования образуются свободные протоны водорода, то при комплексонометрическом титровании требуется использование буферных растворов. В некоторых случаях для предотвращения образования гидроксидов металлов добавляют цитраты или тартраты. В качестве индикаторов используют так называемые металлохромные индикаторы, которые с металлами образуют окрашенные комплексы, отличающиеся по цвету от свободных индикаторов. Комплекс металла с индикатором, как правило, менее стабилен, чем комплекс металла с ЭДТА. В качестве индикатора применяют эриохром - черный Т. В точке эквивалентности комплекс металла с индикатором разрушается, при этом освобождается свободный индикатор и цвет меняется от вино-красного до синего. Если использовать смешанный индикатор – эриохром черный Т и метиловый оранжевый, то в точке эквивалентности цвет меняется от вино-красного до зеленого.
Уравнения реакции мы покажем на примере титрования соли магния.



Образовавшаяся серная кислота нейтрализуется буферным раствором.
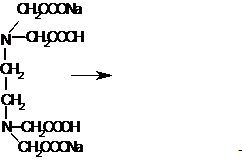



Реакции осаждения чаще всего используются для определения хлоридов, бромидов и йодидов.
Определение галогенидов проводят путем прямого или обратного титрования с помощью раствора серебра нитрата.
Прямое титрование в нейтральной среде по методу Мора проводят в присутствии калия хромата. Точку эквивалентности определяют по образованию калия хромата красно-коричневого цвета.
NaCI + AgNO3 → AgCI↓ + NaNO3
2AgNO3 + K2CrO4 → Ag2CrO4 + 2KNO3
Обратное титрование по методу Фольгарда проводят следующим образом. К определяемому раствору добавляют избыток титрованного раствора серебра нитрата и раствор железо-аммонийных квасцов. Избыток раствора серебра нитрата оттитровывают титрованным раствором аммония тиоцианата до получения красного окрашивания.
Для определения йодидов часто рекомендуется метод Фаянса. Это прямое титрование с применением адсорбционных индикаторов. При титровании йодидов в точке эквивалентности происходит изменение знака заряда мицеллы осадка серебра йодида и адсорбции индикатора эозината на осадке серебра йодида. При этом осадок приобретает розовый цвет.
NaI + AgNO3 → AgI↓ + NaNO3
[ AgI] I─ · Na+
до точки эквивалентности
[AgI] Ag+ · Эоз─
после точки эквивалентности.
Титрование по методу Фаянса используется при титровании по методу осаждения и других анионов: хлоридов, бромидов, сульфатов.






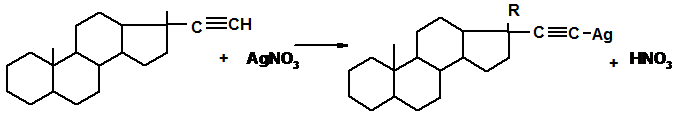
 KТ = или рКТ = рКi – pKA,
KТ = или рКТ = рКi – pKA, КТ = или рКТ = рКi – рКВ или рКТ = рКi + рКА – 14.
КТ = или рКТ = рКi – рКВ или рКТ = рКi + рКА – 14.

 Титрантом является раствор натрия метилата в растворе метанола и бензола или раствор натрия гидроксида в том же растворителе.
Титрантом является раствор натрия метилата в растворе метанола и бензола или раствор натрия гидроксида в том же растворителе.
 Такое значение рКТ позволяет провести титрование кофеина как основания. В воде кофеин имеет значение рКВ = 13,4 и значение рКТ = 14,0 – 13,4 = 0,6, что не позволяет оттитровать его в водном растворе.
Такое значение рКТ позволяет провести титрование кофеина как основания. В воде кофеин имеет значение рКВ = 13,4 и значение рКТ = 14,0 – 13,4 = 0,6, что не позволяет оттитровать его в водном растворе.