

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...
Топ:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Оснащения врачебно-сестринской бригады.
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Общая характеристика и классификация методов исследования.
1.1. Общая характеристика физических методов исследования. Взаимодействие излучения с веществом. Классификация методов по областям электромагнитного излучения. Способы изображения спектра электромагнитного излучения в методах исследования.
1.2 Возможности методов и области их применения. Чувствительность, разрешающая способность и характеристическое время метода. Энергетические характеристики методов. Прямая и обратная задачи. Понятие корректно и некорректно поставленных задач.
Колебательная спектроскопия.
2.1. Полная энергия молекулы как сумма электронной, колебательной и вращательной составляющих. Приближение Борна-Оппенгеймера. Колебания двухатомной молекулы согласно классической теории в приближениях гармонического и ангармонического осцилляторов. Полная энергия колебаний. Уравнение движения ядер. Волновое число колебаний. Потенциал Морзе. Точки возврата. Силовая постоянная связи.
2.2. Колебательные состояния двухатомной молекулы согласно квантовой механике. Колебательная волновая функция. Уровни колебательной энергии двухатомных молекул в приближении гармонического и ангармонического осцилляторов. Соотношение Бора. Коэффициент ангармоничности. Энергия диссоциации двухатомной молекулы.
2.3. Колебательные состояния многоатомных молекул. Колебательные степени свободы. Нормальные координаты и колебания. Формы и частоты нормальных колебаний. Валентные, деформационные плоскостные и внеплоскостные, маятниковые, крутильные, веерные, пульсационные, зонтичные, ножничные и другие виды нормальных колебаний. Симметрия молекул и нормальных колебаний. Нормальные колебания и их частоты для молекул СО2 и Н2О.
|
|
2.4. Уровни колебательной энергии многоатомных молекул. Фундаментальные, обертонные, составные, «горячие» и разностные частоты. Система колебательных уровней энергии молекул Н2О и СО2. Резонанс Ферми.
2.5. Методы наблюдения колебательных спектров. Спектры испускания и поглощения (ИК-спектры). Правила отбора для колебательных и колебательно-вращательных спектров. Интенсивность линий в спектрах.
2.6. Вращательная структура в колебательных ИК спектрах (Р- и R- ветви). Правила отбора. Вид спектров. Интенсивность линий в спектрах.
2.7. Спектры комбинационного рассеяния (КР-спектры). Правила отбора. Вид спектров. Интенсивность линий в спектрах. Вращательная структура в спектрах КР (О-, Q- и S- ветви).
2.8. Идентификация соединения и качественный анализ смесей методами колебательной спектроскопии. Количественный анализ. Органические и неорганические вещества. Полимеры. Проблема окружающей среды. Исследование равновесий. Комплексы с водородными связями. Кинетические исследования.
2.9. Характеристичность нормальных колебаний. Концепция групповых частот и её недостатки. Внутренние и внешние факторы, влияющие на групповые частоты. Сопоставление ИК- и КР- спектров и выводы о симметрии молекулы. Правило исключения. Использование контуров вращательной структуры ИК-полос поглощения газов для интерпретации спектра.
2.10. Техника и методики ИК и КР спектроскопии. Выбор оптимальных условий получения ИК спектров. Методы подготовки образцов. Прозрачные материалы. Аппаратура спектроскопии КР. Лазерные источники возбуждения. Сравнение методов ИК и КР спектроскопии, их достоинства и недостатки. Метод нарушенного полного внутреннего отражения (НПВО) для «неудобных» объектов (смолы, пищевые продукты, сырая резина и т.п.).
Метод ядерного гамма - резонанса.
8.1. Физические основы мессбауэровской спектроскопии. Ядерная изомерия. Вероятность появления γ-кванта. Энергия отдачи и эффект Допплера. Распределение испускаемых и поглощаемых γ-квантов по энергиям.
|
|
8.2. Условия наблюдения эффекта Мессбауэра. Влияние химического окружения ядер на эффект Мессбауэра. Химический (изомерный) сдвиг. Квадрупольные и магнитные взаимодействия.
8.3. Возможности применения эффекта Мессбауэра в химии и его ограничения. Квадрупольное расщепление и изомерные сдвиги для высоко - и низкоспиновых комплексов железа. Техника и особенности эксперимента.
Методы масс-спектрометрии.
10.1. Методы ионизации: электронный удар, фотоионизация, электростатическое неоднородное поле, химическая ионизация. Комбинированные методы. Ионный ток и сечение ионизации. Зависимость сечения ионизации от энергии ионизирующих электронов (от ускоряющего потенциала). Потенциалы появления ионов. Принципиальная схема масс-спектрометра Демпстера. Вертикальные и адиабатические электронные переходы.
10.2. Принципиальная схема масс-спектрометра Демпстера. Фокусирующее действие однородного поперечного магнитного поля (фокусировка по направлению). Электростатическая фокусировка цилиндрическим конденсатором (фильтрация ионов по энергии). Двойная фокусировка. Разрешающая сила масс-спектрометра. Ионный источник. Система напуска. Молекулярное течение газа.
10.3. Типы ионов в масс-спектрометрах: молекулярные, осколочные, метастабильные, перегруппировочные, многозарядные и отрицательные. Диссоциативная ионизация. Динамические масс-спектрометры. Времяпролетный масс-спектрометр. Квадрупольный масс-спектрометр (фильтрат масс). Спектрометр ион-циклотронного резонанса.
10.4. Применение масс-спектрометрии в химии. Идентификация веществ. Роль разрешения, потенциалов появления, методов ионизации, метастабильных ионов в идентификации веществ. Таблицы массовых чисел. Соотношение изотопов. Корреляция между молекулярной структурой и масс-спектрами. Измерение потенциалов появления ионов и определение потенциалов ионизации и энергии разрыва связей. Преимущества фотоионизации.
10.5. Масс-спектральные термодинамические исследования. Определение парциальных давлений компонентов газовых смесей. Условия испарения вещества. Диффузионная ячейка Кнудсена. Связь ионного тока с парциальным давлением пара в ячейке Кнудсена. Определение теплоты сублимации веществ, теплоты реакции и константы равновесия. Проблема расшифровки масс-спектра.
|
|
11. Дополнительные вопросы для получения превосходной оценки:
11.1. Общие принципы методов рентгеновской и фотоэлектронной спектроскопии. Параметры и структура спектров. Применение методов в химии.
11.2. Применение методов фотоэлектронной спектроскопии в химии. Структурно-аналитическое применение. Количественный анализ. Теоретическое моделирование и объяснение химических сдвигов. Определение химических элементов и энергий связи электронов на внешних и внутренних оболочках атомов. Применение метода для исследования твердых тел.
11.3. Спектроскопические и дифракционные методы. Соотношение амплитуд рассеяния в дифракционных методах. Области применения рентгенографии, электронографии и нейтронографии в химии.
Задачи
3. Структуры каких веществ изображены на рисунке? Назовите тип решётки, определите число формульных единиц, координационный полиэдр и координационные числа атомов.
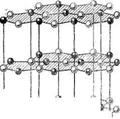
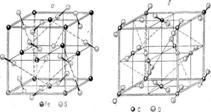

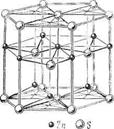
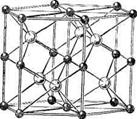
3. Структуры каких веществ изображены на рисунке?Назовите тип решётки, определите число формульных единиц, координационный полиэдр и координационные числа атомов.
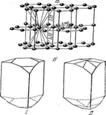
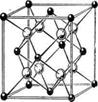
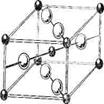



Подсказка:
Изображены структуры: графита P63/mmc, CaF2 (флюорита Fm3m,к.ч.=8,4, ThO2, Li2O, Na2O, Na2S); TiO2 (рутила P42/mnm к.ч.=6,3), Mg P63/mmc (α-Co, α-Be), Cu Fm3m (Au, Ag, Al, γ-Fe), α-Fe Im3m (Na, K, Ba), алмаза Fd3m, FeS2 (пирита Pa3 к.ч.=6,3), CO2 ( Pa3 к.ч.=2,1), ZnS (сфалерита F43m к.ч.=4и вюртцита P63mc к.ч.=4), NiAs (никелина P63/mmc к.ч.=6), BN (P6m2 к.ч.=3), NaCl (Fm3m к.ч.=6), CsCl ( Pm3m к.ч.=8), β-SiO2 (кристобалита Fd3m к.ч.=4,2,).
3. Привести общий вид ЭПР-спектра радикала CD3* и определить расстояние между линиями в его сверхтонкой структуре a D, если константа СТС а Ндля СН3* равна 2.25 мТ, а магнитные моменты ядер в единицах ядерного магнетона равны 2.792µяд (для водорода) и 0.857µяд, для дейтерия, I (2D) = 1.
3. Рассчитайте величины межплоскостных расстояний d и углов 2q для плоскостей с (hkl) = (111) и (200), полученных на рентгенограмме кубического кристалла с Р-решёткой и параметром а = 5.0 Å при съемке на CuKa-излучении (l = 1.5418 Å). Предскажите и схематически отобразите рентгенограмму для отражений до семейства плоскостей с (hkl) = (200).
|
|
3. Рассчитайте величины межплоскостных расстояний d и углов 2q для плоскостей с (hkl) = (222) и (321), полученных на рентгенограмме кубического кристалла с I-решёткой и параметром a = 6.0 Å при съемке на CuKa-излучении (l = 1.5418 Å). Предскажите и схематически отобразите рентгенограмму для отражений до семейства плоскостей с (hkl) = (222).
3. Параметр примитивной кубической ячейки US = 5.484 Å. На каких углах 2q с использованием CuKa – излучения (l = 1.5418 Å) могут быть зарегистрированы рефлексы для плоскостей (111), (220) и (400)?
3. Рентгенограммы поликристаллических веществ А и В с кубической структурой содержат разное количество пиков, поскольку вещество А имеет элементарную ячейку типа P, а вещество В ячейку типа I. Для какого из веществ в рентгенограмме меньше пиков и почему?
3. Рентгеновские исследования показали, что KSiH3 (М=70.18) с периодом решетки 7.15 Å имеет решётку типа NaCl с атомами калия и ионами SiH3- в узлах. Вычислите плотность кристалла. Рассчитайте расстояние в Å между ближайшими ионами K+ и SiH3- в решетке. Предскажите и схематически отобразите рентгенограмму до семейства плоскостей с (hkl) = (222) при использовании рентгеновских лучей с l=1.791 Å.
Атомная единица массы (а.е.м.) = 1.66×10-27 кг; NA = 6.022×1023 моль-1.
3. Приведите общий вид спектра ЭПР ион радикала пиридилия (C5H5N) -. Константы СТВ a (14N) равна 1,6 мТ, а для α-, β- и γ- протонов а Н имеют значения 0.128, 0.412 и 0.856 мТ, соответственно.
3. При облучении γ-излучением пентафторида фосфора при 300К образуются радикалы тетрафторида фосфора 3IPI9F4* (спины ядер 31Р и 19F равны 1/2). Эти радикалы дают ЭПР спектр с центром при 339.6 мТ в радиоспектрометре с рабочей частотой 9.5 ГГц, при этом a (31Р) = 135 мТ, a (19F ) = 20 мТ. Определите g-фактор образующихся радикалов и приведите общий вид ЭПР-спектра.
3. Изобразите спектр радикала *СН2ОН, если расстояние между пиками в дублете равно 0.12 мТ, а между центрами дублетов -1.8 мТ.
3. При облучении молекулярного водорода жестким УФ-излучением могут образовываться частицы различного состава и строения Н*, Н2+, Н3+, Н3. Как будут выглядеть их ЭПР-спектры и можно ли обнаружить их в смеси, если предположить, что указанные формы присутствуют в заметных концентрациях?
3. При взаимодействии ферроцена с сильными окислителями, например йодом, образуются, так называемые, комплексы с переносом заряда. Привести общий вид спектра ЭПР ион-радикала ферроцена (C5H5)2Fe -, т.е. определить количество линий и соотношение их интенсивностей. Будут ли все линии наблюдаться в прямом спектре?
3. В этиленовом радикале Н'Н''С=С*Н все протоны неэквивалентны. Константы сверхтонкого взаимодействия с протонами, соответственно, равны a (Н') = 3.42 мТ; a (Н'') = 6.85мТ; a (Н) = 1.57мТ. Привести ожидаемый спектр ЭПР.
|
|
3. Приведите общий вид спектра ЭПР соединений [V(NH3)6]Cl2, [Ti(NH3)4]Cl2 и K3(CoBr6) при слабом нулевом поле. Объясните причину парамагнетизма частиц. Спины ядер I (51V и 57Co) = 7/2, I (49Ti) = 5/2.
3. Приведите общий вид спектра ЭПР соединений K4(MnF6), K3(CrF6) и K4[Co(CN)6] при сильном нулевом поле. Объясните причину парамагнетизма частиц. Спины ядер I (51Mn) = 5/2, I (52Cr) = 0, I (57Co) = 7/2.
3. Приведите общий вид спектра ЭПР соединений [V(NH3)6]Cl2, [Ti(NH3)4]Cl2 и K3(CoBr6) при сильном нулевом поле. Объясните причину парамагнетизма частиц. Спины ядер I (51V и 57Co) = 7/2, I (49Ti) = 5/2.
3. Приведите общий вид спектра ПМР и соотношения интегральных интенсивностей в них для трех изомеров дихлорпропана С3Н6С12
3. Спектр ПМР соединения (С4Н8О3) представляет триплет, квадруплет и два синглета с отношением интегральных интенсивностей 3:2:2:1. Химические сдвиги мультиплетов составляют 1,1; 3,6; 4,2 и 11,1м.д. Изобразите общий вид такого спектра и определите структуру молекулы.
3. По спектру ПМР определить структуру соединения с брутто формулой C7H12O4.

3. Привести структуру одного из изомеров кислоты С3Н6ВгСООН в соответствии со спектром ПМР.

3. Какому из изомеров дихлорпропана принадлежит спектр?
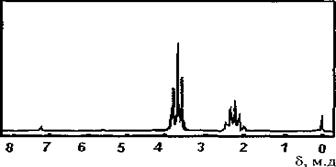
3. По спектру ПМР определить структуру соединения с брутто формулой C8H11NO.

3. В спектре ПМР смеси двух веществ (С2Н2Вг2) и (С2Н2С12) наблюдаются два синглета с соотношением интенсивностей 1:2. Каковы возможные структуры веществ и их мольные концентрации?
3. ПМР-спектр смеси, содержащей циклогексан, тетраметилсилан, хлороформ и бензол содержит четыре синглета одинаковой интенсивности с химическими сдвигами 0; 1,4; 7,2 и 7,4 м.д. Сделайте отнесение всех сигналов к конкретным веществам и определите количественный состав смеси.
3. Спектр ПМР низкого разрешения для соединения (C8H11NO) содержит четыре пика с соотношением интенсивностей 3:2:2:4. В спектре высокого разрешения эти пики представлены четырьмя мультиплетами: триплет (1.3 м.д.), синглет (3.2 м.д.), квадруплет (4.0) и мультиплет (6.5 м.д.). Определить структурную формулу молекулы.
3. Определите максимально заселенные вращательные состояния для молекул НCl, DCl, N2 и I2 при 300К. Постоянные Bе и aе равны, соответственно, 10.5909 и 0.3019, 5.445 и 0.112, 1.9983 и 0.0171, 0.0374 и 0.00012 см-1.
3. Во вращательном КР-спектре окиси углерода, возбуждаемом линией ртути lвозд = 4358 Å. получены линии со следующими волновыми числами: 22933.0; 22925.3; 22917.6 см-1. Определите вращательную постоянную Bо, момент инерции Iо и межъядерное расстояние rо. Постоянная αе = 0.0175 см-1.
Скорость света = 3×108м×сек-1; h = 6.6256×10-34Дж×сек. Атомная единица массы (а.е.м.) = 1.66×10-27 кг.
3. Найдите вращательные уровни энергии первых трех вращательных состояний молекулы HCl в см-1, кДж×моль-1 и эВ (Ве= 10.5909 см-1, aе = 0,3019 см-1, re = 1.2747Å). Основываясь на правилах отбора DJ, рассчитайте положение первых трех линий в ИК- и КР-вращательных спектрах молекулы и отобразите их на схеме (в см-1).
Скорость света = 3×108м×сек-1; h = 6.6256×10-34Дж×сек; h×с = 19.8768×10-26Дж×м.
Атомная единица массы (а.е.м.) = 1.66053886×10-27 кг; NA = 6.0221415×1023 моль-1; 1 эВ = 1.602177×10-19 Дж.
3. Найдите приближенно энергию диссоциации Do (в кДж×моль-1 и эВ) и относительное содержание молекул хлора (ωе = 564.9, ωехе = 4 см-1) в первом и втором возбужденных колебательных состояниях по отношению к основному при 298 и 500К?
Скорость света = 3×1010 см×сек-1; h = 6.6256×10-34Дж×сек; h×с = 19.8768×10-26Дж×м, R = 8.314472 Дж моль-1K-1,NA = 6.0221415×1023 моль-1; 1 эВ = 1.602177×10-19 Дж.
3. В ИК-спектре поглощения молекулы D37C1 наблюдается ряд колебательных полос поглощения с центрами при 2091.0, 4128.6 и 6112.8 см-1. Изобразите спектр с указанием интенсивности линий. Проведите отнесение колебательных полос к соответствующим колебательным переходам Δ υ. Определите энергию диссоциации Do (в кДж×моль-1), частоту колебания ɷe, постоянную ангармоничности ɷeхе и силовую постоянную kе молекулы D37C1.
Скорость света = 3×108м×сек-1; h = 6.6256×10-34Дж×сек; h×с = 19.8768×10-26Дж×м.
Атомная единица массы (а.е.м.) = 1.66053886×10-27 кг.
3. Отличаются ли энергии диссоциации (Dо) изотопных молекул Н2 и D2? Чему равна энергия диссоциации Dо изотопозамещенной молекулы в кДж×моль-1 и эВ? Частоты колебаний молекул Н2 и D2 равны соответственно ωе = 4396.55 и 3120 см-1, а wе·xe =118 и 59.4 см-1. Межъядерные расстояния в минимуме кривой потенциальной энергии одинаковы и равны 0.74 Å. Будут ли различия в колебательных и вращательных состояниях этих молекул, и каковы эти различия, если они есть?
3. В КР-спектре паров над треххлористым галлием GаС13 при 960°С, возбуждаемых линией 514.6 нм аргонового лазера, наблюдаются три линии: 518.0; 524.9 и 527.0 нм, относящиеся к основным колебаниям плоской симметричной модели молекулы GаС13. Определите частоты основных гармонических колебаний в см-1.
3. Интерпретируйте ИК-спектр соединения С4Н802 и определите его структуру.

3. Интерпретируйте ИК-спектр соединения С4Н802 и определите его структуру.
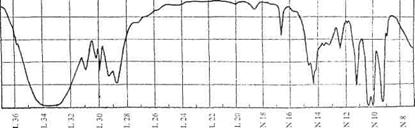
3. В спектре ЯКР на 14N в твердом пиридине C5H5N при 77К наблюдаются линии при 3.90 и 2.95 МГц. Найдите константу квадрупольного взаимодействия e2Qq и параметр асимметрии η.
3. Сколько переходов следует ожидать в спектре ЯКР на 57Co для твердых веществ K3[Co(CN)6] и K3(CoBr6)? Какова энергия квадрупольных переходов, выраженная в константах квадрупольного взаимодействия e2Qq. Природное содержание 57Co(I = 7/2) равно 100%. Эффект Штернгеймера отсутствует и η=0.
3. Определите структуру соединения I2Br2Cl4, если известно, что а) молекула I2С16 плоская и имеет МБ-спектр, содержащий один мультиплет с величиной ХС равной 3.50 мм/с, б) рассматриваемая молекула также плоская, но имеет спектр, содержащий два мультиплета с ХС 2.82 и 3.48 мм/с. Изобразите все возможные структуры плоской Молекулы I2Вг2С14 и методом исключения, основываясь на сравнении ХС спектров двух приведенных молекул, выберите искомую структуру.
3. Объясните почему МБ-спектр Na4[Fe(CN)6] представляет одиночную линию, а спектр Na2[Fe(CN)5NO] дублет? Каково соотношение интенсивностей пиков, чем его можно объяснить?
3. Изобразите структуру ядерных энергетических уровней и качественный вид спектра ЯГР при наличии квадрупольного расщепления (спин ядра 129I в основном состоянии равен 7/2, а возбужденном – 5/2).
3. Каков компонентный состав раствора (содержание В и С), если оптические плотности D(l), измеренные при l1 и l2 равны: D(l1) = 0.48 и D(l2) = 0.26. Значения экстинкции e(l) для вещества В составляют: e(l1) = 13250 и e(l2) = 890, а для вещества С: e (l1) = 480 и e(l2) = 43280 дм3× мол-1× см-1.
3. Какие изменения в УФ-спектре акролеина СН2=СН–СНО [lмакс= 203 нм (e = 12000), lмакс= 345 нм (e = 20)] следует ожидать при разбавлении его этанолом, содержащем следы кислоты.
3. Когда пловец ныряет на большие глубины, он входит в темный мир. Приняв, что средний коэффициент экстинкции морской воды в видимой области равен 6.2×10-5 дм3×моль-1×см-1, рассчитайте глубину, на которой до ныряльщика будет доходить половина света от поверхности.
3. Электронные спектры поглощения растворов о- и п-нитроанилинов в диапазоне длин волн 200-400 нм полностью перекрываются, хотя и имеют существенные различия в ε. Определите состав раствора, содержащего оба изомера, если значения оптической плотности раствора, измеренного при λ1=265 нм и λ2= 304 нм составляют Аλ1= 0.7476 и Аλ2 = 0.6358, соответственно. Коэффициенты поглощения о -изомера (lgε = 3.64 для λ1 и lgε = 2.43 для λ2), а п -изомера (lgε = 2.79 для λ1и lgε = 3.87 для λ2).
3. Вычислите значения мольных коэффициентов погашения для максимумов в УФ-спектре и в видимой области для окрашенного в красный цвет противоопухолевого антибиотика рубомицина М = 560.8. Спектр (рис.) получен для раствора 4.49 мг вещества в 250 мл этанола при толщине кюветы 10 мм.

3. УФ-спектр спектр поглощения 4-метилпентен-3-она-2 (окиси мезитила) [СНз-СО-СН=С(СН3)2] содержит два максимума, которые в зависимости от растворителя лежат в интервале 230-245 нм и 305-327 нм. В ряду н-гексан, этанол и вода длинноволновый максимум претерпевает гипсохромный сдвиг, а коротковолновый – батохромный сдвиг. Основываясь на этих фактах, отнесите оба максимума к конкретным типам переходов и приведите объяснения.
3. Если смешать два изотопных вещества 79Вг2 и 81Вг2, то масс-спектр смеси со временем будет меняться. Чем можно объяснить такие изменения, если реакция изотопного обмена имеет близкую к нулю энтальпию. В чем они проявятся.
3. Какие конкретно изменения (по сравнению с чистыми компонентами) будут происходить в масс-спектрах двухкомпонентной газовой смеси 16О2 и 17О2, если в ней происходят процессы изотопного обмена с константой реакции К = 1?
7.1. Рекомендуемая литература.
а) основная литература:
1. Пахомов Л.Г., Кирьянов К.В., Князев А.В. Физические методы в химических исследованиях. Учеб. пособие. Нижний Новгород.: Изд-во ННГУ. 2007. 286 с.
2. Пентин Ю.А., Вилков Л.В. Физические методы исследования в химии. М.: Мир. 2006. 683 с.
3. Вилков Л.В., Пентин Ю.А. Физические методы исследования в химии. Резонансные и электрооптические методы. М.: Высш. шк. 1989. 287 с. (уч. абон.-157экз.)
4. Пентин Ю.А., Вилков Л.В. Физические методы исследования в химии. М.: Мир. 2003. 683 с. (1047900хр)
5. Драго. Р. Физические методы в химии. М.: Мир. 1981. Т. 1. 422 с. Т. 2. 456 с. (ч.з. -7экз., 772183хр -3экз)
6. Смит А. Прикладная ИК- спектроскопия. М.: Мир. 1982. 327с. (791086хр -3экз)
7. Мальцев А.А. Молекулярная спектроскопия. М.: Изд-во МГУ. 1980. 271с. (4экз)
8. Бенуэлл К. Основы молекулярной спектроскопии М.:Мир. 1985.384 с.(839469хр -2экз)
9. Козицина Л.А., Куплетская Н.Б. Применение УФ-; ИК- и ЯМР-спектроскопии в органической химии. М.: Высш. шк. 1971. 264 с. (11экз.)
10. Вукс М.Ф. Электрические и оптические свойства молекул и конденсированных сред. Учеб. пособие. Л.: Изд-во Ленингр. ун-та. 1984. 334 с. (826139хр -2экз)
11. Порай-Кошиц М.А. Основы структурного анализа химических соединений. М.: Высш. шк. 1982. 152 с. (уч. абон. - 14 экз.)
12. Бокий Г.Б. Кристаллохимия. М.: Наука. 1971. 400 с. (уч. абон.- 60 экз.)
13. Зоркий П.М. Задачник по кристаллохимии и кристаллографии. М.: Изд-во Моск. ун-та. 1981. 232 с. (хр - 3экз.)
14. Зоркий П.М. Симметрия молекул и кристаллических структур. М.: Изд-во Моск. ун-та. 1986. 232 с.(842944хр - 2экз)
15. Ковба Л.М. Рентгенография в неорганической химии. М.: Изд-во МГУ. 1991.256 с. (уч. абон.-12экз.)
16. Терентьев П.Б. Масс-спектрометрия в органической химии. М.: Высшая школа. 1979. 223 с. (уч. абон.-10экз.)
б) дополнительная литература:
1. Пентин Ю.А., Вилков Л.В. Физические методы исследования в химии. Структурные методы и оптическая спектроскопия. М.: Высш. шк. 2002. 366 с.
2. Эткинс П., Саймоне М. Спектры ЭПР и строение неорганических радикалов М: Мир. 1970. 310 с. (489745ч.з. -2экз)
3. Сергеев Н.М. Спектроскопия ЯМР. Учеб. пособие. М.: Изд-во Моск. ун-та. 1981. 279 с. (уч. абон.-19экз.)
4. Гюнтер X. Введение в курс спектроскопии ЯМР. М.: Мир. 1984. 478 с. (816593 -2экз)
5. Семин Г.К., Бабушкина Т.А., Якобсон Г.Г. Применение ядерного квадрупольного резонанса в химии. Л.: Химия. 1972. 536 с. (582453хр - 3экз)
6. Вертхейм Г. Эффект Мессбауэра. М.: Мир. 1966. 172 с.(350819 ч.з. - 4экз)
7. Гольданский В.И. Эффект Мессбауэра и его применение в химии. М.: АН СССР. 1963. 83 с. (280890 ч.з. - 2экз)
8. Тюлин В.И. Колебательные и вращательные спектры многоатомных молекул. М.: Изд-во Моск. ун-та. 1987. 204 с. (864493хр - 2экз)
9. Беллами Л. Инфракрасные спектры сложных молекул. М.: Мир. 1963. 590 с. (282998хр - 2экз)
10. БелламиЛ. Новые данные по инфракрасным спектрам сложных молекул. М.:Мир. 1971. 318 с. (534251 ч.з. -3экз)
11. Кесслер И. Методы инфракрасной спектроскопии в химическом анализе. М.: Мир. 1964. 287 с. (293533 ч.з. - 3экз)
12. Коптев Г.С., Пентин Ю.А.Расчет колебаний молекул.М.: Изд-во Моск.ун-та.1977. 208 с.
13. Накамото К. ИК- спектры и спектры КР неорганических и координационных соединений. М.: Мир. 1966. 411 с. (926695хр - 3экз)
14. Нефедов В.И., Вовна В.И. Электронная структура химических соединений. М.: Наука. 1987. 197 с. (895831хр -1экз)
15. Свердлова О.В. Электронные спектры в органической химии. Л-д.: Химия. 1973. 248 с. (2экз)
16. Свердлова О.В. Электронные спектры в органической химии. Л-д.: Химия. 1985. 248 с. (833456хр - 2экз)
17. Уитли П. Определение молекулярной структуры. М.: Мир. 1970. 296 с. (511268 ч.з. -1экз)
18. Миронов В.А., Янковский С.А. Спектроскопия в органической химии. Сборник задач. М.: Химия. 1985. 230 с. (уч. абон. - 4экз.)
19. Толмачев В.Н. Электронные спектры поглощения органических соединений и их измерение. Харьков.: Изд-во Харьков. Гос.ун-та. 1974. 161 с. (631363хр - 2экз)
20. Сысоев А.А. Чупакин М.С.Введение в масс-спектрометрию. М.: Атомиздат.1977. 302 с. (685086хр -4экз)
21. Зенкевич И.Г., Иоффе Б.В. Интерпретация масс-спектров органических соединений. Л.: Химия. 1986. 174 с. (уч.абон.- экз.)
22. Вульфсон Н.С., Заикин В.Г., Микая А.И. Масс-спектрометрия органических соединений. М.: Химия. 1986. 312с. (841109 ч.з. - 3экз)
23. Уэллс А. Структурная неорганическая химия. В 3 т. М.: Мир. 1987-1988. Т. 1,2,3. (3 экз)
24. Минкин В.И., Осипов О.А., Жданов Ю.А. Дипольные моменты в органической химии. Л.: Химия. 1968. 246 с. (425258хр -1экз)
25. Верещагин А.Н. Поляризуемость молекул. М.: Наука. 1980. 177 с. (756961хр -2экз)
26. Вилков Л.В., Мастрюков B.C., Садова Н.И. Определение геометрического строения свободных молекул. Л.: Химия. 1978. 224 с. (728647хр -5экз)
27. Вертц Дж., Болтон Дж.Теория и практика приложения метода ЭПР. М.: Мир.1975. 374 с. (нет)
28. Грознер У. Мессбауэровская спектроскопия. М.: Мир. 1983 256 с. (нет)
29. Горохов Л.И. Масс-спектрометрия в неорганической химии. М.: Знание.1984. 254 с. (списан)
Общая характеристика и классификация методов исследования.
1.1. Общая характеристика физических методов исследования. Взаимодействие излучения с веществом. Классификация методов по областям электромагнитного излучения. Способы изображения спектра электромагнитного излучения в методах исследования.
1.2 Возможности методов и области их применения. Чувствительность, разрешающая способность и характеристическое время метода. Энергетические характеристики методов. Прямая и обратная задачи. Понятие корректно и некорректно поставленных задач.
|
|
|

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!