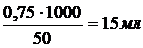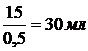Лабораторная работа № 1
Определение процентного содержания бария в хлориде бария
Ион Ba2+ образует много труднорастворимых солей, однако наименее растворимой и поэтому пригодной в качестве осаждаемой формы является сульфат бария BaSO4 (ПР=1,1·10-10). Так как при прокаливании состав BaSO4 не изменяется, то BaSO4 является и весовой формой. Осадок BaSO4 является мелкокристаллическим и иногда проходит сквозь поры фильтра, что искажает результат анализа. Для получения более крупных кристаллов при осаждении его нужно повысить растворимость вещества, а для этого следует соблюдать следующие условия:
а) навеску BaCl2·2H2O растворить в большом объеме воды (сильно разбавить);
б) раствор осадителя (2 н. H2SO4) также сильно разбавить водой;
в) перед осаждением растворы соли и кислоты нагреть почти до кипения;
г) осадитель приливать к раствору соли по каплям, постоянно перемешивая палочкой;
д) фильтрование проводить не сразу, а по истечении нескольких часов (в это время происходит "созревание", укрупнение осадка).
При осаждении в таких условиях осадок получается более чистым, свободным от соосажденных примесей. Практически полное осаждение иона бария достигается добавлением полуторного избытка осадителя.
Приступая к выполнению анализа, нужно внимательно прочитать ход анализа, приготовить и тщательно вымыть всю необходимую посуду: стаканы на 200 мл и 100 мл "с носиком"; стеклянную палочку, стаканчик для взятия навески, воронку, фильтр типа "синяя лента" (мелкопористый, беззольный), штатив с кольцом, фарфоровый тигель, эксикатор, промывалку с дистиллированной водой.
План работы
1. Доведение тигля до постоянной массы
Пустой фарфоровый тигель нужно довести до постоянной массы: взвесить его на аналитических весах; поставить прокаливать в муфельную печь при температуре 900-1000°С на один час; вынуть его тигельными щипцами, слегка охладить на воздухе на фарфоровой подставке, а потом поставить охлаждаться до комнатной температуры в эксикатор (если крышка эксикатора холодная, то и тигель охладился); взвесить снова тигель на тех же весах (тигель брать только щипцами); снова поставить его в печь на 15-30 минут, охладить, взвесить. Все значения масс записать в лабораторный журнал. Например,
Масса пустого тигля: 1 взвешивание 12,2300 г
2 взвешивание 12,2233 г
3 взвешивание 12,2231 г
Постоянная масса пустого тигля 12,2231 г
Массу тигля можно считать постоянной, когда результаты двух последних взвешиваний будут отличаться не более чем на 0,0002 г. Хранить тигель в эксикаторе
2. Взять навеску исходного вещества хлорида бария (m(BaCl2·2H2O)). Так как BaSO4 – кристаллический осадок, то нужно взять около 0,5 г препарата (масса осадка BaSO4 тоже будет около 0,5 г); Взвесить на техно-химических весах, а затем и на аналитических весах сухой чистый стаканчик, получить в него соль бария и снова взвесить на аналитических весах (все взвешивать на одних и тех же весах!). По разности масс стаканчика с солью и пустого стаканчика определить массу навески (m(BaCl2·2H2O)).
3. Перенести количественную навеску в стакан на 200 мл дистиллированной водой, растворить её и довести объем раствора приблизительно до 100,00 мл добавить 3-5 мл 2 н. HCl.
4. Рассчитать объем 2 н. раствора H2SO4, необходимый для полного осаждения иона бария по реакции


244,3 г/моль – 98 г/моль – 1000 МЛ
0,5 г x мл
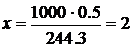 мл.
мл.
Увеличить объем в 1,5 раза: 2 мл · 1,5=3 мл
5. Отмерить мерным цилиндром 3 мл 2 н. H2SO4, перелить в стакан на 100 мл, разбавить дистиллированной приблизительно до 30-50 мл.
6. Осадить ион бария следующим образом: нагреть почти до кипения стаканы с растворами хлорида бария и серной кислоты: приливать медленно по каплям по стеклянной палочке почти всю серную кислоту к раствору соли (все время перемешивать не касаясь дна и стенок стакана). Дать осадку отстояться и прилить по стенке 1-2 капли оставшегося раствора серной кислоты, чтобы убедиться, что ион бария полностью осажден. Накрыть стакан бумагой, наколов её на палочку (на бумаге написать свою фамилию и группу), оставить осадок до следующего занятия.
Внимание! Палочку из стакана вынимать и класть на стол нельзя, так как к ней прилипли частицы осадка.
7. Отфильтровать осадок следующим образом:
а) сложить вчетверо фильтр «синяя лента» и подогнать его к сухой воронке, (воронку подбирают с таким расчетом, чтобы фильтр не доходил до краев её на 5-15 мм), так, чтобы он плотно подходил к стенкам её, затем налить в него дистиллированной воды и подогнать фильтр к стенкам воронки (так, как показано на плакате), осторожно, чтобы не порвать фильтр. Если фильтр хорошо подогнан к воронке, то носик воронки заполнится водой и фильтрование будет проходить быстрее. Воронку с фильтром поместить в кольцо штатива и подставить под неё чистый стакан;
б) потереть пальцем под "носиком" стакана с осадком (он не будет смачиваться водой, и капли фильтруемой жидкости по внешней стенке стакана стекать не будут); осадок не взмучивать, осторожно по палочке сливать прозрачный раствор на фильтр, заполняя его не более чем на 2/3. Поднимать стакан тоже по палочке, тогда раствор не будет попадать на внешнюю сторону стакана (смотрите плакат). Палочка должна находиться только над фильтром или в стакане, нельзя дотрагиваться ею до фильтра. Таким образом отфильтровать почти весь раствор с осадка, стараясь меньше взмучивать его. Такой метод фильтрования и промывания осадка называется "декантацией". Проверить, не прошли ли частички осадка через поры фильтра. Для этого фильтрат в стакане раскрутить и посмотреть на темном фоне. Если осадка в фильтрате нет, вылить его.
8. Промыть осадок 3-4 раза декантацией промывной жидкостью (около 5 мл 2 н. HCl на 100 мл воды) порциями по 10-15 мл. прилить порцию промывной жидкости, перемешать осадок, дать отстояться и фильтровать.
9. Перенести осадок на фильтр дистиллированной водой: прилить 10-15 мл воды, перемешать и фильтровать, повторить эту операцию пока весь осадок не окажется на фильтре (осторожно, не допускайте разбрызгивания жидкости с осадком и не забывайте проверять фильтрат на наличие осадка).
Оставшиеся в стакане частички осадка собрать кусочком фильтровальной бумаги с помощью палочки и эту бумагу положить в фильтр и струей воды из промывалки смыть осадок в центр фильтра.
10. Высушить фильтр на воронке в сушильном шкафу до слегка влажного состояния, свернуть его так, чтобы осадок оказался внутри, поместить в доведенный до постоянной массы тигель и поставить под тягу на электрическую плитку для обугливания (фильтр нее должен гореть пламенем). Обугливание закончено когда фильтр уже не дымит.
Поставить тигель с осадком прокаливаться в муфельную печь на 1,5-2,0 часа. Остудить в эксикаторе, взвесить. Поставить в печь еще раз на 15-20 минут и снова взвесить охлажденный тигель. (Внимание! Брать тигель только щипцами). Повторять прокаливание и взвешивание до постоянной массы. Все результаты взвешивания записывать в журнал.
11. Найти массу BaSO4 (m(BaSO4)) по разности масс тигля с осадком и пустого тигля.
Пример.
Масса тигля с BaSO4: 1 взвешивание - 12,6890 г
2-е взвешивание - 12,6878 г
3-е взвешивание - 12,6876 г
Постоянная масса тигля с осадком BaSO4 - 12.6876 г
Постоянная масса пустого тигля – 12,2231 г.
Постоянная масса осадка BaSO4(m(BaSO4) – 0,4645 г.
12. Рассчитать результаты анализа, составив пропорцию:
в 233,4 г BaSO4 содержится 137,3 г Ва,
в m(BaSO4) г содержится x г Ва

Вычислить процентное содержание бария в навеске хлорида бария:

Расчет также можно вести по формуле:
 ,
,
где F – фактор пересчета, равный отношению молярных масс определяемого вещества (Ва) к молярной массе весовой формы  . В нашем случае F=137,3/233,4=0,5883
. В нашем случае F=137,3/233,4=0,5883
13. Показать результат анализа преподавателю, составить подробный отчет о работе.
4.2. Задачи и примеры решений.
I. Расчет навески
Навеской называют небольшое количество (0,1-1,0 г) образца анализируемого вещества, которое точно взвешивают и далее количественно подвергают всем аналитическим операциям.
Если определяемую составную часть навески превращают в осаждаемую форму, то навеска должна быть такой величины, чтобы массы полученной осаждаемой формы были равны, в зависимости от формы осадка, (г):
аморфный (гидроксиды) – 0,07-0,1;
кристаллический легкий (большинство солей) – 0,1-0,15;
кристаллический тяжёлый (BaSO4) – 0,2-0,4;
кристаллический очень тяжёлый (PbSO4, AgCl) – до 0,5.
Величина навески рассчитывается приближенно.
Примеры:
1). Какую навеску каменного угля, содержащего около 4% серы, следует взять для анализа на содержание серы, если её определяют в виде BaSO4,?
Решение: Масса BaSO4 должна быть около 0,3 г. Тогда масса серы (x) в BaSO4 равна:
М(BaSO4)=233 г/моль – М(S)=32 г/моль
0,3 г - х

Масса навески каменного угля равна:
0,04×100% = 4%×y; y»1 г
Ответ: 1 г.
2). Какую навеску CuSO4×5H2O следует взять для анализа на содержание меди, если её определяют в виде CuO после осаждения гидроксида?
Решение:
М(CuO)=80 г/моль – М(CuSO4×5H2O)=250 г/моль
0,1 г - х

Ответ: 0,3 г.
1. Рассчитать навеску сульфида железа, содержащего около 30% серы, для определения в нём серы в виде BaSO4.
2. Какую навеску BaCl2×2H2O следует взять для анализа на содержание бария, если его определяют в виде BaSO4?
3. Какую навеску железной проволоки, содержащей около 98% железа, следует взять для определения железа, если его осаждают в виде Fe(OH)3?
4. Какую навеску железной руды, содержащей около 70% железа, следует взять для определения железа, осаждаемого в виде Fe(OH)3?
5. Какую навеску сидерита надо взять для анализа на содержание железа, если образец содержит около 75% FeCO3, а осаждаемая форма Fe(OH)3?
6. Рассчитать навеску известняка, содержащего около 8% примесей, для анализа на содержание CaCO3, если осаждаемая форма CaC2O4×H2O.
7. Рассчитать навеску кальцита для анализа на содержание кальция, если кальций осаждают в виде CaC2O4×H2O, а кальцит почти не содержит примесей.
8. Рассчитать навеску мрамора для анализа на содержание в ней кальция в виде CaO.
9. Образец гашеной извести содержит около 15% примесей. Какую навеску извести следует взять для определения в ней Ca в виде CaO?
10. Рассчитать навеску технической поваренной соли, содержащей около 6% примесей, для анализа на содержание хлора в виде AgCl.
11. Масса прокаленного осадка BaSO4 составила 0,4128 г. Какова масса навески химически чистого FeS, из которой получен осадок BaSO4.
12. Какова должна быть масса навески химически чистого железа, чтобы масса прокаленного осадка Fe2O3 составила 0,4136 г?
13. Сульфат алюминия содержит 88% Al2(SO4)3×18H2O. Рассчитать навеску, необходимую для определения алюминия в виде Al2O3, если масса Al2O3 0,1 г.
14. Сколько мл раствора HCl (r=1,028) необходимо для осаждения серебра, если на приготовление раствора взяли 1,5 г сплава, содержащего 10% серебра?
15. 2 г сплава, содержащего около 70% серебра, растворили. Раствор довели до 500 мл. Сколько мл раствора HCl (r=1,018) необходимо для осаждения серебра из 25 мл приготовленного раствора.
II. Расчёт осадителя
Расчёт количества осадителя относится к предварительным вычислениям и поэтому проводится приблизительно. Теоретической основой является закон эквивалентов. На основании которого получаем формулу:
 , где х – масса осадителя (г); Эос – эквивалент осадителя; Э – эквивалент осаждаемого вещества; m – масса навески осаждаемого вещества.
, где х – масса осадителя (г); Эос – эквивалент осадителя; Э – эквивалент осаждаемого вещества; m – масса навески осаждаемого вещества.
Если осадитель не 100%, а a%, то искомое весовое количество реактива (m¢), будет

Чтобы перейти к объёмным единицам, величину m¢ делят на плотность раствора (её можно принять за единицу). Чтобы реакция прошла до конца, раствора осадителя обычно берут в полтора раза больше. Если концентрация реактива (хмл) 1 н., то объём его находят по формуле
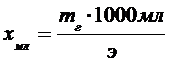
Если концентрация реактива не 1н., то найденный объём изменяют обратно пропорционально его концентрации.
Пример:
Какой объём 0,5 н. раствора (NH4)2C2O4×H2O нужен, чтобы количественно осадить кальций из раствора, приготовленного из 1 г мела, содержащего 25% влаги и нерастворимых примесей.
Решение:
1). Найдём массу чистого CaCO3 в навеске
 1 г – 100%
1 г – 100%

х - 75%
2). Найдём эквиваленты CaCO3 и осадителя.
Э(CaCO3)=  ; Э((NH4)2C2O4×H2O=
; Э((NH4)2C2O4×H2O=  .
.
3). Найдём объём 1 н. раствора осадителя
 50 г - 1000 мл×(1 н)
50 г - 1000 мл×(1 н)
y= 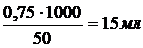
0,75 г - y мл×(1н)
4). Объём 0,5 н раствора равен 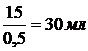
5). С учётом увеличения в полтора раза: 30×1,5=45 мл.
Ответ: 45 мл.
1. Какой объём (с учётом избытка) 1 н. раствора HCl потребуется для осаждения Ag+ из раствора, полученного растворением 1 г серебра?
2. Какой объём 2 н. раствора аммиака следует взять, чтобы осадить Fe3+ из раствора, содержащего 0,2 г железа.
3. Какой объём 2 н. H2SO4 потребуется, чтобы осадить барий из раствора, содержащего 0,6 г BaCl2×2H2O?
4. Какой объём 1 н. раствора H2SO4 пойдет на осаждение бария из раствора, полученного растворением 0,9 г BaCl2×2H2O c 40% примесей?
5. Какой объём 4 н. раствора Na2HPO4 пойдёт на осаждение магния из раствора, полученного растворением 0,4 г сплава с 60% Mg?
6. Какой объём 0,2 н раствора H2C2O4 пойдёт на осаждение кальция, если исходить из того, что для приготовления раствора взяли 0,6 г мрамора?
7. Сколько граммов H2C2O4×2H2O требуется для полного осаждения кальция из 50 мл, полученного растворением 1 г мрамора в 250 мл раствора?
8. Какой объём 0,5 н. раствора хлорида бария потребуется для осаждения бария в виде BaSO4 из раствора, полученного после соответствующей обработки из 1,5 г каменного угля, если он содержит около 2% серы?
9. Какой объём 10%-ного раствора аммиака следует взять для осаждения 0,15 г железа?
10. Какой объём 5%-ного раствора аммиака следует взять для осаждения железа, если на приготовление раствора взяли 0,3 г Fe2O3, содержащего около 10% пустой породы?
11. Какой объём 10%-ного раствора аммиака потребуется для осаждения железа, если на приготовление раствора взяли 0,4 г Fe3O4?
12. Какой объём 7%-ного Na2HPO4×12H2O потребуется для осаждения магния из раствора 0,4 г MgSO4×7HO (плотность принять 1)?
13. Сколько мл раствора аммиака (r=0,980 г/мл) потребуется для количественного осаждения железа, если на приготовление раствора взяли 0,2 г шпатового железняка, содержащего 30% железа?
14. Сколько мл раствора HCl (r=1,028 г/мл) необходимо для осаждения серебра, если на приготовление раствора взяли 1,5 г сплава, содержащего 10% серебра?
15. 2 г сплава содержащего около 70% серебра растворили. Раствор довели до 500 мл. Сколько мл раствора HCl (r=1,018 г/мл) необходимо для осаждения серебра из 25 мл приготовленного раствора?





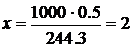 мл.
мл.

 ,
, . В нашем случае F=137,3/233,4=0,5883
. В нашем случае F=137,3/233,4=0,5883

 , где х – масса осадителя (г); Эос – эквивалент осадителя; Э – эквивалент осаждаемого вещества; m – масса навески осаждаемого вещества.
, где х – масса осадителя (г); Эос – эквивалент осадителя; Э – эквивалент осаждаемого вещества; m – масса навески осаждаемого вещества.
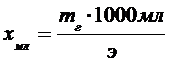
 1 г – 100%
1 г – 100%
 ; Э((NH4)2C2O4×H2O=
; Э((NH4)2C2O4×H2O=  .
. 50 г - 1000 мл×(1 н)
50 г - 1000 мл×(1 н)