Методы объемного анализа, в которых применяются реакции окисления и восстановления веществ, называются методами окисления-восстановления или редоксиметрии. Характерной особеностью окислительно-восстанови-тельных реакций (ОВР) является переход электронов между реагирующими частицами. Частицу, принимающую электрон, называют окислителем, а частицу, отдающую электрон - восстановителем.
Например, в реакции:
MnO4- + Fe2+ + 8H+ → Mn2+ + Fe3+ + 4H2O (1)
электроны от иона Fe2+ переходят к иону MnO4-. В результате этого степень окисления Mn+7 уменьшается до Mn2+, а степень окисления железа (+2) увеличивается до степени окисления (+3). Ион MnO4- в данном случае является окислителем, а ион Fe2+ - восстановителем. Следовательно, процесс окисления одного вещества неразрывно связан с восстановлением другого. Каждую ОВР можно представить как сумму двух полуреакций, одна из которых отражает превращение окислителя в восстановитель, а другая - восстановителя в окислитель. В реакции (1) уравнение полуреакций с окислителем имеет вид:
MnO4- + 8H+ + 5e = Mn2+ + 4H2O (1.1)
а с восстановителем:
Fe2+ - e = Fe3+ (1.2)
Суммирование уравнений (1.1) и (1.2) дает уравнение (1). При суммировании необходимо предусмотреть, чтобы в соответствии с законом электронейтральности раствора число электронов, отдаваемых восстановителем, было равно числу электронов, принимаемых окислителем.
Количественно силу окислителя и восстановителя оценивают по величине окислительно-восстановительного потенциала – ОВП (φ0, φ или φ0ОХ/RED, где ОХ – окисленная форма а RED – восстановленная форма). Чем больше величина ОВП, тем большими окислительными свойствами обладает окисленная форма, а чем меньше величина ОВП, тем большими восстановительными свойствами обладает восстановленная форма.
Чем сильнее указанный окислитель, тем слабее сопряженный с ним восстановитель, и наоборот. Когда комбинируются две какие-либо окислительно-восстановительные пары, то более сильный из двух окислителей отнимает электроны у более сильного восстановителя, причем образуется более слабый окислитель и восстановитель. Например, в случае пар Cl2/2Cl- и Fe3+/Fe2+ более сильным окислителем является Cl2, т.к.  , а более сильным восстановителем являются ионы Fe2+, т.к.
, а более сильным восстановителем являются ионы Fe2+, т.к. 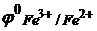 = +0,77 В. Поэтому реакция между указанными парами протекает в направлении:
= +0,77 В. Поэтому реакция между указанными парами протекает в направлении:
Сl2 + 2Fe2+ → 2Cl- + 2Fe3+
В сторону образования более слабого восстановителя (Сl-) и окислителя (Fe3+), чем исходные.
Окислители с большим значением ОВП, способны окислять любой из восстановителей с меньшим потенциалом, а восстановители с меньшим потенциалом способны восстанавливать окислители с большим потенциалом.
Например, ионы Cr2O72- в кислой среде (φ0 Cr2O72- + 14Н+ + 6е/2Сr3+ + 7H2O = 1,36 В) могут окислять все восстановители с меньшими значениями ОВП – I-, SO32-, S2O32-, Sn2+, S2-. Но ионы Cr2O72- не могут окислить Mn2+ в MnO4-, однако ионы Cr3+ cпособны восстановить ионы MnO4- в ионы Mn2+. Учитывая вышесказанное, можно, пользуясь таблицей ОВП (φ0) при стандартных условиях, предвидеть направление течения ОВР.
Следует учитывать, что изменение некоторых условий протекания реакций, которые влияют на величину ОВП, может привести к изменению соотношения потенциалов окислительно-восстановительных пар, и реакция, невозможная в стандартных условиях (когда ∆G0>0), будет возможна в соответствующих условиях (когда ΔG<0). Зависимость ОВП от температуры и концентрации компонентов окислительно-восстановительной системы выражается формулой Нернста:
φОХ/RED = φ0ОХ/RED + 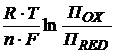 , (2)
, (2)
где ПОХ – произведение концентраций всех компонентов окислительно-
восстановительной системы, находящихся в одной части схемы с окисленной формой, причем концентрация каждого компонента берется в степени, равной стехиометрическому коэффициенту, стоящему перед формулой соответствующего компонента;
ПRED – соответственно то же для компонентов, находящихся в одной
части схемы с восстановленной формой. Концентрации трудно-
растворимых и газообразных веществ и воды не входят в эти
произведения;
R – газовая постоянная, 8,31 Дж/моль·К;
T – абсолютная температура, К;
F – число Фарадея, 96500 кулонов;
n – количество электронов окислительно-восстановительной системы.
Преобразованная формула Нернста имеет вид:
φОХ/RED = φ0ОХ/RED + 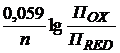 , (3)
, (3)
Например, для реакции (1) формула Нернста будет такой:

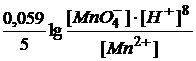
ОВР протекает слева направо когда:
а) Δφ0 или Δφ >0 (Δφ0 = φ0ок - φ0восс.; Δφ = φок - φвосс.);
б) ΔG0р-ии или ΔGр-ии <0
ΔG0р-ии = -n·F·(φ0оx - φ0RED.); ΔGр-ии = -n·F·(φоx - φRED).
Так как ОВР обратимы и вследствие этого устанавливается химическое равновесие, то для них можно рассчитать константу равновесия К:
lg K =  , (4)
, (4)
где n – число электронов.
Из формулы (4) видно, что константа равновесия должна быть тем больше, чем больше разность стандартных потенциалов окислительно-восстановительных пар. Если же эта разность велика, реакция идет практически до конца, а при малой разности потенциалов химическое превращение до конца не доходит.
К реакциям, применяемым в редоксиметрии, предъявляются те же требования, что и к любой реакции, используемой в объемном анализе, а именно:
а) возможность фиксирования точки эквивалентности;
б) большая скорость;
в) отсутствие побочных процессов;
г) практическая необратимость.
Для фиксирования точки эквивалентности применяются редокс-индикаторы, представляющие собой окислители или востановители, окисленные и восстановленные формы которых имеют различную окраску. При изменении потенциала в титруемом растворе меняется цвет индикатора. Выбирается тот индикатор, область перехода окраски которого (находится по формуле φ0 ± 0,059/п, где φ0 – стандартный окислительно-восстановительный потенциал индикатора; п – число отданных либо принятых электронов) совпадает со скачком потенциала на кривой титрования восстановителя окислителем либо наоборот.
Окислительно-восстановительные реакции обычно идут с меньшими скоростями, чем реакции, связанные со взаимодействием ионов. Для ускорения их приходится применять катализаторы или нагревание реакционной смеси.
Окислительно-восстановительные процессы часто проходят очень сложно, с побочными реакциями. Поэтому не всякую реакцию можно применить в методах редоксиметрии.
Окислительно-восстановительные процессы чаще всего обратимы. Для сдвига равновесия в нужную сторону используют или добавление избытка ионов водорода (если реакция идет с поглощением их), или увеличение концентрации одного из компонентов. Иногда применяются методы непрямого титрования: замещения или обратного титрования.
Редоксиметрия, в свою очередь, подразделяется на методы, различающиеся применяемым рабочим раствором. Наиболее употребительны из них:
а) перманганатометрия, использующая реакции окисления, производимые перманаганатом калия (KMnO4).
б) хроматометрия, использующая реакции окисления дихроматом калия (K2Cr2O7) в кислой среде.
в) броматометрия, использующая реакции окисления, производимые броматами (KBrO3) в кислой среде.
г) иодометрия, в основе которой лежат реакции окисления свободным иодом или восстановления иодид-ионами, и другие.
В случае окислительно-восстановительных процессов эквивалентом называют такую часть молекулы (иона, атома), на которую приходится один принимаемый или отдаваемый электрон в данной реакции. Формула эквивалента вещества А имеет вид 1/ZA, где 1/Z – фактор эквивалентности, а Z – число эквивалентности. Например для перманганата калия в кислой среде фактор эквивалентности равен 1/5, число эквивалентности – 5, а формула эквивалента 1/5 (KMnO4).
Метод перманганатометрии
В данном методе рабочим раствором является перманганат калия KMnO4. Ион перманганата (MnO4-) окисляет в кислой, щелочной и в нейтральной средах. В объемном анализе наибольшее применение имеет окисление в кислой среде, когда перманганат-ион восстанавливается до иона Mn2+ по уравнению:
MnO4- + 8H+ + 5e = Mn2+ + 4H2O
Молярная масса перманганата калия М(KMnO4) = 158,03 г/моль, а молярная масса эквивалента М(1/5KMnO4) = 1/5·М(KMnO4) = 31,61 г/моль. Окислительно-восстановительный потенциал данной системы находится по уравнению:
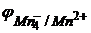 = 1,52 +0,059/5
= 1,52 +0,059/5 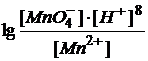
Видно, что величина потенциала зависит не только от концентраций ионов MnO4- и Mn2+, но и сильно зависит от концентрации ионов водорода.
Молярная масса эквивалента перманганата калия в нейтральной или слабо щелочной средах находится на основании уравнения:
MnO4- + 3H2О +3e = MnО(ОН)2 + 4OН- (5)
Т.е. MnO4- восстанавливается до MnO2, точнее до ее гидрата MnO(ОН)2, выпадающего в виде бурого осадка. Следовательно, молярная масса эквивалента KMnO4 равна 1/3·М(KMnO4) = 52,68 г/моль. Стандартный потенциал пары MnO4-/Mn2+ (1,52 В) гораздо выше стандартного потенциала пары MnO4-/MnО2 (0,59 В), поэтому окислительная сила перманганата в кислой среде выше, чем в нейтральной.
Титрование перманганатом может осуществляться прямым и косвенным способом. Прямым методом титрования определяют многие восстановители, которые легко и без потерь окисляются перманганатом. Обратное титрование обычно применяют для анализа восстановителей, которые взаимодействуют с перманганатом медленно. Для анализа окислителей методом перманганатометрии их предварительно восстанавливают до соединений низших степеней окисления.
Метод перманганатометрии имеет следующие достоинства:
1. Так как раствор перманганата окрашен в красно-фиолетовый цвет, то титрование можно проводить без индикатора. Точку эквивалентности фиксируют по появлению розовой окраски титруемого раствора при определении прямым методом или по исчезновению розовой окраски при титровании обратным методом.
2. Титрование перманганатом осуществляется в кислой или в щелочной средах.
3. Имея высокий окислительно-восстановительный потенциал, перманганат может окислять многие восстановители.
Недостатки метода:
1. Перманганат калия трудно получить в химически чистом состоянии, поэтому невозможно приготовить его раствор точной нормальности по навеске. Нормальность перманганата устанавливают по исходным веществам или готовят его раствор из фиксанала.
2. Растворы перманганата неустойчивы, со временем меняют свою нормальность в результате разложения KMnO4.
3. Титрование перманганатом, как правило, не рекомендуется проводить в присутствии хлорид-ионов, окисляющихся им до хлора.
4. Состояние динамических равновесий, устанавливающихся в процессе титрования перманганатом, зависит от различных факторов, поэтому определение необходимо проводить при строго определенных условиях, рекомендуемых методикой анализа.
Приготовление и хранение раствора KMnO4
Обычно при титровании перманганатом применяют 0,05н его раствор. Для приготовления 1 л 0,05н раствора перманганата калия, предназначенного для титрования в кислой среде, навеска рассчитывается по формуле:
m(KMnO4) = 1/5M(KMnO4)·0,05 = 1,5803 г
Если рабочий раствор KMnO4 предназначается для слабо щелочных или нейтральных растворов, то навеска его рассчитывается по формуле:
m(KMnO4) = 1/3M(KMnO4)·0,05 = 2,64 г
Навеску перманганата взвешивают на технических весах в стеклянном бюксе, растворяют в 1 л дистилированной воды, нагревают до кипения, охлаждают и оставляют в темной колбе с притертой пробкой до следующего занятия. Если в колбе при хранении образуется осадок MnO2, то раствор осторожно сливают с осадка или фильтруют через стеклополотно.
Точную нормальность раствора перманганата устанавливают по одному из исходных веществ: H2C2O4·2H2O; Na2C2O4; As2O3; K4[Fe(CN)6]·3H2O. Наиболее удобным является щавелевокислый натрий (оксалат натрия) (Na2C2O4). Очистка его легко достигается перекристаллизацией.
Техника безопасности
1. При выполнении работ, связанных с применением серной кислоты, соблюдать обычные меры предосторожности при работах с кислотами:
а) при попадании кислоты на кожу быстро смыть проточной водой и обработать 5%-ным раствором соды;
б) при попадании кислоты в глаза их нужно промыть большим количеством воды и обязательно обратиться к врачу.
2. При работе с мерной пипеткой для набора жидкости нужно пользоваться резиновой грушей, конец пипетки необходимо опускать глубоко в жидкость, чтобы не произошло засасывания её в грушу.
Лабораторные работы
Перманганатометрия
Лабораторная работа №1
1.1. Определение нормальности раствора Сн(Na2C2O4) на основании уравнения:
2MnO4- + 5C2O42- + 16H+ → 2Mn2+ + 10CO2 + 8H2O (6)KMnO4 по оксалату натрия
План работы
2. Приготовление раствора исходного вещества.
Вычислить навеску, необходимую для приготовления 100,0 мл 0,05 н раствора Na2C2O4. Молярная масса эквивалента оксалата натрия равна ½
и полуреакции:
С2О42- - 2е = 2СО2
½ М(Na2C2O4) = ½ 134,00 = 67,00 г/моль

где: Vм.к. – объем мерной колбы;
С(1/2Na2C2O4) – концентрация приготовляемого раствора;
½ М(Na2C2O4) – молярная масса эквивалента оксалата натрия.
2.1. На аналитических весах взять точную навеску около рассчитанного количества и перенести ее без потерь в мерную колбу на 100,0 мл одним из способов, описанных в методе нейтрализации, растворить в теплой дистилированной воде, охладить до комнатной температуры, довести раствор до метки и тщательно перемешать, предварительно закрыв колбу пробкой.
2.2. Вычислить титр и нормальность приготовленного раствра оксалата натрия по формулам: Т = m(Na2C2O4)/100 (г/мл)
C(½ Na2C2O4) = 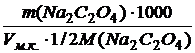
с точностью до четырех значащих цифр.
3. Определение нормальности KMnO4 по оксалату натрия
3.1. Заполнить бюретку на 25,00 мл раствором перманганата калия и установить уровень жидкости на нуле по верхнему мениску.
3.2. В две конические колбы для титрования на 250 мл отмерить пипеткой на 15,00 или 20,00 мл аликвоту раствора оксалата натрия.
3.3. В эти же колбы прилить цилиндром по 15 мл 2н. раствора серной кислоты (нужно добавлять достаточное количество кислоты, так как она нейтрализуется в процессе титрования). В случае недостатка кислоты во время титрования образуется бурый осадок MnO2, что недопустимо!
3.4. Реакция между перманганатом и оксалатом идет очень медленно. Для ускорения ее непосредственно перед титрованием содержимое каждой колбы нагреть почти до кипения (до 70-800С), но не давать кипеть, чтобы не произошло разложения щавелевой кислоты.
3.5. Титровать горячий раствор оксалата натрия перманганатом калия медленно, обесцвечивая каждую каплю. Первые капли KMnO4 обесцвечиваются медленно, но как только образуется немного ионов Mn2+, являющихся катализатором данной реакции, дальнейшее обесцвечивание происходит практически мгновенно. Нужно уловить момент, когда одна лишняя капля перманганата окрасит раствор в бледно-розовый цвет, не исчезающий в течение 30 сек. Записать полученный объем по бюретке (V1). Нагреть аликвоту оксалата во второй колбе и оттитровать таким же образом. Записать объем (V2) (разница между объемами не должна превышать 0,20 мл). Из двух отсчетов определить среднее арифметическое:
(V1 + V2)/2 = Vср.
2.6. Вычислить нормальность перманганата калия по формуле:
С(1/5 KMnO4) =  , моль/л
, моль/л
с точностью до четырех значащих цифр и показать результат преподавателю.
Лабораторная работа №2



 , а более сильным восстановителем являются ионы Fe2+, т.к.
, а более сильным восстановителем являются ионы Fe2+, т.к. 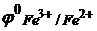 = +0,77 В. Поэтому реакция между указанными парами протекает в направлении:
= +0,77 В. Поэтому реакция между указанными парами протекает в направлении: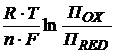 , (2)
, (2)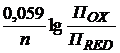 , (3)
, (3)
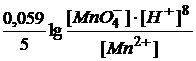
 , (4)
, (4)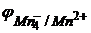 = 1,52 +0,059/5
= 1,52 +0,059/5 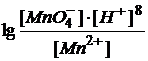

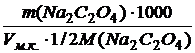
 , моль/л
, моль/л


