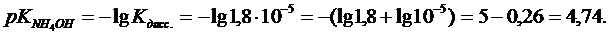а константа диссоциации Кд = 1,8 * 10-4.
Решение: Муравьиная кислота слабая, диссоциирует на ионы обратимо, поэтому концентрация ионов водорода не равна концентрации кислоты. [H+] находим из Кд(НСООН).
НСООН «Н+ + НСОО-
Кд = 
[H+] = [HCOO-], а [HCOOH]недис. » [HCOOH]исх.
1,8 * 10-4 =  [H+] =
[H+] = 
рН = -lg 2,68 * 10-3 = -(lg 2,68 + lg 10-3) = 3- 0,43 = 2,57
рОН = 11,43
Ответ: рН = 2,57; рОН = 11,43.
IV Вычислить рН и рОН растворов, если смешали:
1) 20 мл 0,1н HCl и 19 мл 0,1н NaOH
2) 19 мл 0,1н HCl и 20 мл 0,1н NaOH
3) 25 мл 0,2М HCl и 25 мл 0,1н NaOH
4) 10 мл 0,1н NH4OH и 15 мл 0,1н HCl
5) 10 мл 0,1н CH3COOH и 12 мл 0,1н NaOH
6) 5 мл 0,2н HCl и 20 мл 0,1н NaOH
7) 15 мл 0,1н CH3COOH и 15 мл 0,2н NaOH
8) 100 мл 0,1М CH3COOH и 100,1 мл 0,1М KOH
9) 99,9 мл 0,1М CH3COOH и 100 мл 0,1н KOH
10) 99,0 мл 0,2М CH3COOH и 99,9 мл 0,2н NaOH
11) 5 мл 0,1н HCOOH и 20 мл 0,01М NaOH
12) 10 мл 0,2н NaOH и 5 мл 0,2н HCOOH
13) 50 мл 0,1н NaOH и 50 мл 0,1н HCl
14) 100,1 мл 0,1н HCl и 100 мл 0,1М KOH
15) 50 мл 0,1н HCl и 49 мл 0,1н NH4OH
Пример: Вычислить рН и рОН раствора, если смешали 20,0 мл
М раствора NaOH и 19,0 мл 0,1 М
раствора CH3COOH.
Решение: Так как в растворе в избытке оказалось сильное основание, то оно и будет определять рН раствора, гидролизом ацетата натрия можно пренебречь. Находим [OH-]:
[OH-] = 
рОН = -lg2,56 * 10-3 = -(lg2,56 + lg 10-3) = 3-0,4 = 2,6
рН = 14 – 2,6 = 11,4 Ответ: рН = 11,4; рОН = 2,6;
V Вычислить рН и рОН растворов, если смешали:
1) 20 мл 0,1н HCl и 21 мл 0,1н NH4OH;
2) 20 мл 0,1н NH4OH и 19 мл 0,1н HCl;
3) 20 мл 0,1н CH3COOH и 18 мл 0,1н NaOH;
4) 15 мл 0,1н HCOOH и 10 мл 0,1н NaOH;
5) 15 мл 0,1н NH4OH и 10 мл 0,1н HCl;
6) 100,1 мл 0,2н NH4OH и 100 мл 0,2н HCl;
7) 100 мл 0,2н NH4OH и 99,9 мл 0,2н HNO3;
8) 50 мл 0,2н NH4OH и 40 мл 0,2н HNO3;
9) 50 мл 0,1н NaOH и 51 мл 0,1н HCOOH;
10) 10 мл 0,2н NaOH и 10 мл 0,2н HCOOH;
11) 25 мл 0,1н HF и 24 мл 0,1н KOH;
12) 50 мл 0,1н CH3COOH и 49 мл 0,1н NaOH;
13) 100,1 мл 0,1н CH3COOH и 100 мл 0,1н KOH;
14) 100 мл 0,1н HNO2 и 99 мл 0,1н KOH;
15) 100 мл 0,2н HCOOH и 99,9 мл 0,2н NaOH;
Пример: Вычислить рН и рОН раствора, если смешали 15 мл
0,1 н раствора НСl и 20 мл. 0,1 н. NH4ОН.
Решение: так как слабое основание взято в избытке, то в растворе в результате образуется щелочная буферная смесь
HCl + NH4ОН ® NH4Cl+ Н2О + (NH4ОН)
0,1*15 0,1*20 0,1*15 избыток
рН этой смеси расчитывается по формуле:
рН = 14 - рК NH4ОН + lg(Cосн/Ссоли)
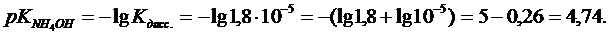
Так как под логарифмом стоит отношение концентраций, то вместо этих концентраций логично поставить объемы.
рН = 14 - 4,74 + lg(5/15) = 9,26 + lg3,3*10-1 = 9,26 - 0,48 = 8,78,
где lg3,3*10-1 = (lg3,3 + lg10-1) = -1 + 0,52 = - 0,48
рОН = 14 - 8,78 = 5,22
Ответ: рН = 8,78; рОН = 5,22
VI Выбрать индикатор для титрования раствора (1) рабочим
раствором (2):
1) (1) 0,1н NaOH; (2) 0,1н HCl
2) (1) 0,1н NaOH; (2) 0,1н HNO3
3) (1) 0,2н HCl; (2) 0,2н KOH
4) (1) 0,1н NH4OH; (2) 0,1н HNO3
5) (1) 0,2н NH4OH; (2) 0,2н HCl
6) (1) 0,1н HNO2; (2) 0,1н KOH
7) (1) 0,2н HNO2; (2) 0,2н HCl
8) (1) 0,01н NH4OH; (2) 0,01н HCl
9) (1) 0,01н HCOOH; (2) 0,01н КОН
10) (1) 0,2н HCOOH; (2) 0,2н NaOH
11) (1) 0,01н NaOH; (2) 0,01н CH3COOH
12) (1) 0,01н KOH; (2) 0,01н CH3COOH
13) (1) 0,2н KOH; (2) 0,2 н CH3COOH
14) (1) 1н KOH; (2) 1н CH3COOH
15) (1) 1н HCOOH; (2) 1н NaOH
Пример 1: Выбрать индикатор для титрования 0,01 н. раствора
NaОН 0,01 М раствором HСl.
Решение: рабочий раствор - сильная кислота и определяемое вещество - сильное основание.
Для выбора индикатора нужно на кривой титрования найти рН двух точек - начала скачка и конца скачка.
а) начало скачка на кривой титрования - недотитровано 0,1% от объема титруемого раствора NaОН. Так как объем не задан, то берем 100 мл. В начале недотитрована щелочь, поэтому находим концентрацию [ОН-]:
[ОН-] = (0,01·100 - 0,01· 99,9)/ 100 = 1*10-5 моль
(принебрегаем изменением объема смеси)
рОН = 5; рН = 14 - 5 = 9
б) конец скачка - раствор перетритирован на 0,1% от объёма раствора NaOH, в избытке сильная кислота, находим концентрацию ионов водорода:
[Н+] = (0,01*100,1 - 0,01*100) / 100 =1*10-5 моль/л.
рН =5
Величина скачка от 9 до 5. В этом интервале происходит изменение окраски индикаторов: фенол-фталеина (рТ = 8), метилового красного (рТ=5,5, лакмуса (рТ=7). Каждый индикатор можно использовать для данного титрования.
Пример 2: Выбрать индикатор для титрования 0,1 М раствора
NH4ОН 0,1 м. раствором НCl.
Решение: рабочий раствор - сильная кислота, определяемое вещество - слабое основание.
а) Начало скачка на кривой титрования - в избытке раствор аммиака
NH4ОН + НCl = NH4Cl+ H2О + (NH4ОН)
100 мл. 99,9 мл. 99,9 мл. 0,1 мл. (избыток)
образуется аммиачная буферная смесь
рН = 14 - рК NH4ОН + lg(Сосн/Ссоли)
рН = 14 - 4,74 + lg(0,1/99,9) = 9,26 - 3 = 6,26
б) конец скачка - в избытке сильная кислота. Находим концентрацию ионов водорода:[Н+] = (0,1·100,1 - 0,1 ·100)/100 = 10-4 моль/л, рН = 4
Интервал скачка рН от 6,26 до 4.
4. В этом интервале происходит изменение окраски индикаторов метилового красного (рТ = 5,5) и метилового оранжевого (рТ = 4).
VII Вычислить эквивалентную массу вещества (А), которое
Титруется рабочим раствором (Б) в присутствии
индикатора (В):
1) (А) Na3PO4; (Б) HCl; (В) Метиловый оранжевый;
2) (А) Na3PO4; (Б) HCl; (В) Фенолфталеин;
3) (А) H3PO4; (Б) NaOH; (В) Метиловый оранжевый;
4) (А) H3PO4; (Б) NaOH; (В) Фенолфталеин;
5) (А) Na2CO3; (Б) HCl; (В) Метиловый оранжевый;
6) (А) Na2CO3; (Б) HCl; (В) Фенолфталеин;
7) (A) Na2B4O7; (Б) HCl; (В) Метиловый оранжевый;
8) (А) К2CO3; (Б) HCl; (В) Фенолфталеин;
9) (А) К2CO3; (Б) HNO3; (В) Метиловый оранжевый;
10) (А) К2CO3; (Б) HNO3; (В) Фенолфталеин;
11) (А) Na3PO4; (Б) H2SO4; (В) Метиловый оранжевый;
12) (А) K3PO4; (Б) H2SO4 ; (В) Фенолфталеин;
13) (A) K3PO4; (Б) HNO3; (В) Метиловый оранжевый;
14) (А) Na2B4O7 * 10 H2O; (Б) HNO3; (В) Фенолфталеин;
15) (А) Na2CO3; (Б) H2SO4; (В) Фенолфталеин;
Пример: Вычислить эквивалентную массу кислоты Н3РО4, если




 [H+] =
[H+] =