Кафедра химия
Контрольные задания
По физической химии
Методические указания для студентов 2-го курса
заочного обучения специальности
«Производство строительных изделий и конструкций»
Воронеж 2004
Составители Г. Г. Кривнева, В. В. Шаталова
УДК 541. 1
Контрольные задания по физической химии. Методические указания для студентов 2-го курса заочного обучения специальности «Производство строительных изделий и конструкций» / Воронеж. гос. арх. – строит. ун – т.; Сост.: Г. Г. Кривнева, В. В. Шаталова. – Воронеж, 2004. - с.
Методические указания предназначены для самостоятельной работы студентов при изучении курса физической химии. Указания включают важнейшие темы дисциплины, краткое изложение теории, приеры решения задач, задачи для самостоятельного решения.
Содержание дисциплины соответствует государственному обраовательному стандарту для специальности 290601 «Производство строительных изделий и конструкций» утвержденному 17. 03. 2000 г.
Табл. Ил.. Библиограф.: назв.
Печатается по рекомендации редакционно – издательского совета Воронежского архитектурно – строительного университета.
Рецензент –
Оглавление
Введение
Раздел I. Основы химической термодинамики ……………………..
1.1. Первый закон термодинамики……………………………………..
1.2. Термохимия…………………………………………………………
1.3. Второй закон термодинамики……………………………………..
Раздел 2. Растворы.
2.1. Давление пара разбавленных растворов. Закон Рауля…………..
2.2. Замерзание и кипение растворов………………………………….
Раздел 3. Химическая кинетика. Закон действия масс. Кинетическая классификация химических реакций.
Раздел 4. Фазовые равновесия в гетерогенных системах
Библиографический список рекомендуемой литературы
Основные вопросы для подготовки к экзамену
Варианты контрольных заданий
Введение
Изучение физической химии дает возможность понять законы химии и физики, а также предсказать химические явления и управлять ими. Поэтому знание физической химии для будущих инженеров – технологов открывает большие возможности для решения многообразных задач, встречающихся в практической деятельности.
Методические указания содержат 4 раздела, относящиеся к следующим темам курса физической химии: основы химической термодинамики, растворы, химическая кинетика, фазовые равновесия в гетерогенных двойных системах. Каждый раздел содержит краткое изложение некоторых теоретических вопросов и формулы, необходимые для решения задач; включает решение типовых задач, рассмотрение которых поможет разобраться в аналогичных примерах. Материал необходимо изучать последовательно, используя предложенную литературу. Особое внимание следует обратить на усвоение понятий, определений, законов, вывод уравнений и решение задач.
Студенты выполняют одну контрольную работу. При оформление работы указывается номер шифра, разборчиво – фамилия, имя и отчество исполнителя. Условие задач переписываются полностью, при решение необходимо все расчеты давать с пояснением. Для замечаний рецензента следует оставлять поля. Контрольная работа должна быть выполнена и зачтена до начала экзаменационной сессии. Номер контрольной работы студенты получают у преподавателя кафедры химии.
По своему содержанию указание соответствует рабочей программе по химии, разработанной в соответствии с типовой программой.
Раздел 1. основы химической термодинамики
Первый закон термодинамики
Термодинамический метод является одним из основных методов физической химии, которой дает точные соотношения между энергией и свойствами системы. Термодинамика применяется к системам, находящимся в равновесии, и рассматривает только начальные и конечные состояния.
Первый закон термодинамики – принцип сохранения и превращения энергии в применении к процессам, сопровождающимся выделением или поглощением теплоты – q, а также совершением или затратой работы – А и изменением внутренней энергии системы – Δ U:
d U = δq - δА (1)
Для конечного изменения состояния системы уравнение (1) можно записать:
Δ U = q - А = q - p ΔV, (2)
где p ΔV – работа расширения.
В уравнение (2) величина q считается положительной, если теплота поглощается системой, и отрицательной, если теплота выделяется в ходе процесса; работа А является положительной, если система её совершает; ΔU считается положительной, если внутренняя энергия системы возрастает, и отрицательной, если убывает.
Внутренняя энергия системы складывается из кинетической энергии молекулярного движения, из энергии взаимного притяжения и отталкивания частиц, составляющих систему, из химической внутримолекулярной энергии. Зависит U от природы вещества, его количества, агрегатного состояния, температуры, давления, объема.
Если система подчиняется законам идеального газа, то при постоянной температуре dU = 0; при изменении температуры
dU = ν Cv ∙ dT. Величина работы расширения, совершаемой системой, зависит от условий, в которых происходит изменение объема:
а) при изобарном расширении (Р – const)
Ар = Р (V2 – V1) или
Ар = ν R (T2 – T1); (3)
б) при изохорном процессе (V – const)
А v = 0; (4)
в) при изотермическом процессе (Т - const)
Ат = ν R T ln (V2 / V1) = ν R T ln (P1 / P2) (5)
г) при адиабатном процессе, протекающем без теплообмена системы с внешнем средой (q = const)
Аq = - Δ U, Аq = Сv (T2 – T1); (6)
Применительно к различным термодинамическим процессам, идущим в гомогенных системах, уравнение (2) первого закона термодинамики записывается так:
для изобарного процесса (Р – const)
qp = Δ U + p Δ V; (7)
для изохорного процесса (Δ V = 0)
q v = Δ U = Сv (T2 – T1); (8)
для изотермического процесса (Δ U =0)
q т = Ат = ν R T ln (V2 / V1) = ν R T ln (P1 / P2) (9)
Решение типовых задач
Задача 1. Определите количество теплоты, поглощенное системой и величину работы, совершенной при изотермическом (Т=308 К) расширении от давления 5, 0665∙105Па до давления 1, 01325∙105 Па смеси, состоящей из
1,5 моль кислорода и 2 моль азота.
Решение.
Согласно уравнению (2) ∆U = q A, при T-const для гомогенной системы ∆U = 0, тогда qТ = АТ.
Работа изотермического процесса рассчитываем по уравнению (5)
АТ = 3,5 ∙ 8,31∙ 308 ln (5,0665∙105/1,01325∙105) = 14413,7 Дж
или 14,413 кДж
Задача 2. Определите изменение внутренней энергии при охлаждении 10 кг воздуха от 300 0 до 0 0С. Удельная теплоемкость воздуха при постоянном объеме выражается уравнением
CV = 0,7084 + 1,87 ∙10-4 Т кДж/кг∙К.
Решение.
В изохорном процессе работа расширения не совершается (∆V=0), поэтому из уравнения (2) ∆UV = qV.
Изменение внутренней энергии в данном процессе рассчитываем согласно уравнению (8)
T2
∆UV = - m Cv (T2 – T1) = - m ∫ Cv d T =
T1
∆UV = -10 ∫ (0,7084 +1,87 ∙10-4 Т) dT= -10∙[0,7084(573 –
273)+(1,87 / 2) ∙10-4(5732 – 2732)] = - 2362,5 кДж.
Задачи для самостоятельного решения
1. Для испарения 20 кг спирта при температуре 351 К и давление 1, 01325 ∙105 Па потребовалось 17,01 ∙106 Дж теплоты. При этом образовался пар, занимающий объем 12,2 м3. Определите изменение внутренней энергии, считая пары спирта идеальным газом. Объемом жидкости пренебречь.
Ответ: 15, 774 ∙106 Дж.
2. Определите изменение внутренней энергии при испарение 90 г воды при температуре её кипения. Теплота образования воды 40714,2 Дж/моль, удельный объем водяного пара 1,699 ∙10 – 6м3/г. Давление 1, 01325 ∙105 Па, объемом жидкости пренебречь.
Ответ: 203, 56 кДж.
3. Теплоемкость кислорода при постоянном объеме выражается уравнением Сv = 0,6527 + 2,5 ∙10 – 4 Т кДж /кг ∙К. Вычислите изменение внутренней энергии при охлаждение 1 кг кислорода от 2000 до 00 С.
Ответ: - 149,19 кДж.
4. Газ, расширяясь при постоянном давлении 1, 01325 ∙105 Па от 25 ∙10 –3 м3 до 75 ∙10 –3 м3, поглощает 12570 Дж теплоты. Определите изменение внутренней энергии.
Ответ: 7,504 кДж.
5. При адиабатном расширении 5 кг водорода затрачена работа, равная (- 580 кДж). Начальная температура 00 С, теплоемкость водорода при постоянном объеме 1, 04 кДж / кг ∙ К. Определите изменение внутренней энергии системы и конечную температуру процесса.
Ответ: 580 кДж, 384, 5 К.
6. При 170С 10кг воздуха изотермически расширяется от 1,025∙106 Па до 1,340 ∙105 Па. Определите объем воздуха в начале и конце процесса расширения, совершенную при этом работу и количество подведенной теплоты. Средняя молярная масса воздуха 29 г.
Ответ: 1688,5 кДж; 0,811м3; 6, 192 м3
7. Водяной пар в количестве 450г конденсируется при 1000С при постоянном давлении. Теплота испарения воды равна 2253, 02 Дж/г. Вычислите работу процесса, количество выделенной теплоты и изменение внутренней энергии системы.
Ответ: - 77, 49 кДж; - 1013, 83 кДж; - 936, 37 кДж.
8. При 00С 5кг азота изотермически расширяется от давления 1,040 ∙ 106 Па до 1,542 ∙105 Па. Определите объем в начале и конце процесса, количество совершенной работы.
Ответ: 0, 4138 м3; 2,63 м3; 769, 4 кДж.
9. Рассчитате изменение внутренней энергии при нагревании 2кг ά – кварца от 298 до 800 К, если зависимость теплоемкости ά – кварца от температуры выражается уравнением
Сv = 0,83 +34,3∙10–3 Т кДж / кг ∙ К. Объем системы не меняется.
Ответ: 19623, 98 кДж.
10. Работа, затраченная на адиабатное сжатие 3кг воздуха, равна (-471 кДж). Начальная температура 150С. Определите изменение внутренней энергии системы и конечную температуру процесса. Средняя теплоемкость воздуха при сжатии равна 0, 732 кДж/кг∙К.
Ответ: 471 кДж; 502,5 К.
11. Рассчитайте изменение внутренней энергии при испарение 5 моль спирта при температуре 790С, если мольная теплота парообразования спирта равна 39, 509 кДж/моль. Объемом жидкости пренебречь.
Ответ: 182,2кДж.
12. 10л азота, взятого при температуре 273 К и давлении 5,0662 ∙105 Па, расширяется изотермически до давления 1, 01325 ∙105 Па. Рассчитайте работу, совершенную системой и поглощенную в ходе процесса теплоту.
Ответ: 1626, 3 кДж.
13. Вычислите изменение внутренней энергии при испарении 50г толуола при 300С и давлении 1,01325 ∙105 Па, приняв, что пары толуола подчиняются законам идеального газа и объем жидкости незначителен по сравнению с объемом пара. Теплота испарения толуола 347, 8 Дж/г; молярная масса толуола – 92 г/моль.
Ответ: 16, 021 кДж.
14. Вычислить изменение внутренней энергии при нагревании 5кг азота от 00 до 5000С, если удеальная теплоемкость азота при постоянном объеме выражается уравнением
Сv = 0,7084 +1,8 ∙10 –3 Т кДж / кг ∙ К.
Ответ: 2006, 3 кДж.
15. Определите изменение внутренней энергии при испарении 20г спирта при температуре кипения и давлении 1,01325 ∙105 Па, если известно, что удельная теплота испарения спирта равна 856,9 Дж/г, а удельный объем пара при температуре кипения равен 607 ∙10 –6 м3/г. Объемом жидкости пренебречь.
Ответ: 159, 24 Дж.
16. Какое количество теплоты затрачено и какая работа будет совершена, если 51г аммиака, занимавшего при 270С объем 25∙10 –3 м3, расширяется при постоянной температуре до 75∙10 –3 м3?
Ответ: 8226,9 Дж.
17. 10г кислорода сжимается адиабатически, при этом температура повышается от 298 К до 502 К. Определите работу, затраченную на адиабатическое сжатие кислорода, изменение внутренней энергии системы. Средняя мольная теплоемкость кислорода при постоянном давлении равна 20,77Дж/моль∙К.
Ответ: 1323.9 Дж.
18. Какое количество теплоты выделяется при изотермическом сжатии идеального газа от 30∙10 –3 м3 до 15∙10 –3 м3, если он был взят при 00С и давлении 1,850 ∙105 Па.
Ответ: 3811,5 Дж.
19. Определите изменение внутренней энергии при испарении 2 моль толуола при 500С и давлении 1,01325∙105 Па, приняв, что пары толуола подчиняются законам идеальных газов и объем жидкости незначителен по сравнению с объемом пара. Теплота испарения толуола 31997,6 Дж/моль.
Ответ: 58,62 кДж.
20. Какое количество теплоты выделяется при изотермическом сжатие идеального газа от 24∙10 –3 м3 до 3∙10 –3 м3, если он был взят при 170С и давлении 1,454∙105 Па?
Ответ: - 7266,3 Дж.
Термохимия
Раздел химической термодинамики, в котором изучаются тепловые эффекты химических процессов, называется термохимией.
Тепловой эффект процесса, протекающего при постоянном давлении или объеме, не зависит от пути следования процесса, а зависит только от природы исходных и конечных веществ и их состояния (закон Гесса).
В термохимических расчетах используют следующие два следствия закона Гесса:
а) тепловой эффект процесса равен разности между суммой теплот образования продуктов (∆ Hобрпрод. .) и суммой теплот образования исходных веществ (∆ Hобрисх. .) с учетом стехиометрических коэффициентов в уравнении реакции;
б) тепловой эффект процесса равен разности между суммой теплот сгорания исходных веществ (∆ Hсгорисх. .) и суммой теплот сгорания продуктов реакции (∆ Hсгорпрод. .) с учетом стехиометрических коэффициентов в уравнении реакции.
Закон Гесса и следствия позволяют вычислять тепловые эффекты различных процессов на основе табличных данных о теплотах образования неорганических веществ и теплотах сгорания органических соединений при стандартных условиях (Р= 101325 Па, Т= 298 К). Поскольку расчеты в химии и химической технологи чаще всего приходится производить для изобарных процессов, то для данных процессов тепловой эффект обозначают через энтальпию -∆H:
∆H = ∆U + p∆V; (10)
qV = ∆U, qР = ∆H, qР = qV +p∆V. (11)
Для определения тепловых эффектов при температурах, отличных от стандартной, необходимо учесть температурные зависимости теплоемкостей веществ, которые выражаются степенными рядами:
СР = а + вТ + сТ2 + …
СР = а + вТ + с΄ Т-2 + … (12)
Уравнение Кирхгофа, выражающее зависимость теплового эффекта от температуры, будет иметь вид:
Т2
∆HТ = ∆H298 + 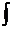 ∆ СР∙ dТ,
∆ СР∙ dТ,
Т1
Т2
∆HТ = ∆H298 + 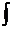 (∆а + ∆dT + ∆cT2 + ∆c΄T-2)dT (13)
(∆а + ∆dT + ∆cT2 + ∆c΄T-2)dT (13)
Т1
где ∆а, ∆b, ∆с, ∆c΄— алгебраические суммы постоянных а, b, с, c΄.
Решение типовых задач
Задача 1. Определите тепловой эффект реакции
Al2O3 + 3SO3 → Al2(SO4)3
при 298 К и 101325 Па.
Решение. Для определения ∆ Hреакц. воспользуемся следствием из закона Гесса.
∆ Hреакц. . = ∆Hобр Al2(SO4)3 - (∆Hобр Al2O3+ 3∆Hобр SO3).
Тепловые эффекты образования веществ представлены в таблице 1
∆ Hобр Al2O3 = -1675 кДж/моль; ∆Hобр SO3 = -395,2 кДж/моль;
∆ Hобр Al2(SO4)3 = -3434 кДж/моль.
∆ Hреакц. = -3434 +1675+3∙395,2= -573,4 кДж.
Задача 2. Рассчитайте тепловой эффект процесса при 600 0С, протекающего по уравнению СО +Н2О(пар) → СО2 +Н2, используя температурные зависимости теплоемкостей реагирующих веществ (Дж/моль∙К):
СР(СО) = 28,41 + 4,1∙10-3Т – 0,46∙105Т-2;
СР(Н2О) =30,00 + 10,7∙10-3Т + 0,33∙105Т-2;
СР(СО2) = 44,14 + 9,0∙10-3Т + 8,53∙105Т-2;
СР(Н2) = 27,28 + 3,2∙10-3Т + 0,50∙105Т-2.
Решение. По теплотам образования веществ, взятым из таблицы 1, подсчитаем тепловой эффект процесса при стандартных условиях (Т-298К);
∆H298 = ∆Hобр СО2 -∆Hобр СО - ∆Hобр Н2О =
= -393,51+110,5+241,84=-41,170 кДж.
Определяем ∆а, ∆b, ∆c΄:
∆а = 27,28+44,14-30,00-28,41=13,01,
∆b = (3,2+9,0-10,7-4,1)∙10-3 = -2,6∙10-3,
∆c΄ = (0,5-8,53+0,46-0,33) ∙105 = -7,9∙105.
Т= 60+273=873 К.
Тепловой эффект процесса при 600 0С находим по уравнению (13)
∆H873 = ∆H298 + 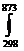 (13,01 - 2,6∙10-3Т - 7,9∙105Т-5)dT =
(13,01 - 2,6∙10-3Т - 7,9∙105Т-5)dT =
= -41170+13,01(873-298)-1/2∙2,6∙10-3∙(8732-2982)+
+ 7,9∙105(1/873- 1/298)=-36307 Дж или ∆H873 =-36,307 кДж.
Задачи для самостоятельного решения
21. Определите теплоту сгорания этилена
С2Н4 + 3О2 → 2СО2 + 2Н2О(ж),
исходя из следующих данных: ∆Hобр С2Н4 = 62,01 кДж/моль;
∆HобрН2О = -284,9 кДж/моль; ∆Hобр СО2 = -393,9 кДж/моль.
Ответ: -1419,6 кДж/моль.
22. Найдите разность между q p и q v при 250С для следующих реакций:
N2 + 3 H2 → 2NH3; 2 C + O2 → 2 CO.
Ответ: -4955,1 Дж; - 2477,5 Дж.
23. Теплота диссоциации СаСО3 → СаО + СО2 при 9000С составляет 178, 3 кДж/моль. Теплоемкости веществ Дж/моль∙К:
Ср (СаСО3) = 104,5 + 21,9∙10-3Т – 25,9∙105 Т-2;
Ср (СаО) = 49,6 + 4,5∙10-3Т – 6,9∙105 Т-2;
Ср (СО2) = 44,1 + 9,0∙10-3Т – 8,5∙105 Т-2.
Вычислите теплоту диссоциации при 10000С.
Ответ: 176, 3 кДж.
24. Определите количество теплоты, выделяющейся при гашении 500 кг извести водой:
СаО + Н2О → Са (ОН)2 при 250С
Для решения задачи теплоты образования веществ (∆Н298) возьмите из таблицы 1.
Ответ: 589, 3 кДж.
25. Тепловой эффект реакции 2 Fe + 3/2 O2 → Fe2O3 при 180С и постоянном давлении равен – 823, 3 кДж/моль. Определите q v для этой реакции при той же температуре.
Ответ: - 817, 67 кДж.
26. Рассчитать тепловой эффект при 1000 К процесса
СН4 → С + 2Н2, если ∆Н298 = 74, 9 кДж/моль. Теплоемкости веществ Дж/моль∙К:
Ср (С) = 11,2 + 10,9 ∙10-3Т;
Ср (Н2) = 27,2 + 3,8 ∙10-3Т;
Ср (СН4) = 22,4 +43,2∙10-3Т.
Ответ: 99,4 кДж/моль.
27. Определите теплоту образования сероуглерода по уравнению СS2 + 3О2 → СО2 + 2 SО2, если известно, что тепловой эффект реакции равен (–1109.9) кДж.
∆Нобр.SO2 = -297,1 кДж/моль; ∆Нобр.СO2 =- 393,7 кДж/моль.
Ответ: 122,0 кДж/моль.
28. Вычислите теплоту образования бензола
6 С + 3 Н2 → С6 Н6, если теплоты сгорания водорода, углерода и бензола соответственно равны: -285,0; - 394,0; -3282,4 (кДж/моль).
Ответ: - 63,4 кДж/моль.
29. Теплота образования паров воды по уравнению
Н2 + ½ О2 → Н2О (пар) при 250С равна (– 242,0) кДж/моль. Вычислите тепловой эффект этой реакции при 1000 К пользуясь уравнениями теплоемкостей реагирующих веществ (Дж/моль∙К):
Ср (Н2О) = 30,2 +11,3 ∙10-3Т;
Ср (Н2) = 29,1 – 0,84 ∙10-3Т;
Ср (О2) = 31,5 + 3,4 ∙10-3Т.
Ответ: - 247,5 кДж.
30. Тепловой эффект реакции Мq(OH)2 → МqО + Н2О (пар), протекающей в открытом сосуде при 400 К и 101325 Па, составляет 89, 03 кДж. Как будет отличаться от этого значения тепловой эффект, если реакцию проводить при той же температуре, но в закрытом сосуде?
Ответ: 85, 7 кДж.
31. Рассчитате расход теплоты на получение 100м3 водорода в ходе процесса
СН4 + СО2 → 2 СО + 2 Н2
Данные по теплотам образования веществ возьмите из таблицы 1.
Ответ: 5, 552∙ 105 кДж.
32. Сколько выделится теплоты при гашении 112 кг извести по реакции СаО + Н2О(ж) → Са(ОН)2? Теплоты образования веществ возьмите из таблицы 1.
Ответ: 136 ∙ 103 кДж.
33. Вычислите тепловой эффект реакции Ν2 + 3 Н2 → 2 ΝН3 при 5000 С, если уравнения для теплоемкостей (Дж/моль∙ К) реагирующих веществ имеют вид:
Ср (ΝН3) = 29, 6 + 25, 5 ∙ 10 –3 Т;
Ср (Н2) = 29, 1 – 0, 84 ∙ 10 –3 Т;
Ср (Ν2) =27, 8 + 4, 3 ∙ 10 –3 Т и теплота реакции при 250 С
равна (– 92, 4) кДж
Ответ: - 107, 2 кДж
34. Определите количество поглощенной теплоты при растворении 1 м3 оксида углерода СО + Н2О(ж) → СО2 + Н2. Данные по теплотам образования веществ при стандартных условиях возьмите из таблицы 1.
Ответ: 125, 1 кДж.
35. Рассчитайте теплоту образования нафталина при 250 С, если тепловой эффект реакции
С10Н8 + 12 О2 → 10 СО2 + 4 Н2О(ж) равен (– 5162) кДж
ΔНобр СО2 = - 393, 8 кДж/моль, ΔНобрН2О(Ж) = - 286, 0 кДж/моль
Ответ: 84 кДж/моль.
36. Определить тепловой эффект реакции
Са(ОН)2 → СаО + Н2О(г), если она протекает в автоклаве при постоянном объеме и 298 К. Тепловые эффекты образования веществ при стандартных условиях возьмите из таблицы 1.
Ответ: 106, 82 к Дж.
37. При стандартных условиях тепловой эффект процесса
С2Н5ОН(г) → C2H4 + H2О(г) равен 45, 8 кДж. Вычислите тепловой эффект этой реакции при 400 К, если температурная зависимость теплоемкостей (Дж/моль·К) веществ выражается уравнениями:
Ср (H2О(г)) = 30, 1+11, 3∙ 10-3 Т,
Ср (C2H4) = 4, 2+154, 7∙ 10-3 Т,
Ср (С2Н5ОН(г)) = 20, 7+205, 5∙ 10-3 Т.
Ответ: 45, 78 кДж.
38. Какое количество тепла надо затратить, чтобы прошел процесс разложения 0, 2 м3 СО2 по реакции 2СО2 → 2СО + О2 при стандартных условиях. Данные возьмите из таблицы 1.
Ответ: 2517, 3 кДж.
39. Рассчитайте теплоту образования аммиака при стандартных условиях, если тепловой эффект реакции
NH4Cl(тв) → NH3 + HCl(г) равен 175, 2 кДж, а
∆Нобр NH4Cl = - 313,8 кДж/моль, ∆Нобр HCl = -92, 38 кДж/моль.
Ответ: -46, 22 кДж.
40. Тепловой эффект сгорания графита при 298 К равен
–393,8 кДж/моль. Молярные теплоемкости для этих веществ соответственно равны 8,65 кДж/моль∙К и 6, 06 кДж/моль∙К. Рассчитайте тепловой эффект перехода графита в алмаз при 273 К.
Ответ: -1835, 2 Дж.
Второй закон термодинамики
Второй закон термодинамики устанавливает: возможен или невозможен при данных условиях тот или иной процесс, до какого предела он может протекать и какая полезная работа совершится при этом. Применительно к химическим процессам второй закон можно сформулировать так: всякое химическое взаимодействие при неизменных давлении или объеме и постоянстве температуры протекает в направлении уменьшения изобарно-изотермического ∆G или изохорно-изотермического ∆F потенциалов. Изменение G и F можно рассчитать по уравнениям
∆G = ∆H - T∆S; ΔF = ∆U - T∆S, (14)
где ∆S – изменение энтропии в ходе процесса, физический смысл энтропии – энергетическая мера беспорядка в системе.
Если процессы совершаются в системах, свойства которых близки к идеальным, то изменение энтропии определяется по уравнениям
∆S = ν Rln(V2/V1) + ν CVln(T2/T1), (15)
∆S = ν Rln(Р1/Р2) + ν Cрln(T2/T1) (16)
Для реальных систем
Т2
∆S = ν ∫ ∆ Cр (dТ/Т) (17)
Т1
При переходе вещества из одного агрегатного состояния в другое изменение энтропии рассчитывается
∆S = ∆Hпер / Т = L / Т, (18)
L – скрытая теплота фазового превращения (испарения, плавления и др.),
Т – температура фазового перехода.
Размерность энтропии Дж / моль∙К
Пределом протекания химической реакции (т. е. условиям наступления равновесия, для которого ∆G = 0 или ∆ F = 0) является достижением некоторого минимального значения G и F.
Если расчет показал, что в ходе процессов изобарно – изотермический или изохорно – изотермический потенциалы уменьшаются (∆G < 0 или ∆ F < 0), то данные процессы при заданных условиях возможны и идут самопроизвольно. При ∆G > 0 или
∆ F > 0 процессы не могут при заданных условиях (V, Т или Р, Т) протекать самопроизвольно и возможны лишь при получении работы извне.
Решение типовых задач
Задача 1. Определите изменение энтропии при нагревании
30 г ледяной уксусной кислоты от температуры плавления 16, 6 до 600 С. Теплота плавления 194 Дж/г, массовая теплоемкость уксусной кислоты выражается уравнением Ср =1,9 + 3, 9∙10 –3 Т Дж/г∙К.
Решение. Общее изменение энтропии ∆ S равно сумме изменений энтропии при плавлении ∆ S1 и при нагревании ∆ S2 жидкой уксусной кислоты от температуры плавления до заданной температуры 600 С.
По формуле (18) рассчитаем изменение энтропии при плавлении:
∆S1 =(m ∙ L) / Тпл. = 30 ∙ (194 / 289, 6) = 20, 09 Дж/К
Для вычисления ∆ S2 используем формулу (17)
333
∆S2 = m ∙ ∫ (1, 96 + 3, 9 ∙ 10-3 Т) ∙ (d Т/Т) =
289, 6
30 [1, 96 ∙ 2, 303 lg(333 / 289, 6) + 3, 9 ∙ 10-3(333 – 289, 6) ];
∆ S2 = 13, 26 Дж/К;
∆ S = 20, 09 +13, 26 = 33, 35 Дж/К.
Задача 2. Определите изменение изобарно-изотермического потенциала при стандартных условиях для реакции
Fe3O4 + СО → 3 FeО + СО2 и решите вопрос о возможности самопроизвольного протекания её при указанных условиях.
Рассчитайте температуру, при которой наступит состояние равновесия данной системы.
Решение. Изменение изобарно-изотермического потенциала при стандартной температуре 298 К определяем по формуле (14)
∆Gреакц. = ∆Н0реакц. - Т∆ S0реакц.
Значение ∆Н0298 и ∆ S0298 для веществ, участвующих в реакции:
∆НобрFeO = - 266, 9 кДж/моль ∆ S0 FeO = 58, 8 Дж/моль∙К
∆НобрСО2 = -383, 8 кДж/моль ∆ S0 СО2 = 213 Дж/моль∙К
∆НобрСО = - 110, 6 кДж/моль ∆ S0СО = 198, 0 Дж/моль∙К
∆Нобр Fe3O4 = -1118, 7 кДж/моль ∆ S0 Fe3O4 = 151, 5 Дж/моль∙К
∆Нреакц. = ∆НобрСО2 + 3 ∆НобрFeO - ∆НобрСО - ∆Нобр Fe3O4.
∆Нреакц . = -383, 8 -3 ∙266, 9 + 110, 6 +1118, 7= 34, 8 кДж.
∆ Sреакц. = S0 СО2 + 3 S0 FeO - S0СО - S0 Fe3O4.
∆ Sреакц. =213 + 3∙58, 8 - 198, 0 - 151, 5 = 40, 7 Дж/К
∆Gреакц. = 34800 – 40, 7 ∙ 298 = 22672 Дж = 22, 67 кДж.
Итак, ∆Gреакц > 0. Следовательно, при стандартных условиях самопроизвольный процесс восстановления Fe3O4 оксидом углерода невозможен.
Равновесие системы наступает тогда, когда ∆G=0.
0=∆Нреакц.- Трав.· ∆ Sреакц.; отсюда Травн. = (∆Нреакц. / ∆ Sреакц.) =
= 34, 8 / 0, 0407 = 855 К или 5820 С.
Задачи для самостоятельного решения
41. Рассчитайте изменение изобарно-изотермического потенциала в ходе процесса образования алюмината кальция
СаО + Аl2O3 → СаО ∙ Аl2O3 при температуре 1400 К и решить вопрос о возможности его протекания при данной температуре. Данные для решения возьмите из таблицы 1.
Ответ: - 41, 7 кДж.
42. Вычислите суммарное изменение энтропии при нагревании 1 моля воды от температуры плавления до полного испарения при температуре кипения. Теплота плавления льда 335, 2 Дж/г, теплота парообразования воды 2260 Дж/г, массовая теплоемкость воды 4, 188 Дж/г∙К.
Ответ: 154, 67 Дж.
43. Определите изменение изобарно-изотермического потенциала в ходе реакции Ν2 + 2 Н2О(ж)→ΝН4ΝΟ2 и дайте заключение о возможности её протекания при стандартных условиях, если ΔG0 Н2О (ж) = - 237, 5 кДж/моль ΔG0 ΝН4 ΝΟ2 = 115, 94 кДж/моль
Ответ: 590, 94 кДж.
44. Рассчитайте изменение энтропии для 1 кг воздуха при нагревании его от – 50 до +500 С, при этом происходит изменение давления от 106 до 105 Па. Массовая теплоемкость воздуха 1, 005 Дж/г∙К. Средняя молярная масса воздуха 29.
Ответ: 1032, 5 Дж.
45. Чему равно изменение энтропии 128 г нафталина при нагревании его от 0 до 80, 40С (температура плавления), если теплота плавления 149, 6 Дж/г, а средняя массовая теплоемкость кристаллического нафталина 1, 315 Дж/ г∙К.
Ответ: 97, 62 Дж/К.
46. Вычислить изменение изобарно-изотермического потенциала в ходе процесса СаСО3 → СаО + СО2 и решить вопрос о возможности его протекания при 9000С. Рассчитайте температуру, при которой система достигнет состояния равновесия. Данные для решения возьмите из таблицы 1.
Ответ: - 10, 87 кДж.
47. Определите изменение изобарно-изотермического потенциала в ходе процесса образования силиката магния
MgO +SiO2→ MgO ∙ SiO2 и решите вопрос о его протекании при стандартных условиях. Данные для решения возьмите из таблицы 1.
Ответ: - 35, 04 кДж.
48. Определите изменение энтропии при стандартных условиях для процессов: 2 Н2S + SO2 → 2 Н2O(ж) - 3 S;
Са(ОН)2 + СО2 → СаСО3 + Н2О(ж)
и объясните её уменьшение в ходе данных процессов.
Ответ: - 423, 8 Дж/К; -134, 5 Дж/К.
49. Самопроизволен ли процесс гашения извести при стандартных условиях, протекающий по уравнению
СО2 + Н2О(ж)→ Са(ОН)2.
Ответ мотивируйте, рассчитав изменение ΔG0 для данного процесса; данные для решения возьмите в таблице 1.
50. Вычислите изменение энтропии при нагревании 1 моль
α – кварца – SiO2 от 258 до 900 К, если зависимость теплоемкости α – кварца от температуры выражается уравнением
Ср = 46, 94 +34, 31 ∙ 10-3 Т Дж/ моль ∙ К.
Ответ: 72, 53 Дж/К.
51. Нагревают 14 кг азота от 273 до 373 К при постоянном объеме. Рассчитайте изменение энтропии в этом процессе. Зависимость теплоемкости азота при постоянном объеме от температуры выражается уравнением
Сv = 29, 7 + 4, 27 ∙ 10-3 Т Дж/ моль ∙ К
Ответ: 3444, 2 Дж/К.
52. Определите изменение изобарно-изотермического потенциала для процесса Mq + CO2 → MqCO3, при стандартных условиях и рассчитайте температуру, при которой система достигает состояния равновесия. Для решения воспользуйтесь данными из таблицы 1.
Ответ: 66, 4 кДж; 677, 4 К.
53. В одном сосуде емкостью 3 м3 находиться 2 кг водорода, в другом емкостью 6 м3 – 32 кг кислорода при той же температуре. Вычислите изменение энтропии при диффузии в результате соприкосновении содержимого этих сосудов. Считать, что водород и кислород являются идеальными газами.
Ответ: 12, 49 ∙ 103 Дж/К.
54. Рассчитате изменение энтропии при нагревании 2, 7 кг воды от 293 К до 390 К. Теплота испарения воды 2260, 9·103 Дж/кг, массовая теплоемкость жидкой воды 4, 2 ∙ 103 Дж/кг ∙ К, пара –
2, 0 ∙ 103 Дж/кг ∙ К.
Ответ: 20, 14 ∙ 103Дж/К.
55. Определите изменение изобарно-изотермического потенциала при температуре 298 К для реакции образования трехкальциевого силиката 3 CaO + SiO2 → 3 CaO·SiO2. Возможен ли данный процесс при стандартных условиях? Данные для решения возьмите из таблицы 1.
Ответ: 456, 3 кДж.
56. Массовая теплоемкость железа равна 0, 486 Дж/г·К. Определите изменение энтропии при нагревании 1 кг железа от 100 до 150 0С.
Ответ: 61, 14 Дж/К.
57. Рассчитате изменение изобарно-изотермического потенциала при Т–298 К для процесса MqO + H2 → H2O(Ж) + Mq. Определите, при какой температуре в системе установиться равновесие. Величины ∆Н0298 и S0298 для веществ возьмите из таблицы 1.
Ответ: 332 кДж; 5751 К.
58. Определите изменение энтропии при Т=298 к в ходе следующих реакций: С + О2 → 2 СО; FeO+CO→Fe+CO2. Для решения воспользуйтесь данными таблицы 1.
Ответ: 176 Дж/К; -13, 2 Дж/К.
59. Возможен ли процесс синтеза аммиака при стандартных условиях 3 Н2 + N2→2NH3? Величины ∆Н0298 и S0298 для веществ возьмите из таблицы 1.
60. Вычислите изменение энтропии при охлаждении 12 ∙10-3кг кислорода от 290 до 233 К и одновременном повышении давления от 1 ∙ 105 до 60, 6 ∙ 105 Па. Если теплоемкость кислорода
Ср(О2) = 32



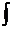 ∆ СР∙ dТ,
∆ СР∙ dТ,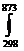 (13,01 - 2,6∙10-3Т - 7,9∙105Т-5)dT =
(13,01 - 2,6∙10-3Т - 7,9∙105Т-5)dT =


