Растворы.
Дисперсные системы. Основные характеристики дисперсных систем. Степень дисперсности. Классификация дисперсных систем. Гетерогенные и гомогенные дисперсные системы. Гетерогенные равновесия.
Дисперсные системы - гетерогенные системы из двух или большего числа фаз с сильно развитой поверхностью раздела между ними.
Все дисперсионный системы по размеру частиц дисперсионной фазы можно классифицировать на молекулярно-ионные (<1нм., к данной группе относятся разнообразные истинные растворы неэлектролитов: глюкозы, мочевины, спирта, сахарозы.), коллоидные (от 1 до 100нм. Такие частицы легко проникают через поры бумажных фильтров.Примером коллоидной системы являются растворы желатина, альбумина, гуммиарабика, коллоидные растворы золота и серебра.), грубодисперсные (>100нм, к ним относят эмульсии и суспензии).
По интенсивности взаимодействия между веществами дисперсной фазы и дисперсионной среды (только для систем с жидкой дисперсионной средой), по предложению Г. Фрейндлиха различают следующие дисперсные системы:
- Лиофильные (гидрофильные, если ДС – вода): Для них характерно сильное взаимодействие частиц ДФ с молекулами ДС. В предельном случае наблюдается полное растворение.
- Лиофобные (гидрофобные, если ДС – вода): эмульсии, суспензии, золи. Для них характерно слабое взаимодействие частиц ДФ с молекулами ДС.
Классификация дисперсных систем по агрегатному состоянию фаз
Степень дисперсности: D’=∑S/V где ∑S - суммарная межфазная поверхность или поверхность всех частиц дисперсной фазы; V - объем частиц дисперсной фазы.
Гомогенная система – система, состоящая из одной фазы.
Гетерогенная система – система, состоящая из двух или большего числа фаз.
Гетерогенные равновесия возникают в гетерогенных системах, т. е. системах, состоящих из нескольких фаз, разделенных реальными физическими границами раздела фаз.
Раствор, находящийся в равновесии с твердой фазой, называют насыщенным относительно осадка. Такой раствор представляет собой равновесную гетерогенную систему.
Охарактеризуем этот равновесный процесс количественно константой равновесия, применив к данной системе закон действующих массa = fa × С.
Крав. = C(+)C(-)/C илиKрав=a(+)a(-)/a
Произведение двух констант дает новую постоянную величину, которую называют термодинамической константой растворимости и обозначают Kр:
Kp= C(+)*C(-), где С – равновесные концентрации катионов и анионов (моль/л) в насыщенном растворе малорастворимого сильного электролита.
Эту величину часто называют произведением растворимости и обозначают ПР; это устаревшее обозначение.
Таким образом, в насыщенном растворе малорастворимого сильного электролита произведение равновесных активностей его ионов есть величина постоянная при данной температуре.
Растворимость газов, жидкостей и кристаллов в жидкостях. Влияние на растворимость природы компонентов раствора, температуры и давления. Насыщенные, ненасыщенные и пересыщенные растворы.
Растворы неэлектролитов.
Неэлектролиты-вещества, которые в растворенном или расплавленном состоянии не проводят электрический ток.
Осмос. Осмотическое давление. Закон Вант-Гоффа. Явление осмоса в природе. Давление насыщенного пара над раствором. Повышение температуры кипения растворов и понижение температуры кристаллизации. Законы Рауля.
Осмос –самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану при условии разности концентраций раствора по обе стороны мембраны.
Осмотическое давление –давление, которое нужно приложить к раствору во избежание проникновения растворителя в раствор.
Осмотическое давление p достаточно разбавленных коллоидных растворов может быть найдено по уравнению:
П=сRT=(Cm/Na)RT=CmkT или П=СRT уравнение Вант-Гоффа
где V – объем частицы; М – масса одного моля растворенного вещества; с – массовая концентрация.
Если концентрацию растворённого вещества выразить как молярную
С = n/V (число молей растворённого вещества в единице объёма), тогда
Росм ∙V = n∙R∙T или
Pосм = m∙R∙T/M∙V,
R=8,314 Дж/моль∙К (универсальная газовая постоянная).
Это уравнение совпадает с уравнением идеального газа, уравнением Менделеева-Клайперона. Поэтому Вант - Гофф пришёл к выводу, что осмотическое давление равно тому давлению, которое оказывало бы растворённое вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало тот же объём, что и раствор.
Законы Рауля. 1 закон: Давление насыщенных паров над раствором меньше, чем давление насыщенных паров над растворителем. Относительное понижение давления насыщенных паров растворителя нвд раствором прямо пропорционально мольной доли раствора при t=const.
(P0А- pА)/p0А=XBкомпонент А-растворитель
Парциальное давление насыщенного пара i-го компонента над раствором (pi) равно произведению давления насыщенного пара над чистым компонентом (p0i) на мольную долю (xi) этого компонента в растворе:
Pi=P0i*xi
Температура кипения жидкости – температура, при которой давление насыщенных паров жидкости становится равным атмосферному давлению.
2 закон: изменение температуры кипения и замерзания растворов прямо пропорционально моляльной концентрации раствора.
∆Tкип=ECmE-эбуллиоскопическая константа(Е(H2O)=0,52) ∆Tкип-разность между Tкип раствора и растворителя.
∆Tзам=KCmK-криоскопическая константа (K(H2O)=1,86)∆Tзам-разность между Tзам раствора и растворителя.
Роль осмоса в природе. У растений клетки используют осмос для увеличения объёма вакуоли. Благодаря этому растение становится более упругим.
Следует отметить роль осмоса в переносе питательных веществ в высоких стволах деревьев. Дело в том, что капиллярный перенос у высокорослых деревьев не способен выполнить функцию снабжения питанием.
Роль осмоса также важна для целых биологических систем. Иногда осмос имеет негативное влияние. Например, если в водоёме концентрация соли или других веществ в воде существенно изменится, то все обитатели такой экосистемы могут погибнуть из-за губительного фатального воздействия осмоса.
Растворыэлектролитов.
Электролиты-вещества, которые в растворенном или расплавленном состоянии проводят электрический ток.
Исходя из степени диссоциации все электролиты делятся на две группы:
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как HCl, HBr, HI, HNO3, H2SO4).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты, такие как HF), основания p-, d- и f-элементов.
Электролитическая диссоциация. Особенности воды как растворителя. Зависимость диссоциации от характера химических связей в молекулах электролитов. Механизм процесса электролитической диссоциации. Характеристика поведения электролитов. Сила электролитов. Степень диссоциации. Константа диссоциации. Закон разбавления Оствальда. Кажущаяся степень диссоциации сильных электролитов. Понятие об активности и ионной силе растворов.
Электролитическая диссоциация – процесс распада на ионы.
Вода хорошо растворяет ионные и многие полярные соединения. Такое свойство воды связано в значительной мере с ее высокой диэлектрической проницаемостью (78,5).
Теория электролитической диссоциации. Зависимость направления диссоциации от характера химических связей в молекуле. Способность электролитов в растворах проводить электрический ток и их отклонения от законов Рауля и Вант-Гоффа объясняет теория электролитической диссоциации Аррениуса.
1. В растворах молекулы электролитов диссоциируют на положительно и отрицательно заряженные ионы. Раствор в целом электронейтрален. Благодаря наличию электрически заряженных частиц, через раствор электролитов проходит электрический ток.
2. Свойства ионов отличаются от свойств нейтральных атомов
3. Ионы движутся беспорядочно, но при пропускании электрического тока приходят в направленное движение. Положительно заряженные ионы движутся к катоду и называются катионами (металлы и водород); отрицательно заряженные ионы движутся к аноду и называются анионами (кислотные остатки и гидроксид ионы).
4. Объясняет отклонения растворов электролитов от законов Рауля и Вант-Гоффа. Это связано со способностью молекул элекиролитадиссоциировать на ионы. Понижение температуры кристаллизации и повышении температуры кипения зависит исклюсительно от числа растворённых частиц.
Однако теория Аррениуса не учитывала всей сложности явлений в растворах. В частности, она рассматривала ионы как свободные, независимые от молекул растворителя частицы. Этой теории противостояла химическая теория растворов Менделеева, в основе которой лежало представление о взаимодействии растворённого вещества с растворителем. В преодалении кажущегося противоречия обеих теорий большая заслуга принадлежит русскому учёному Каблукому, впервые высказавшему предположение о гидратации ионов. Развитие это идеи привело в дальнейшем к объединению этих теорий.
В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны при этом два случая. Один из них это диссоциация растворяющихся солей, т.е. кристаллов с ионной связью в молекуле, второй - диссоциация при растворении кислот, т.е. веществ, состоящих из полярных молекул с ковалентной связью.
Когда кристалл соли попадает в воду происходит постепенное его растворение. Слой за слоем полярные молекулы воды, находящиеся в движении в результате соударений отделяют ионы от кристалл и переводят их в раствор. Иначе протекает диссоциация полярных молекул. Молекулы воды вызывают расхождение полюсов притянутой молекулы - поляризуют её. Такая поляризация в комбинации с колебательным тепловым движением атомов, а также с непрерывным тепловым движением окружающихеё молекул приводит к распаду полярной молекулы на ионы и они гидратируются. При этом ион водорода Н+ прочно связывается с молекулой воды и образует ион гидроксония Н3О+.
Диссоциации веществ как ионного, так и молекулярного строения способствует полярность молекул растворителя. Поэтому кроме воды, многие жидкости, состоящие из полярных молекул, являются ионизирующими растворителями.
Если теперь записать выражение для константы диссоциации HCN, то можно выразить Кд через Сα:

Концентрация недиссоциированных молекул [HCN] в равновесии должна быть меньше исходной концентрации С как раз на величину Сα – отсюда выражение (С – Сα) в знаменателе дроби. Если вынести концентрацию С за скобки и сократить, то получим следующее выражение:

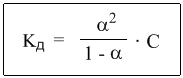 -закон разбавления Оствальда.
-закон разбавления Оствальда.
Окислительно-восстановительные реакции. Классификация окислительно-восстановительных реакций. Важнейшие окислители и восстановители. Изменение окислительно-восстановительных свойств в связи с положением элементов в периодической системе Д.И. Менделеева.
Окислительно-восстановительные реакции – это реакции, в которых изменяется степень окисления атомов, входящих в состав реагирующих веществ.
Степень окисления - это тот условный заряд, который приобрел бы элемент, если предположить, что он принял или отдал то или иное число электронов.
Степень окисления позволяет охарактеризовать химические свойства вещества и определить, будет ли частица отдавать либо принимать электроны.
Если идет переход электронов с орбитали одной частицы на орбиталь другой, то такой процесс называется отдачей электронов или окислением (степень окисления повышается). Присоединение электронов, сопровождающееся понижением степени окисления, называется восстановлением.
Частицы, отдающие электроны, называются восстановителями, а частицы, принимающие электроны - окислителями.
В каждой окислительно-восстановительной реакции имеется окислитель и восстановитель.
К типичным восстановителям относятся:
· простые вещества, атомы которых имеют малую электроотрицательность.
Например, металлы и многие неметаллы (водород, углерод);
· отрицательно заряженные ионы неметаллов (S2-, I-, Br-,l- и др.);
· положительно заряженные ионы металлов в низкой степени окисления (Fe2+, Cr2+, Mn2+, Cu+ и др.).
Только восстановителями могут быть соединения, содержащие элементы в низшей степени окисления, равной (№группы –8) (число электронов, которые атом может присоединить на внешний энергетический уровень)
Окислителями могут быть простые вещества, атомы которых характеризуются высокой электроотрицательностью.
Например: кислород, катионы и анионы, содержащие атомы с высокой степенью окисления - Fe3+, Pb4+, Au3+, NO3-, SO42-, CrO42-. Соединения, содержащие элементы в высшей степени окисления, равной номеру группы, могут быть только окислителями.
Если же вещество содержит элемент в промежуточной степени окисления, то в зависимости от условий проведения реакции оно может быть и окислителем, и восстановителем.
В химических окислительно-восстановительных реакциях окисление и восстановление взаимосвязаны. В ходе реакции восстановитель отдает свои электроны, а окислитель принимает. Число отданных электронов должно быть равно числу принятых электронов.
Влияние среды на протекание окислительно-восстановительных реакций. Окислительно-восстановительные потенциалы. Составление уравнений окислительно-восстановительных реакций. Вычисление эквивалентов в окислительно-восстановительных реакциях.
Применяют два метода составления уравнений ОВР: метод электронного баланса и метод полуреакций.
Метод электронного баланса: в методе электронного баланса сравнивают степени окисления исходных и конечных веществ, отражая их изменения в электронных уравнениях. Чтобы уравнять число отданных и принятых электронов, находят наименьшее общее кратное, с помощью которого получают коэффициенты для окислителя и восстановителя. Коэффициенты перед веществами, атомы которых не меняют степени окисления, находят подбором.
Например: составим уравнение реакции свинца с раствором нитрата серебра.
Запишем формулу исходных и конечных веществ реакции и найдём степени окисления элементов:
Pb + AgNO3 → Pb(NO3)2 + Ag.
Свинец, образуя ион свинца, отдаёт два электрона, его степень повышается от 0 до +2. Свинец - восстановитель. Ион серебра, присоединяя электрон, изменяет степень окисления от +1 до 0. Серебро - окислитель. Эти изменения выражаются электронными уравнениями:
Pb0 – 2е- = Pb+2 1 процесс окисления
Ag+1 + 1е- = Ag0 2 процесс восстановления
Pb0 + 2 Ag+1= Pb+2+ 2Ag0
Учитывая, что число электронов, теряемых восстановителем, должно быть равно числу электронов, присоединяемых окислителем, находим коэффициенты 1 и 2 при восстановителе и окислителе. Найденные коэффициенты позволяют перейти от схемы к уравнению реакции:
Pb + 2AgNO3= Pb(NO3)2 + 2Ag.
Электродные потенциалы. Электродные потенциалы металлов и факторы, влияющие на их величину. Понятие о стандартных потенциалах. Стандартный (нормальный) водородный электрод. Гальванические элементы. Электродвижущая сила (ЭДС) гальванических элементов.
При погружении металла в раствор собственной соли на границе раздела «металл–электролит» всегда происходит распределение электрических зарядов в виде двойного электрического слоя. При этом поверхностные катионы металла под действием полярных молекул воды вырываются с его поверхности, переходят в раствор, создавая у поверхности пластинки положительный слой катионов. Избыточные электроны, оставшиеся в металле, сообщают пластинке отрицательный заряд. Катионы металла из раствора притягиваются к отрицательно-заряженной пластине. Устанавливается равновесие, которое описывается уравнением
Me + mH2O 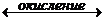 (Me ∙ H2O)mn++ne-.
(Me ∙ H2O)mn++ne-.
восстановление
| м-
е-
т -
а-
л-
л-
| +
+
+
+
+
+
| +
+
+
+
+
| +
++
+
|
Таким образом, на границе «металл-раствор» возникает разность потенциалов – двойной электрический слой, который называется электродным потенциалом (е).
Потенциал, установившийся в условиях равновесия, является равновесным электродным потенциалом.
Величина электродного потенциала зависит:
· от природы металла;
· концентрации катионов;
· температуры.
Количественно эта зависимость выражается уравнением Нернста:
e = e◦ +  ∙ ℓn [Men+],
∙ ℓn [Men+],
где е – равновесный электродный потенциал, В;
e◦ – стандартный электродный потенциал, В;
R – универсальная газовая постоянная (8,31 Дж/моль0К);
T – температура, 0К;
n – число электронов, принимающих участие в процессе (равное заряду иона);
F – постоянная Фарадея, 96500 Кл/моль.
При температуре 25 ◦ С (298 0К), подставляя значение RT/F и преобразовав ln[Men+] в lg[Men+], получим уравнение Нернста:
e = e◦ + 0,059 ∙ lg[Men+]/n.
Потенциал данного электрода при стандартных условиях (P = 1атм, T=298◦K, [Men+] = 1,0 моль/л) – это стандартный электродный потенциал.
Абсолютное значение электродного потенциала определить невозможно, поэтому определяют его относительное значение по отношению к водородному электроду, потенциал которого при стандартных условиях принят за ноль. Водородный электрод состоит из платиновой пластинки, погруженной в раствор H2SO4, где концентрация [H+] равна 1 моль/л. Через раствор пропускают водород (p=1 атм), который адсорбируется платиной. Потенциал водородного электрода обозначают
е◦Н2/2Н+ = 0 (В).
Реакция, идущая на платиновой пластинке,
2Н+ + 2е-  Н2.
Н2.
Для определения стандартного электродного потенциала металла составляют гальванический элемент из исследуемого металла, погруженного в раствор собственной соли (напримерMg/Mg2+) и стандартного водородного электрода (2Н+/H2). Электрохимическую схему данного элемента записывают следующим образом:
Мg/MgSO4//H2SO4/(Н2)Pt.
Измеряют электродвижущую силу элемента (ЭДС=+2,36) и находят потенциал металла
+2,36 = 0 - е◦Mg/Mg2+, отсюда
е◦Mg/Mg2+= -2,36 (В).
Значит, стандартный электродный потенциал магниевого электрода равен -2,36 В.
Если расположить металлы в порядке возрастания их потенциалов, получим ряд стандартных электродных потенциалов (см. приложение, табл.4), который дает количественную электрохимическую характеристику металла (т.е. активность металлов в растворах).
Чем меньше величина электродного потенциала, тем большей восстановительной способностью обладает атом металла (легче отдает валентные электроны).
Ме – ne = Меn+.
Чем больше величина электродного потенциала, тем больше способность ионов металлов восстанавливаться до атома.
Меn+ + ne = Ме.
Электродвижущая сила гальванического элемента (Э.Д.С.) находится как разность электродных потенциалов катода и анода:
ЭДС = Eкатода - Eанода.
Например, ЭДС элемента Даниэля-Якоби для стандартных условий
ЭДС = (+0,34) – (-0,76) = 1,10В.
ЭДС элемента – величина положительная, т.к. окислительно-восстановительный процесс протекает самопроизвольно.
Электролиз расплавов солей
Рассмотрим электролиз расплава хлорида натрия.
При погружении в расплав, состоящий из ионов Na+ и Cl-, двух графитовых электродов, подключенных к источнику тока, в электролите начнется направленное движение ионов, и на электродах будут протекать окислительно-восстановительные процессы.
Схема электролиза расплава натрия
NaCl =Na+ + Cl-


 катод (-) (+) анод
катод (-) (+) анод
Na+ + e-= Na◦ 2Cl- - 2e- = Cl2
Суммарное уравнение реакции:
 2Na+ + 2Cl-электролиз 2 Na + Cl2
2Na+ + 2Cl-электролиз 2 Na + Cl2
 2NaCl электролиз 2Na + Cl2
2NaCl электролиз 2Na + Cl2
Процессы на аноде
Для электролиза используют растворимые (активные) и нерастворимые (инертные) аноды. Во время электролиза растворимые аноды растворяются и ионы металла – анода переходят в раствор. Обычно растворимые аноды изготавливаются из того металла, соль которого подвергается электролизу.
Нерастворимые аноды в окислительно-восстановительных реакциях не участвуют. Обычно это аноды из графита, золота, платины. Первыми на аноде окисляются частицы с меньшим электродным потенциалом. Это, как правило, ионы, не содержащие кислорода, такие как J-, Br- , Cl-, S2- и др. (исключение F-).
Кислородсодержащие кислотные остатки на аноде в водных растворах не окисляются, так как имеют очень высокий электродный потенциал. Вместо них окисляются молекулы воды:
2H2О - 4e- = O2 +4H+ (рH<=7)- нейтральная среда,
4OH- - 4e- = 2H2O + O2 (рH>7)- щелочная среда.
Рассмотрим несколько случаев электролиза водных растворов.
Пример 1.
Схема электролиза водного раствора хлорида меди с инертным анодом
CuCl2 = Cu2+ +2Cl-
H2O ↔ H+ + OH-

 катод(-) Cu2+,H+(H2O) Cl-, OH- (H2O) (+)анод
катод(-) Cu2+,H+(H2O) Cl-, OH- (H2O) (+)анод
Cu2+ + 2e- = Cu0 2Cl- - 2e- = Cl 2
Суммарное уравнение процесса CuCl2→ Cu0 + Cl2.
У меди потенциал больше нуля (е◦Cu/Cu2+ = +0,34В), поэтому на катоде восстанавливается металл, на аноде окисляется безкислородный кислотный остаток.
Пример 2.
Схема электролиза раствора сульфата калия с инертным анодом.
K2SO4 = 2K+ + SO42-
H2O ↔H+ + OH-

 катод(-) 2K+,H+(H2O) SО42-, OH(H2O) (+)анод
катод(-) 2K+,H+(H2O) SО42-, OH(H2O) (+)анод
2H2O + 2e- = H2 + 2OH- 2H2O – 4e- = O2 + 4H+.
Домножим катодный процесс на 2, чтобы уравнять количество электронов катодного и анодного процессов, суммируем уравнения и получим 4H2O+2H2O = 2H2+4OH- + O2 + 4H+
6 H 2 O = 2H2+ O2 + 4H 2 O (4OH- + 4H+),
2H2O = 2H2+ O2.
Так как калий в ряду стандартных электродных потенциалов стоит значительно раньше водорода, то на катоде идет восстановление водорода из воды и накопление ионов ОН-.
У анода будетидти окисление молекул воды вместо кислородсодержащего кислотного остатка и накопление ионов Н+. Таким образом, в катодном пространстве вторичным продуктом будет щелочь, а в анодном – кислота.
Пример 3.
Электролиз водного раствора сульфата никеля с никелевым (активным) анодом.
NiSO4 = Ni2+ + SO42-
H2O ↔ H+ + OH-

 катод(-) Ni2+, H+(H2O) SO42- , OH-(H2O) (+)анод
катод(-) Ni2+, H+(H2O) SO42- , OH-(H2O) (+)анод
Ni2+ +2e- = Ni0 Ni – 2e- = Ni2+
e◦Ni/Ni2+= -0,25B - больше потенциала восстановления ионов водорода из воды (2H2O + 2e- = H2 + 2OH-, e◦ 2H2O/ H2 + 2OH- = -0,41В), поэтому восстанавливается никель, а на аноде происходит окисление металла анода, так как потенциал никеля намного меньше потенциала окисления воды (е◦2H2O/O2 + 4H+ = +1,23В) и потенциала кислородсодержащего кислотного остатка SO42-.
Зако́ныэлектро́лизаФараде́я являются количественными соотношениями, основанными на электрохимических исследованиях, опубликованных Майклом Фарадеем в 1836 году.
Масса электролита, подверженная химическому превращению, а также масса веществ, выделившихся на электродах по законам Фарадея прямо пропорциональны количеству прошедшего через электролит электричества и молярным массам эквивалентов веществ:
m =  или m =
или m = 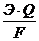 ,
,
где m –масса электролита, подвергшаяся электролизу, или масса веществ, выделившаяся на электродах;
J – сила тока, А; Q = J·t – количество электричества;
Э – молярная масса эквивалентов вещества, г/моль;
F – число Фарадея – 96500 Кл;
t – время электролиза, с.
Пример.
Какой объем водорода выделится при пропускании тока силой в 3 А в течение 1 часа через водный раствор серной кислоты.
Для расчета объема выделившегося газа закон Фарадея имеет вид:
V=  ,
,
где Vэ- эквивалентный объем газа.
Для водорода Vэ =  , где Vm- молярный объем газа - 22,4л/моль –постоянная величина для любого газа, 2 – количество электронов, затраченных в процессе восстановления водорода (2Н+ + 2е- = Н2).
, где Vm- молярный объем газа - 22,4л/моль –постоянная величина для любого газа, 2 – количество электронов, затраченных в процессе восстановления водорода (2Н+ + 2е- = Н2).
Таким образом, V(Н2) =  =1,25л.
=1,25л.
Применение в промышленности. Электролиз широко применяется в различных отраслях промышленности. В химической промышленности электролизом получают такие важные продукты как хлор и щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, перманганат калия, органические соединения, химически чистые водород, кислород, фтор и ряд других ценных продуктов.
В цветной металлургии электролиз используется для рафинирования металлов, для извлечения металлов из руд. К числу металлов, получаемых электролизом расплавленных сред относятся алюминий, магний, цирконий, титан, уран, бериллий и ряд других металлов.
Электролиз применяют во многих отраслях машиностроения, радиотехники, электронной, полиграфической промышленности для нанесения тонких покрытий металлов на поверхность изделий для защиты их от коррозии, придания декоративного вида, повышения износостойкости, жаростойкости, получения металлических копий.
6.Радиоактивность. Изотопы и изобары. Виды излучений. Ядерные превращения. Ряды радиоактивных превращений. Ядерное деление и ядерный синтез.
Радиактивность- самопроизвольное превращение неустойчивого изотопа одного хим элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер.
В результате радиактивного распада происходят ядерные превращения, сопровождающиеся излучением.
Ядерные превращения описываются аналогично обычным химическим реакциями. При этом суммарные массы и атомные номера в левой и правой частях уравнений должны быть равны. Изотопы -атомы, ядра которых имеют одинаковое число протонов. Изобары - атомы имеющие одинаковые массовые числа.
Пример:
ПРИМЕРЫ ИЗОТОПОВ, ИЗОБАРОВ И ИЗОТОНОВ СРЕДИ ПРИРОДНЫХ НУКЛИДОВ.
(ТАБЛИЦА)
| ИЗОТОПЫ
| ИЗОБАРЫ
|
| Нуклиды
| Z
| A
| N
| Нуклиды
| Z
| A
| N
|

|
|
|
| 
|
|
|
|
|
|
|
| 
|
|
|
|
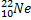
|
|
|
| 
|
|
|
|

|
|
|
| 
|
|
|
|

|
|
|
| 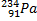
|
|
|
|
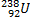
|
|
|
| 
|
|
|
|
Нуклиды с одинаковым 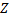 , но различными
, но различными  называются изотопами, нуклиды с одинаковым
называются изотопами, нуклиды с одинаковым  и различными
и различными  – изобарами
– изобарами
Виды излучений:
Альфа-излучение -представляет собой поток ядер гелия, с зарядом +2 и массой 4 а.е.м.альфа-лучи испускают ядра самых тяжелых элементов, менее стабильных.поскольку ядра гелия имеют положит заряд, они притягивают электроны и вследствии этого обладают высокой ионизирующей способностью.однако сравнительно большой размер ядер гелия ограничивает проникающую способность альфа излуч по сравнению с бета и гамма.
Бета излучение представляет собой поток электронов(позитронов), движущихся со скоростью света.электроны испускаются неустойчивыми ядрами в рез распада нейтрона.
Позитроны испускаются радиактивными ядрами. Они являются аналогами электронов, но в отличии от них имеют положительный заряд. они образуются в результате превращения протона в нейтрон.
Гамма излучения представляет собой электромагнитное излучение с высокой энергией, подобно рентгеновским лучам, но с меньшей длиной волн. Высокая энергия и малая длина волны обуславливает большую проникающую способность.испускание гамма происходит, когда нуклид испускает альфа и бета частицы.
Растворы.
Дисперсные системы. Основные характеристики дисперсных систем. Степень дисперсности. Классификация дисперсных систем. Гетерогенные и гомогенные дисперсные системы. Гетерогенные равновесия.
Дисперсные системы - гетерогенные системы из двух или большего числа фаз с сильно развитой поверхностью раздела между ними.
Все дисперсионный системы по размеру частиц дисперсионной фазы можно классифицировать на молекулярно-ионные (<1нм., к данной группе относятся разнообразные истинные растворы неэлектролитов: глюкозы, мочевины, спирта, сахарозы.), коллоидные (от 1 до 100нм. Такие частицы легко проникают через поры бумажных фильтров.Примером коллоидной системы являются растворы желатина, альбумина, гуммиарабика, коллоидные растворы золота и серебра.), грубодисперсные (>100нм, к ним относят эмульсии и суспензии).
По интенсивности взаимодействия между веществами дисперсной фазы и дисперсионной среды (только для систем с жидкой дисперсионной средой), по предложению Г. Фрейндлиха различают следующие дисперсные системы:
- Лиофильные (гидрофильные, если ДС – вода): Для них характерно сильное взаимодействие частиц ДФ с молекулами ДС. В предельном случае наблюдается полное растворение.
- Лиофобные (гидрофобные, если ДС – вода): эмульсии, суспензии, золи. Для них характерно слабое взаимодействие частиц ДФ с молекулами ДС.
Классификация дисперсных систем по агрегатному состоянию фаз
Степень дисперсности: D’=∑S/V где ∑S - суммарная межфазная поверхность или поверхность всех частиц дисперсной фазы; V - объем частиц дисперсной фазы.
Гомогенная система – система, состоящая из одной фазы.
Гетерогенная система – система, состоящая из двух или большего числа фаз.
Гетерогенные равновесия возникают в гетерогенных системах, т. е. системах, состоящих из нескольких фаз, разделенных реальными физическими границами раздела фаз.
Раствор, находящийся в равновесии с твердой фазой, называют насыщенным относительно осадка. Такой раствор представляет собой равновесную гетерогенную систему.
Охарактеризуем этот равновесный процесс количественно константой равновесия, применив к данной системе закон действующих массa = fa × С.
Крав. = C(+)C(-)/C илиKрав=a(+)a(-)/a
Произведение двух констант дает новую постоянную величину, которую называют термодинамической константой растворимости и обозначают Kр:
Kp= C(+)*C(-), где С – равновесные концентрации катионов и анионов (моль/л) в насыщенном растворе малорастворимого сильного электролита.
Эту величину часто называют произведением растворимости и обозначают ПР; это устаревшее обозначение.
Таким образом, в насыщенном растворе малорастворимого сильного электролита произведение равновесных активностей его ионов есть величина постоянная при данной температуре.





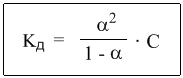 -закон разбавления Оствальда.
-закон разбавления Оствальда. (Me ∙ H2O)mn++ne-.
(Me ∙ H2O)mn++ne-. ∙ ℓn [Men+],
∙ ℓn [Men+], Н2.
Н2.

 катод (-) (+) анод
катод (-) (+) анод 2Na+ + 2Cl-электролиз 2 Na + Cl2
2Na+ + 2Cl-электролиз 2 Na + Cl2 2NaCl электролиз 2Na + Cl2
2NaCl электролиз 2Na + Cl2
 катод(-) Cu2+,H+(H2O) Cl-, OH- (H2O) (+)анод
катод(-) Cu2+,H+(H2O) Cl-, OH- (H2O) (+)анод
 катод(-) 2K+,H+(H2O) SО42-, OH(H2O) (+)анод
катод(-) 2K+,H+(H2O) SО42-, OH(H2O) (+)анод
 катод(-) Ni2+, H+(H2O) SO42- , OH-(H2O) (+)анод
катод(-) Ni2+, H+(H2O) SO42- , OH-(H2O) (+)анод или m =
или m = 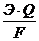 ,
, ,
, , где Vm- молярный объем газа - 22,4л/моль –постоянная величина для любого газа, 2 – количество электронов, затраченных в процессе восстановления водорода (2Н+ + 2е- = Н2).
, где Vm- молярный объем газа - 22,4л/моль –постоянная величина для любого газа, 2 – количество электронов, затраченных в процессе восстановления водорода (2Н+ + 2е- = Н2). =1,25л.
=1,25л.

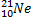

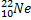




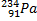
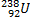
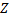 , но различными
, но различными  называются изотопами, нуклиды с одинаковым
называются изотопами, нуклиды с одинаковым  и различными
и различными  – изобарами
– изобарами


