Продукты замещения водорода в углеводородах гидроксильной группой (оксигруппой) называют спиртами.
Общая формула спиртов  .
.
Гидроксильные производные ароматических углеводородов называют ароматическими спиртами в том случае, если гидроксильная группа находится в боковой цепи, а фенолами – когда гидроксильная группа связана с углеродом ядра.
По характеру углеводородного радикала алифатические спирты делятся на насыщенные и ненасыщенные. В зависимости от числа гидроксильных групп в молекуле различают:
Одноатомные спирты

Двухатомные спирты
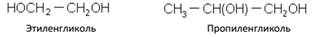
Трехатомные спирты
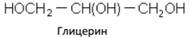
Углеродный атом способен удержать только одну гидроксильную группу; не может гидроксил состоять и при кратной углеродной связи, хотя из этих правил есть исключения.
ОДНОАТОМНЫЕ СПИРТЫ
Изомерия
Изомерия спиртов обусловлена строением радикала (изомерия углеродного скелета) и положением гидроксила в молекуле, в зависимости от того, с каким атомами углерода он связан (с первичным, вторичным или третичным) различают первичные, вторичные и третичные спирты:

Номенклатура
Общая формула гомологического ряда предельных одноатомных спиртов:

Названия спиртов образуют, добавляя окончание – ОЛ к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу. Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа. Кроме того, широко распространена радикально – функциональная номенклатура, по которой название спирта производится от соответствующего углеводородного радикала с обавлением слова «спирт», например:  – этиловый спирт (этанол).
– этиловый спирт (этанол).
Начиная с третьего представителя гомологического ряда – пропанола, у спиртов появляются изомеры:

В соответствии с международной номенклатурой цифрой после названия спирта обозначают, с каким по счету углеродным атомом связана гидроксильная группа, например:
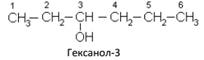
Правило составления названий алканолов с разветвленной цепью по Международной единой химической номенклатуре IUPAC (ИЮПАК)
1) Найти в молекуле самую длинную прямую углеродную цепь, связанную с гидроксильной группой:

2) Пронумеровать атомы С в этой цепи так, чтобы атом С, связанный с группой –ОН, имел наименьший номер:

3) Назвать алкан, соответствующий самой длинной цепи, указав положение всех заместителей:

4) Обозначить гидроксильную группу суффиксом – ОЛ:

5) Цифрой указать положение группы – ОН:

Получение спиртов
1. Гидратация алкенов
Гидратация алкенов, протекает по правилу Марковникова:

Кроме прямой гидратации этилена (пропилена), существует также сернокислотная гидратация, протекающая в две стадии:
– на первой стадии этилен поглощается серной кислотой:

– на второй стадии этилсерная кислота гидролизуется с образованием этилового спирта и серной кислоты:

При гидратации гомологов этилена в соответствии с правилом Марковникова образуются вторичные или третичные спирты:

2. Гидролиз галогеноалкинов
При действии водного раствора NaOH атом галогена в галогеналкане замещается группой – OH:

Обратите внимание, что при действии спиртового раствора щелочи (KOH, NaOH) происходит отщепление галогеноводорода и образование алкена (см. 3 пункт “получение алкенов”):

3. Гидрирование альдегидов и кетонов
Дегидрирование спиртов по своей химической сущности является окислением. Обратная реакция – гидрирование альдегидов и кетонов – является, таким образом, их восстановлением.
В присутствии катализаторов (Ni, Pt, Pd, Co) альдегиды восстанавливаются до первичных спиртов, а кетоны – до вторичных спиртов:

4. Специфические способы получения метанола и этанола

Этанол образуется при брожении (ферментации) углеводов – глюкозы или крахмала:

Физические свойства
Рассмотрим электронное строение молекулы спирта:

Молекулы алканов представляют собой диполи. Они содержат полярные связи
C – H, C – O, O – H. Дипольные моменты связей C → O и O ← H направлены в сторону атома кислорода, поэтому атом O имеет частичный отрицательный заряд δ-, а атомы C и H – частичные положительные заряды δ+. Полярность связи О – Н больше полярности связи С – О вследствие большей разности электроотрицательностей кислорода и водорода.
Полярность связи О – Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов.
В гомологическом ряду спиртов нет газообразных веществ.

Все алканолы легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют. Метанол, этанол, пропанол неограниченно растворяются в воде; с увеличением числа углеродных атомов растворимость алканолов в воде уменьшается; высшие
спирты не растворяются в воде.
Химические свойства
Химические свойства алканов определяются особенностями их электронного строения:

наличием в их молекулах полярных связей О – Н, С – О, С – Н. Для алканолов характерны реакции, которые идут с расщеплением этих связей: реакции замещения, отщепления, окисления.
I. Реакции замещения
1. Замещение атома водорода гидроксильной группы вследствие разрыва связи О – Н:
А. Взаимодействие с активными металлами с образованием алкоголятов (алканолятов) металлов:

Эти реакции протекают только в безводной среде. В присутствии воды алкоголяты полностью гидролизуются:

Б. Взаимодействие с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации):


Реакции этерификации являются обратимыми реакциями.
2. Замещение гидроксильной группы вследствие разрыва связи С – О:
А. Взаимодействие с галогеноводородами с образованием галогеналканов:

Спирты можно превратить в галогенпроизводные действием и других реагентов, например хлоридов фосфора:

Б. Взаимодействие с аммиаком с образованием аминов.
Реакции идут при пропускании смеси паров спирта с аммиаком при 300 °С над оксидом алюминия:

При избытке спирта алкильным радикалом могут замещаться 2 или 3 атома водорода в молекуле NH3:

II. Реакции отщепления
1. Дегидратация, т. е. отщепление воды Дегидратация спиртов может быть двух типов: межмолекулярная и внутримолекулярная.
А. Межмолекулярная дегидратация спиртов с образованием простых эфиров R – O – R'.
Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:

Б. Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:

Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева: «При образовании воды наиболее легко отщепляется водород от соседнего наименее гидрогенизированного атома углерода»

2. Дегидрирование (разрыв связей О – Н и С – Н):
А. При дегидрировании первичных спиртов образуются альдегиды:

В организме человека этот процесс происходит под действием фермента алкогольдегидрогенозы.
Б. При дегидрировании вторичных спиртов образуются кетоны:
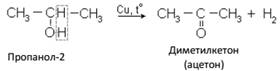
В. Третичные спирты не дегидрируются.
III. Реакция окисления
1. Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла:

2. Неполное окисление под действием окислителей: кислорода воздуха в присутствии катализаторов (например, Cu), перманганата калия, дихромата калия и др.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования:

Таким образом, реакции дегидрирования спиртов по своей химической сущности являются реакциями окисления.



 .
.
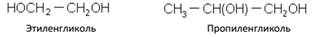
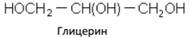


 – этиловый спирт (этанол).
– этиловый спирт (этанол).




































