Если радикалы, замещающие атомы водорода в бензольном ядре, представляют собой остатки предельных углеводородов, то общая формула этих углеводородов СnH2n-6. Эту формулу можно легко вывести.
Бензольное кольцо способно гидрироваться с присоединением шести атомов водорода. В качестве примера гидрированного производного гомолога бензола рассмотрим следующую формулу:
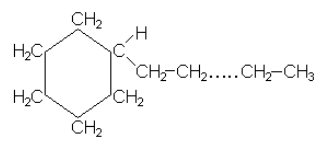
Как видно из этой формулы, на каждый атом углерода в молекуле этого вещества приходится по 2 атома водорода. Атом углерода в бензольном кольце, соединенный с боковой цепью углеродных атомов, связан с одним водородным атомом, но углерод в конце цепи связан с тремя водородными атомами (СН2) и, таким образом, в среднем каждый из этих двух атомов углерода связан с двумя атомами водорода. Таким образом, формула гидрированного гомолога бензола СnH2n. При гидрировании к бензольному ядру присоединилось шесть атомов водорода, следовательно, исходный ароматический углеводород содержал на шесть атомов водорода меньше, и его формула CnH2n-6.
Физические свойства
Первые члены гомологического ряда бензола – бесцветные жидкости со специфическим запахом. Они легче воды и в ней не растворимы. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями для многих органических веществ. Бензол имеет характерный, достаточно приятный запах, но при этом сильно токсичен.
Химические свойства
Ароматические углеводороды обладают большей склонностью к реакциям замещения, чем к реакциям присоединения. Характерна также большая устойчивость бензольного кольца.
I. Реакции присоединения
Присоединение к ароматическим углеводородам происходит только в присутствии катализаторов и при повышенной температуре.
А. Присоединение водорода

Циклогексан – важный продукт и хороший растворитель, а также полупродукт для синтеза адипиновой кислоты и капролактама.
Б. Галогенирование
На солнечном свету под влиянием ультрафиолетового излучения
бензол присоединяет хлор и бром с образованием гексагалогенидов. Последние при нагревании теряют три молекулы галогеноводорода и дают тригалогенобензолы:

В. Реакции окисления
Устойчивость бензольного ядра к окислению является одним из важнейших свойств ароматических соединений. Такие окислители, как азотная кислота, хромовая смесь, раствор перманганата калия, перекись водорода, при обычных условиях на бензол не действуют. К этим окислителям он даже более устойчив, чем предельные углеводороды. Это свойство отличает также ароматические соединения от соединений с двойными связями.
При действии кислорода воздуха на бензол в присутствии катализатора пятиокиси ванадия (V2O5) при температуре 400 ºС получается малеиновый ангидрид (промышленный способ):

Подобно другим непредельным соединениям, бензол присоединяет озон, причем дает триозонид – чрезвычайно взрывчатое вещество. Под действием воды триозонид разрушается и образуется диальдегид – глиоксаль.

При действии окислителей на гомологи бензола окислению подвергаются боковые цепи – алкильные радикалы. Какой бы сложности ни была цепь, она под действием сильных окислителей разрушается, за исключением ближайшего к ядру атома углерода,
который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают одноосновную кислоту – бензойную:

Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:

По образующимся в результате окисления ароматическим кислотам можно судить о положении боковых цепей и их числе.
II. Реакции замещения
А. Галогенирование
Бензол и его гомологи взаимодействуют с хлором или бромом в присутствии катализаторов-безводных AlCl3, FeCl3, AlBr3:

Из толуола по этой реакции получается смесь орто- и параизомеров:

Роль катализаторов заключается в поляризации нейтральной молекулы галогена с образованием из нее электрофильной частицы:
Cl – Cl + AlCl3 → Cl+[AlCl4]-
Б. Нитрование
Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии нитрующей смеси (смеси концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:

В. Сульфирование
Реакция легко проходит под действием «дымящей» серной кислоты (олеума):

Эти три реакции отличают ароматические углеводороды от углеводородов других классов.

















