Раствор – гомогенная система, состоящая из двух или более самостоятельных веществ и продуктов их взаимодействия. Вещество раздроблено до молекул или ионов размеров менее 1нм.
Растворы – это физико-химические системы, а не механические смеси частиц растворителя и растворенного вещества (Менделеев, 1887г)
Коэффициент растворимости – масса безводного вещества, растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора.
Насыщенный раствор – раствор, в котором растворяемое вещество при данной температуре не растворяется, так как находится в равновесии с избытком растворенного вещества.
Ненасыщенный раствор – раствор, в котором еще можно растворить добавочное количество растворенного вещества.
Концентрация раствора – численная величина, которая показывает содержание растворенного вещества в определенном количестве или объеме раствора.
Способы выражения концентрации растворов:
1. Массовая доля растворенного вещества – это отношение массы растворенного вещества к общей массе раствора. Расчёт массовой доли растворённого вещества (%) производится по формуле:

2. Молярная концентрация раствора вещества – отношение количества, растворенного вещества к объему этого раствора.

Значит, одномолярный раствор (1М) – это раствор, в котором 1 моль растворённого вещества соответствует 1 л раствора.
3. Нормальность – число эквивалентов вещества, растворенного в 1 л раствора. Нормальность раствора рассчитывается по формуле: 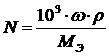
Согласно теории электролитической диссоциации С.Аррениуса (1887г.) при растворении в воде электролиты распадаются на свободные ионы. Например: 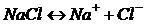
Проводниками электрического тока растворы веществ становятся, когда они содержат ионы, которые в электрическом поле приходят в направленное движение.
Гидратированные ионы можно изобразить следующим образом:

Электролитическая диссоциация – распад электролита на сольватированные (гидратированные) ионы под действием молекул растворителя.
Пример реакции диссоциации: AlCl3 → Al 3++ 3Cl-
Степень электролитической диссоциации (a) – это отношение числа молекул электролита, распавшихся на ионы, к общему числу растворенных молекул. Расчет проводится по формуле:
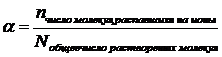
Вещества имеют разные значения степени электролитической диссоциации, при этом:
1) если a = 0, то вещество – неэлектролит (керосин, бензин, ацетон),
2) если a ≈ 1 или > 30 %, то вещество – сильный электролит (соли, неорганические кислоты, щелочи),
3) если a от 2 до 30 %, то вещество – средний электролит.
Слабыми электролитами являются органические кислоты, слабые неорганические кислоты, Н2О, некоторые основания, соли.
Реакциями ионного обмена (РИО)- реакции между ионами в водном растворе. Эти реакции протекают только в растворах и не сопровождаются изменением степеней окисления реагирующих веществ.
Реакции ионного обмена протекают необратимо в случае, если:
1) образуется твердое труднорастворимое вещество - осадок (¯),
2) выделяется летучее вещество - газ (),
3) образуется малодиссоциирующее соединение (слабые электролиты, в том числе Н2О).
Пример оформления РИО:
Al2(SO4)3+3BaCl2 = 2AlCl3+3BaSO4¯ - молекулярное уравнение реакции
Р р р н




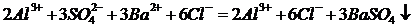 -полное ионное уравнение
-полное ионное уравнение
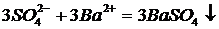 - сокращенное ионное уравнение.
- сокращенное ионное уравнение.
Десятичный логарифм концентрации ионов водорода, взятый с обратным знаком, называется водородным показателем (рН).
рН = -lg[Н+] – так определяется водородный показатель. Он связан с концентрациями ионов водорода и гидроксильных ионов в исследуемой среде, что можно подтвердить следующим образом:
100 107 1014



 рН 0 7 14
рН 0 7 14
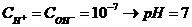 - среда нейтральная,
- среда нейтральная, 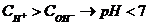 - среда кислая,
- среда кислая, 
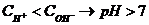 - среда щелочная.
- среда щелочная.
Задания для самоконтроля:
Задание № 1. Напишите уравнения электролитической диссоциации:
а) нитрата калия, б) хлорида кальция, в) сульфата натрия, г) йодоводорода, д) гидроксида калия, е) серной кислоты.
Задание № 2. Напишите в ионной форме уравнения реакций, представленных схемами: а) Ca(NO3)2+K2CO3→, б) CaCO3+НNO3 →, в) NaOH+ H2SO4→, г) MgCO3 + H2SO4 →.
Задание № 3. Вычислите массовую долю гидроксида натрия в растворе, полученном растворением 10 граммов NaOH в: а) 40 г, б) 50 г, в) 250 г, г) 120 г воды.
Задание № 4. Вычислите массы карбоната натрия и воды, необходимые для приготовления 50 г. 5-процентного раствора карбоната натрия.
Задание № 5. Для штукатурных работ необходима 6% аммиачная вода. Сколько литров 25% раствора аммиака (NH3) потребуется для изготовления 3 литров 6% аммиачной воды?
Задание № 6. Казеиновый клей в порошке, содержит гидроксид кальция (Ca(OH)2), карбонат натрия (Na2CO3), сульфат меди (II) и фторид натрия (NaF). Напишите молекулярные, полные ионные и сокращенные уравнения химических реакций, происходящих между минеральными веществами клея при его растворении в воде.





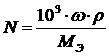
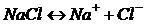

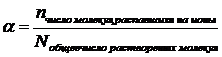




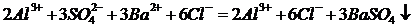 -полное ионное уравнение
-полное ионное уравнение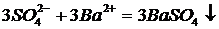 - сокращенное ионное уравнение.
- сокращенное ионное уравнение.


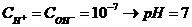 - среда нейтральная,
- среда нейтральная, 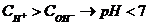 - среда кислая,
- среда кислая, 
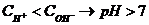 - среда щелочная.
- среда щелочная.


