Очевидно, что величина межфазного скачка потенциала должна зависеть от очень большого числа факторов. В первую очередь это химическая природа электродного материала, температура, концентрация и природа потенциалопределяющих частиц в растворе.
Данная взаимосвязь была установлена и носит название уравнения Нернста
Е = Е 0 +  ln
ln  . (9.3)
. (9.3)
В этом уравнении Е – электродный потенциал (В); Е0 - стандартный электродный потенциал (В); R = 8,31  универсальная газовая постоянная; Т -температура (К); n – число электронов в полуреакции; F – число Фарадея; [ ox ] – концентрация
универсальная газовая постоянная; Т -температура (К); n – число электронов в полуреакции; F – число Фарадея; [ ox ] – концентрация
окисленной формы потенциалопределяющих частиц (моль/л); [ red ] – концентрация восстановленной формы потенциалопределяющих частиц (моль/л).
Например, для полуреакции окисления
Mn2++4H2O - 5  = MnO4- + 8H+,(9.4)
= MnO4- + 8H+,(9.4)
в которой слева – восстановленная форма потенциалопределяющих частиц, а справа – окисленная форма, уравнение Нернста для стандартной температуры будет иметь следующий вид:
E = + 1,507 +  ln
ln  .
.
Введем несколько упрощений. При стандартной температуре 298К и переходе к десятичным логарифмам получим  =0,059В. Концентрация молекул воды в водных растворах может считаться величиной постоянной и в уравнение не включаться. В результате для стандартной температуры уравнение принимает следующий вид:
=0,059В. Концентрация молекул воды в водных растворах может считаться величиной постоянной и в уравнение не включаться. В результате для стандартной температуры уравнение принимает следующий вид:
Е = Е 0 +  lg
lg  , (9.5)
, (9.5)
E = +1,507 + 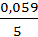 lg
lg 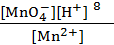 .
.
Подлогарифмическое выражение является константой равновесия (К) для реакции (9.4) Кс = 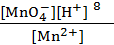 , поэтому уравнение (9.5) может быть представлено в следующем виде:
, поэтому уравнение (9.5) может быть представлено в следующем виде:
Е = Е 0 +  lg К. (9.6)
lg К. (9.6)
Если электродная система состоит из металлического электрода, опущенного в раствор, содержащий одноименные ионы Me 0 -  = Me+n, то уравнение Нернста при стандартной температуре приобретает следующий вид, учитывая, что [ Me 0] – величина постоянная:
= Me+n, то уравнение Нернста при стандартной температуре приобретает следующий вид, учитывая, что [ Me 0] – величина постоянная:
Е = Е 0 +  lg [Me+n]. (9.7)
lg [Me+n]. (9.7)
Взаимосвязь между константой равновесия и величиной ЭДС может быть получена из ур.2.9 и ур.9.6.
D G = - RT ln K и Δ G = -nF Δ Е.
Приравнивая правые части, получим
RT ln Kp = nF Δ Е,
откуда
ln K =  .
.
Для стандартной температуры и десятичных логарифмов
lg K =  . (9.8)
. (9.8)
ЗАКОНЫ ФАРАДЕЯ
Использование электрохимичеких систем в технике возможно в двух вариантах.
1. Преобразование внутренней энергии самопроизвольных окислительно-восстановительных реакций в энергию постоянного тока. Это преобразование осуществляется в устройствах, называемых «химические источники тока».
2. Получение веществ за счет проведения несамопроизвольных ОВР под действием постоянного электрического тока. Эти процессы получили название «электролиз».
В обоих случаях существует взаимосвязь между массой реагирующих или образующихся на электродах веществ и количеством протекшего электричества. Эта взаимосвязь была установлена и носит название законов Фарадея.
1-й закон Фарадея: масса вещества, прореагировавшего или образовавшегося на электроде, пропорциональна количеству прошедшего через электролит электричества.
M ~ Q,
где m (г) – масса вещества; Q (Кл) – количество электричества.
Для перехода к уравнению вводится коэффициент пропорциональности q
M = qQ. (9.9)
Количество электричества Q определяется как произведение силы тока I (А) на время t (c).
m = q I t. (9.10)
2-й закон Фарадея: Теоретическая масса вещества, прореагировавшего или образовавшегося на электроде, при прохождении через него 1-го фарадея (F) электричества называется электрохимическим эквивалентом q.
q =  (9.11)
(9.11)
где М (г/моль)- молярная масса вещества; n – число электронов в полуреакции; F (Кл/моль)- число Фарадея.
Объединяя аналитические выражения 1-го и 2-го законов получим
m =  I t B т. (9.12)
I t B т. (9.12)
В этом уравнении величина В т называется «выход по току» и показывает долю тока, пошедшего на данную реакцию, если она протекала на электроде не одна. Определяется экспериментально, как отношение практически полученной массы вещества к ее теоретическому значению
В т =  ∙ 100%. (9.13)
∙ 100%. (9.13)
Если необходимо рассчитать объем образовавшегося в электродной реакции газа, то ур.9.12 может быть преобразовано
V =  I t В т, (9.14)
I t В т, (9.14)
где Vm (л/моль) – молярный объем – 22,4 л/моль.



 ln
ln  . (9.3)
. (9.3) универсальная газовая постоянная; Т -температура (К); n – число электронов в полуреакции; F – число Фарадея; [ ox ] – концентрация
универсальная газовая постоянная; Т -температура (К); n – число электронов в полуреакции; F – число Фарадея; [ ox ] – концентрация = MnO4- + 8H+,(9.4)
= MnO4- + 8H+,(9.4) ln
ln  .
. =0,059В. Концентрация молекул воды в водных растворах может считаться величиной постоянной и в уравнение не включаться. В результате для стандартной температуры уравнение принимает следующий вид:
=0,059В. Концентрация молекул воды в водных растворах может считаться величиной постоянной и в уравнение не включаться. В результате для стандартной температуры уравнение принимает следующий вид: lg
lg  , (9.5)
, (9.5)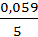 lg
lg 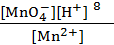 .
. lg К. (9.6)
lg К. (9.6) .
. . (9.8)
. (9.8) (9.11)
(9.11) ∙ 100%. (9.13)
∙ 100%. (9.13) I t В т, (9.14)
I t В т, (9.14)


