Скорость реакции, протекающей при постоянном объеме, обычно пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
Рассмотрим случай, когда молекула вещества А является неустойчивой и самопроизвольно распадается на вещества В и С (А = В + С).
Например: Н2СО3 = Н2О + СО2
Очевидно, что число молекул, распадающихся в единицу времени, будет пропорционально общему числу молекул А. Если объем реакционной смеси будет оставаться постоянным, то концентрация молекул А будет уменьшаться со
скоростью, пропорциональной этой концентрации. Если обозначить исходную концентрацию вещества А как [ A ], то скорость уменьшения концентрации будет - d[A]/dt. Таким образом для элементарной реакции можно записать
-d[A]/dt = k [A]. (6.2)
Множитель k - называют «константа скорости» реакции первого порядка. Это скорость реакции, когда концентрация реагентов равна 1. Константа скорости определяется природой реагирующих веществ и не зависит от их концентрации. Помимо природы веществ, на величину константы оказывают влияние температура и присутствие катализатора. Размерность константы скорости С-1. Так если k = 0,001с-1, то это означает, что за одну секунду будет реагировать 1/1000 от исходного числа молекул.
Если химическая реакция происходит в результате столкновения и взаимодействия двух молекул А и В (А + В = С), то скорость такой реакции будет пропорциональна числу столкновений, которое, в свою очередь, пропорционально произведению концентраций реагирующих веществ А и В.
Учитывая сказанное, уравнение скорости реакции будет иметь вид
-d[A]/dt = -d[B]/dt = k[A][B],
так как каждая молекула вещества А реагирует с одной молекулой вещества В. В этом уравнении k - константа скорости реакции второго порядка.
В общем виде для реакции: aA + bB = cC + dD уравнение скорости запишется в следующем виде:
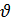 = k [A]а [B]в. (6.3)
= k [A]а [B]в. (6.3)
Это выражение носит название закона действующих масс и было сформулировано в XIX веке двумя норвежскими химиками Гульдбергом и Вааге:
«При постоянной температуре скорость элементарной химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам».
Сумма стехиометрических коэффициентов n = a + b называется «порядок реакции». Это справедливо только для элементарных (одностадийных) реакций, к которым применимо понятие «молекулярность». Оно характеризует число частиц, участвующих в элементарном акте. Различают моно-, би- и тримолекулярные реакции, в которых участвуют соответственно одна, две и три частицы.
PCl5(г) ⇄ PCl3(г) + Cl2(г) (мономолекулярная)  =
=  [PCl5]
[PCl5]
I2(г) + H2(г) ⇄ 2HI(г) (бимолекулярная)  =
=  [I2][H2]
[I2][H2]
2NO(г) + Cl2(г) ⇄ 2NOCl(г) (тримолекулярная)  =
=  [NO]2[Cl2]
[NO]2[Cl2]
Столкновение четырех частиц одновременно является практически невероятным.
В случае сложных реакций совокупность элементарных стадий составляет механизм химической реакции. Стадия, имеющая наименьшую скорость, определяет скорость реакции в целом и называется «лимитирующей стадией» реакции.
Порядок реакции определяет характер зависимости скорости от концентрации. Истинный порядок реакции определяется по уравнению, описывающему скорость лимитирующей стадии процесса, полученному из эксперимента. Таким образом, общий (суммарный) кинетический порядок реакции - это сумма показателей степеней при концентрациях реагирующих веществ в уравнении лимитирующей стадии реакции, определенном экспериментально.
Рассмотрим более подробно такое понятие, как «механизм реакции».
Для реакции NO2(г) + CO(г) = NO(г) + CO2(г)
уравнение скорости  =
=  [NO2][CO].
[NO2][CO].
Однако экспериментально установленное уравнение скорости этой реакции имеет другой вид:  =
=  [NO2]2[ CO]0.
[NO2]2[ CO]0.
Поскольку порядок реакции не соответствует стехиометрическим коэффициентам ее полного уравнения, реакция не может протекать в одну стадию, которая включала бы столкновение между молекулами NO2 и CO.
Установлено, что эта реакция протекает в две бимолекулярные стадии:
1) NO2(г) + NO2(г) → NO(г) + NO3(г)  =
=  [NO2]2
[NO2]2
2) NO3(г) + CO(г) → NO2(г) + CO2(г)  =
=  [NO3][CO]
[NO3][CO]
Каждая из этих стадий называется элементарной реакцией. На первой стадии происходит столкновение двух молекул NO2, в результате чего атом кислорода переходит от одной из молекул NO2 к другой. Образовавшийся NO3 затем быстро передает атом кислорода молекуле CO, в результате чего получается молекула CO2 и молекула NO2.
Первая стадия является очень медленной и определяет скорость всей реакции («лимитирующая стадия»). Таким образом, данная реакция имеет второй порядок по NO2(г) и нулевой порядок по CO(г) Суммарный порядок полной реакции определяется молекулярностью лимитирующей стадии и равен 2.
Частица NO3(г) является интермедиатом (промежуточной частицей) поскольку она не входит ни в число реагентов, ни в число продуктов, а лишь образуется в одной элементарной реакции и расходуется в следующей. В этой реакции показатели степени при концентрациях реагентов (два для диоксида азота и нуль для монооксида углерода) со стехиометрическими коэффициентами не совпадают. Они отражают молекулярность (и стехиометрию) лимитирующей стадии (1) и отсутствие влияния участников второй быстрой стадии на скорость реакции в целом.



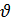 = k [A]а [B]в. (6.3)
= k [A]а [B]в. (6.3) =
=  [PCl5]
[PCl5]

