

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
1. С6Н12 → Pt, 300 °C → С6Н6 + ЗН2 (дегидрирование циклоалканов)
2. н- С6Н14 → Cr2O3, 300 °C → С6Н6 + 4Н2 (дегидроциклизация алканов)
3. ЗС2Н2 → С, 600 °C → С6Н6 (циклотримеризация ацетилена, реакция Зелинского)
Химические свойства ароматических углеводородов
По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Для аренов наиболее характерны реакции, идущие с сохранением ароматической системы, а именно реакции замещения атомов водорода, связанных с циклом. Другие реакции (присоединение, окисление), в которых участвуют делокали-зованные С-С связи бензольного кольца и нарушается его ароматичность, идут с трудом.
1. C6H6 + Cl2 → AlCl3 → C6H5Cl + HCl (галогенирование)
2. C6H6 + HNO3 → H2SO4 → C6H5—NO2 + H2O (нитрование)

3. С6Н6 → H2SO4 → С6Н5—SO3H + H2O (сульфирование)
4. С6Н6 + RCl → AlCl3 → С6Н5—R + HCl (алкилирование)
5. (ацилирование)

6. С6Н6 + ЗН2 → t, Ni → С6Н12 циклогексан (присоединение водорода)
7. (1,2,3,4,5,6-гексахлороциклогексан, присоединение хлора)

8. С6Н5—CH3 + [О] → С6Н5—COOH кипячение с раствором КMnO4 (окисление алкилбензолов)
Галогеноуглеводороды
Галогеноуглеводородами называются производные углеводородов, в которых один или несколько атомов водорода заменены на атомы галогена.
Способы получения галогеноуглеводородов
1. CH2=CH2 + HBr → CH3—CH2Br (гидрогалогенирование ненасыщенных углеводородов)
CH≡CH + HCl → CH2=CHCl
2. CH3CH2OH + РCl5 → CH3CH2Cl + POCl3 + HCl (получение из спиртов)
CH3CH2OH + HCl → CH3CH2Cl + Н2O (в присутствии ZnCl2, t°C)
3. а) CH4+ Cl2 →hv→ CH3Cl + HCl (галогенирование углеводородов)
б)

Химические свойства галогеноуглево-дородов
Наибольшее значение для соединений этого класса имеют реакции замещения и отщепления.
|
|
1. CH3CH2Br + NaOH (водн. р-р) → CH3CH2OH + NaBr (образование спиртов)
2. CH3CH2Br + NaCN → CH3CH2CN + NaBr (образование нитрилов)
3. CH3CH2Br + NH3 → [CH3CH2NH3]+Br ↔— HBr ↔ CH3CH2NH2 (образование аминов)
4. CH3CH2Br + NaNO2 → CH3CH2 NO2 + NaBr (образование нитросоединений)
5. CH3Br + 2Na + CH3Br → CH3—CH3 + 2NaBr (реакция Вюрца)
6. CH3Br + Mg → CH3MgBr (образование магнийорганических соединений, реактив Гриньяра)
7. (дегидрогалогенирование)

Спирты
Спиртами называются производные углеводородов, в молекулах которых содержится одна или несколько гидроксильных групп (—OH), связанных с насыщенными атомами углерода. Группа —OH (гидроксильная, оксигруппа) является в молекуле спирта функциональной группой. Систематические названия даются по названию углеводорода с добавлением суффикса - ол и цифры, указывающей положение гидроксигруппы. Нумерация ведется от ближайшего к OH-группе конца цепи.
По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа —OH), многоатомные (две и более групп —OH). Одноатомные спирты: метанол CH3OH, этанол С2Н5OH; двухатомный спирт: этилен-гликоль (этандиол-1,2) HO—CH2—CH2—OH; трехатомный спирт: глицерин (пропантриол-1,2,3) HO—CH2—CH(OH)—CH2—OH. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты первичные R—CH2—OH, вторичные R2CH—OH, третичные R3C—OH.
По строению радикалов, связанных с атомом кислорода, спирты подразделяются на предельные, или алканолы (CH3CH2—OH), непредельные, или алкенолы (CH2=CH—CH2—OH), ароматические (С6Н5CH2—OH).
Виды изомерии (структурная изомерия): 1) изомерия положения OH-группы (начиная с С3); 2) углеродного скелета (начиная с С4); 3) межклассовая изомерия с простыми эфирами (например, этиловый спирт CH3CH2OH и диметиловый эфир CH3—О—CH3). Следствием полярности связи О—Н и наличия неподеленных пар электронов на атоме кислорода является способность спиртов к образованию водородных связей.
|
|
Способы получения спиртов
1. CH2=CH2 + Н2O/Н+ → CH3—CH2OH (гидратация алкенов)
2. CH3—CHO + Н2 → t, Ni → С2Н5OH (восстановление альдегидов и кетонов)
3. C2H5Br + NaOH (водн.) → С2Н5OH + NaBr (гидролиз галогенопроизводных)
ClCH2—CH2Cl + 2NaOH (водн.) → HOCH2—CH2OH + 2NaCl
4. CO + 2Н2 → ZnO, CuO, 250 °C, 7 МПа → CH3OH (получение метанола, промышленность)
5. С6Н12O6 → дрожжи → 2С2Н5OH + 2CO2 (брожение моноз)
6. 3CH2=CH2 + 2KMnO4 + 4Н2O → 3CH2OH—CH2OH - этиленгиликоль + 2KOH + 2MnO2 (окисление в мягких условиях)
7. а) CH2=CH—CH3 + O2 → CH2=CH—CHO + Н2O
б) CH2=CH—CHO + Н2 → CH2=CH—CH2OH
в) CH2=CH—CH2OH + Н2O2 → HOCH2—CH(OH)—CH2OH (получение глицерина)
Химические свойства спиртов
Химические свойства спиртов связаны с наличием в их молекулу группы —OH. Для спиртов характерны два типа реакций: разрыв связи С—О и связи О—Н.
1. 2С2Н5OH + 2Na → Н2 + 2C2H5ONa (образование алкоголятов металлов Na, К, Mg, Al)
2. а) С2Н5OH + NaOH ≠ (в водном растворе не идет)
б) CH2OH—CH2OH + 2NaOH → NaOCH2—CH2ONa + 2Н2O
в) (качественная реакция на многоатомные спирты – образование ярко-синего раствора с гидроксидом меди)

3. а) (образование сложных эфиров)

б) С2Н5OH + H2SO4 → С2Н5—О—SO3H + Н2O (на холоду)
в)

4. а) С2Н5OH + HBr → С2Н5Br + Н2O
б) С2Н5OH + РCl5 → С2Н5Cl + POCl3 + HCl
в) С2Н5OH + SOCl2 → С2Н5Cl + SO2 + HCl (замещение гидроксильной группы на галоген)
5. С2Н5OH + HOC2H5 → H2SO4, <140 °C → C2H5—O—C2H5 + H2O (межмолекулярная гидротация)
6. С2Н5OH → H2SO4, 170 °C → CH2=CH2 + H2O (внутримолекулярная гидротация)
7. а) (дегидрирование, окисление первичных спиртов)

б) (дегидрирование, окисление вторичных спиртов)

Фенолы
Фенолами называются производные аренов, в которых один или несколько атомов водорода ароматического кольца замещены на гидроксильные группы. По числу гидроксильных групп в ароматическом кольце различают одно– и многоатомные (двух– и трехатомные) фенолы. Для большинства фенолов используются тривиальные названия. Структурная изомерия фенолов связана с различным положением гидроксильных групп.

Способы получения фенолов
1. С6Н5Cl + NaOH(p, 340°C) → С6Н5OH + NaCl (щелочной гидролиз галогеноуглеводородов)
2. (кумольный способ получения)

3. C6H5SO3Na + NaOH (300–350°C) → С6Н5OH + Na2SO3 (щелочное плавление солей ароматических сульфоновых кислот)
Химические свойства фенолов
Фенолы в большинстве реакций по связи О—Н активнее спиртов, поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие непо-деленной электронной пары атома кислорода в системе л-сопряжения). Кислотность фенолов значительно выше, чем спиртов.
|
|
Для фенолов реакции разрыва связи С—О не характерны. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра.
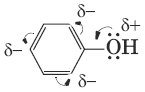
Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно в орто– и пара- положениях (+М-эффект OH-группы). Для обнаружения фенолов используется качественная реакция с хлоридом железа(III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
1. 2С6Н5OH + 2Na → 2C6H5ONa + Н2 (так же, как и этанол)
2. С6Н5OH + NaOH → C6H5ONa + H2O (в отличие от этанола)
C6H5ONa + Н2O + CO2 → С6Н5OH + NaHCO3 (фенол более слабая кислота, чем угольная)
3.
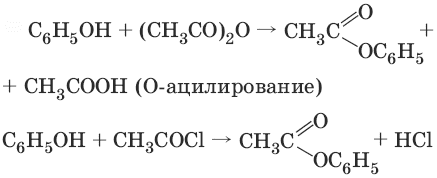
Фенолы не образуют сложные эфиры в реакциях с кислотами. Для этого используются более реакционноспособные производные кислот (ангидриды, хлорангидриды).
4. С6Н5OH + CH3CH2OH → NaOH → С6Н5OCH2CH3 + NaBr (О-алкилирование)
5.
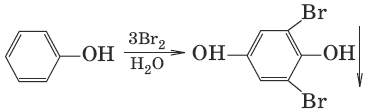
(взаимодействие с бромной водой, качественная реакция)
6.(нитрование разб. HNO3, при нитрировании конц. HNO3 образуется 2,4,6-тринитрофенол)

7. n C6H5OH + n CH2O → n H2O + (—C6H3OH—CH2—) n (поликонденсация, получение фенолформальдегидных смол)
Альдегиды и кетоны
Альдегидами называются соединения, в которых карбонильная группа

соединена с углеводородным радикалом и атомом водорода, а кетонами – карбонильные соединения с двумя углеводородными радикалами.

Систематические названия альдегидов строят по названию соответствующего углеводорода с добавлением суффикса –аль. Нумерацию цепи начинают с карбонильного атома углерода. Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении: Н2С=O – метаналь (муравьиный альдегид, формальдегид); CH3CH=O – этаналь (уксусный альдегид). Систематические названия кетонов несложного строения производят от названий радикалов с добавлением слова «кетон». В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса –он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе. Примеры: CH3—CO—CH3 – диметилкетон (пропанон, ацетон). Для альдегидов и кетонов характерна структурная изомерия. Изомерия альдегидов: а) изомерия углеродного скелета, начиная с С4; б) межклассовая изомерия. Изомерия кетонов: а) углеродного скелета (с С5); б) положения карбонильной группы (с С5); в) межклассовая изомерия.
|
|
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2- гибридизации. Связь С=O сильно полярна. Электроны кратной связи С=O смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда, а карбонильный атом углерода приобретает частичный положительный заряд.
|
|
|

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!