Основные квантовые числа
| n
| Главное квантовое число: n = 1, 2, …  . .
|
| j
| Квантовое число полного углового момента. j никогда не бывает отрицательным и может быть целым (включая ноль) или полуцелым в зависимости от свойств рассматриваемой системы. Величина полного углового момента J связана с j соотношением J2 = 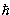 2j(j + 1). 2j(j + 1).  = =  + +  , где , где  и и  векторы орбитального и спинового угловых моментов. векторы орбитального и спинового угловых моментов.
|
| l
| Квантовое число орбитального углового момента l может принимать только целые значения: l = 0, 1, 2, …  . Величина орбитального углового L момента связана с l соотношением L2 = . Величина орбитального углового L момента связана с l соотношением L2 = 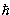 2 l (l + 1). 2 l (l + 1).
|
| m
| Магнитное квантовое число. Проекция полного, орбитального или спинового углового момента на выделенную ось (обычно ось z) равна m 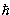 . Для полного момента mj = j, j-1, j-2, …, - (j-1), - j. Для орбитального момента m l = l, l -1, l -2, …, -(l -1), - l. Для спинового момента электрона, протона, нейтрона, кварка m s = ±1/2 . Для полного момента mj = j, j-1, j-2, …, - (j-1), - j. Для орбитального момента m l = l, l -1, l -2, …, -(l -1), - l. Для спинового момента электрона, протона, нейтрона, кварка m s = ±1/2
|
| s
| Квантовое число спинового углового момента s может быть либо целым, либо полуцелым. s - неизменная характеристика частицы, определяемая ее свойствами. Величина спинового момента S связана с s соотношением S2 = 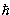 2s(s + 1). 2s(s + 1).
|
| P
| Пространственная четность. Она равна либо +1, либо -1 и характеризует поведение системы при зеркальном отражении. P = (-1) l.
|
Существование сохраняющихся (неизменных во времени) физических величин для данной системы тесно связано со свойствами симметрии этой системы. Так, если изолированная система не изменяется при произвольных поворотах, то у неё сохраняется орбитальный момент количества движения. Это имеет место для атома водорода, в котором электрон движется в сферически симметричном кулоновском потенциале ядра и поэтому характеризуется неизменным квантовым числом l. Внешнее возмущение может нарушать симметрию системы, что приводит к изменению самих квантовых чисел. Фотон, поглощенный атомом водорода, может “перебросить” электрон на другую орбиту с другими значениями квантовых чисел.
Всегда в атоме имеются электроны С близкими значениями энергии, которые и образуют электронные слои в оболочке атома.
Число электронных слоёв равно номеру периода в периодической системе. Максимальное число электронов на слое можно найти с помощью формулы N=2n2,где N -число электронов на слое, n -номер слоя. Произведя простые рассчёты, выясним что на первом электронном слое будет 2 электрона, на втором-8, третьем-18, четвёртом-32. Но на внешнем электронном слое не может быть более 8 электронов, а для первого слоя не более 2. Это небходимо учитывать при распределении электронов по энергетическим слоям.
Рассмотрим несколько примеров заполнения электронных оболочек.

После заполнения второго слоя до восьми электронов появляется третий слой.


Третий электронный слой заполняется до максимального числа -18 электронов. После этого начинает заполняться внешний четвёртый слой до 8 электронов.

Внешний электронный слой заполняется у элементов главных подгрупп, причём число электронов соответствует номеру группы. У элементов побочных подгрупп заполняются предвнешние слои, а на внешнем слое остаётся чаще всего два электрона. У d-элементов заполняется предвнешний слой, а у f-элементов третий снаружи слой.
Распределение электронов по уровням можно записать с помощью ячеек Хунда.
Здесь уровни разделены на подуровни. Вы наверное заметили, что в периодической системе элементы подразделяются на s-, p-, d-, f-элементы. Какой подуровень заполняется последним, к такой группе и относится данный элемент. Например, последний электрон занимает одну из р-орбиталей, то этот элемент относится к р-элементам.
При заполнении ячеек электроны обозначаются стрелками (одна стрелка направлена вверх, другая вниз, это связано с тем, что электроны вращаются вокруг своей оси-один по часовой, другой-против часовой стрелки), причём в одной ячейке могут находиться не более двух электронов.
Порядок заполнения ячеек.
| 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
|
При заполнении ячеек следует учитывать то,что ячейки подуровней заполняются вначале по одному электрону, затем к ним помещают другие электроны.

2. Основные правила квантовой механики(принцип наименьшей энергии, принцип Паули, правило Гунда, правило Клечковского). В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д.
В.М. Клечковский впервые в 1961 г. сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимальным возможным значением n, а с наименьшим значением суммы n + l.
В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением n. Например, на подуровнях Зd, 4р, 5s сумма значений n и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т.е. Зd - 4р – 5s и т.д
Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули. Принцип Паули
В1925 г. швейцарский физик В.Паули (в 1945 г. ему была присуждена Нобелевская премия по физике) установил правило, названное впоследствии принципом Паули (или запретом Паули): В атоме не может быть двух электронов, обладающих одинаковыми свойствами.Поскольку свойства электронов характеризуются квантовыми... Правило Гунда При данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным.Если, например, в трех p-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться.
3. Энергетические эффекты химических реакций. Термохимические уравнения. Закон Гесса. Когда в результате химической реакции при образовании новых связей выделяется энергии БОЛЬШЕ, чем потребовалось для разрушения "старых" связей в исходных веществах, то избыток энергии высвобождается в виде тепла. Примером могут служить реакции горения. В других случаях на разрушение связей в исходных веществах требуется энергии больше, чем может выделиться при образовании новых связей. Такие реакции происходят только при подводе энергии извне и называются ЭНДОТЕРМИЧЕСКИМИ (от латинского "эндо" - внутрь). Примером является образование оксида углерода (II) CO и водорода H
2 из угля и воды, которое происходит только при нагревании. Таким образом, любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже - в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Такая величина называется ТЕПЛОВЫМ ЭФФЕКТОМ РЕАКЦИИ. Уравнения химических реакций, в которых вместе с реагентами и продуктами записан и тепловой эффект реакции, называются ТЕРМОХИМИЧЕСКИМИ УРАВНЕНИЯМИ. Особенность термохимических уравнений заключается в том, что при работе с ними можно переносить формулы веществ и величины тепловых эффектов из одной части уравнения в другую. С обычными уравнениями химических реакций так поступать, как правило, нельзя. Допускается также почленное сложение и вычитание термохимических уравнений. Это бывает нужно для определения тепловых эффектов реакций, которые трудно или невозможно измерить в опыте.
Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком. Это означает, что при образовании любого соединения выделяется (поглощается) столько же энергии, сколько поглощается (выделяется) при его распаде на исходные вещества.
Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса. Это означает, что общий тепловой эффект ряда последовательных реакций будет таким же, как и у любого другого ряда реакций, если в начале и в конце этих рядов одни и те же исходные и конечные вещества.
Закон гесса – тепловой эффект реакции не зависит от пути процесса,а зависит от начального и конечного состояния веществ.
Следствие – тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициэнтов.
4. Катализ. Катализаторы и каталитические реакции. Процесс изменения скорости реакции под воздействием катализаторов наз-ся катализом. Катализаторами наз-ся вещества, которые изменяют скорость хим. Реакций, но сами не испытывают хим. Превращений и остаются в том же количестве. Каталитическими реакциями наз-ся реакции, в которых скорость хим. Реакций изменяется за счет введения катализатора. Катализ гомогенный-катализатор и реагирующее вещества находятся в одном фазовом состоянии. Катализ гетерогенный-катализатор и реагирующее вещества находятся в разных фазовых состояниях. В 1951г. Б.П.Белоусовов изучил окисление лимонной кислоты броматом натрия в растворе серной кислоты, в присутствии катализатора растрвора солей церия. Цвет раствора периодически менялся. Реакции, характеризующиеся колебательными концентраций некоторых промежуточных соединений и соответственно их скоростей, наз-ся колебательными реакциями.
5. Жидкие растворы. Растворимость. Факторы, влияющие на растворимость веществ. Произведение растворимости. Растворы занимают промежуточное место между химическими соединениями и механическими смесями. Однородность растворов делает их схожими с химическими соединениями, так же на химическое взаимодействие между компонентами растворов указывает выделение теплоты при растворении некоторых веществ. Растворы отличаются от химических соединений тем, что состав взаимодействующих веществ может изменяться в широких пределах. В свойствах раствора можно обнаружить многие свойства компонентов его составляющих, что характерно для механических соединений.
Процесс растворения кристалла в жидкости происходит так. Когда кристалл соли, например, хлорида натрия попадает в воду, то распложенные на его поверхности ионы притягивают полярные молекулы воды (ион-дипольное взаимодействие). К ионам натрия молекулы притягиваются своими отрицательными полюсами, а к ионам хлора положительными. Но если ионы протягивают к себе молекулы воды, то и молекулы воды притягивают к себе ионы. В то же время притянутые молекулы воды испытывают толчки со стороны непритянутых молекул воды, находящихся в тепловом движении. И этих толчков, а так же тепловых колебаний самих ионов достаточно для того, чтобы ион хлора или натрия отделился от кристалла и перешел в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой и таким образом идет постепенное растворение кристалла. Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. Гидратация – основная причина диссоциации. Она отчасти затрудняет их обратное соединение (ассоциацию). Под гидратацией обычно понимают совокупность энергетических процессов и структурных изменений, происходящих в растворе при взаимодействии частиц растворенного вещества с водой. Слой частиц воды, непосредственно присоединенных к центральной частице растворенного вещества образует вокруг нее гдратную оболочку. Наименьшее число молекул растворителя, удерживаемое около частицы растворенного вещества называется координатным числом гидратации. Координатное число определить трудно, оно зависит от природы растворенного вещества и растворителя.
Любой раствор состоит из растворителя и растворенного вещества. В случае растворов газов или твердых веществ в жидкостях растворителем обычно считается жидкость, а растворенным веществом – растворенный газ или твердое вещество, независимо от их относительного количественного содержания. Когда компоненты обладают ограниченной смешиваемостью, то растворителем является тот, прибавление которого к раствору возможно в неограниченном количестве без нарушения гомогенности. Если компоненты обладают неограниченной растворимостью, то можно выделить два случая. При значительном различии содержания компонентов растворителем считается вещество, присутствующее в относительно большем количестве. Понятия растворитель и растворенное вещество теряют смысл, когда речь идет о смесях с примерно равными или близкими концентрациями компонентов. В этом случае состав раствора может выражаться различными способами – как с помощью безразмерных единиц – долей или процентов, так и через размерные величины – концентрации. На практике используют более десятка способов выражения концентрации.
Все вещества состоят из молекул, которые в свою очередь состоят из атомов. Для того чтобы разделить молекулу на отдельные атомы необходимо преодолеть их силы притяжения и затратить энергию. При соединении атомов энергия, напротив, выделяется.
На принципе выделения энергии при соединении атомов основано использование топлива. При сгорании топлива происходит химическая реакция, в результате которой атомы углерода соединяются с атомами кислорода (в результате образуется углекислый газ). При этом выделяется большое количество энергии. Количество теплоты, выделяющееся при полном сгорании топлива массой 1 к г, называют теплотой сгорания топлива. Теплота сгорания топлива обозначается латинской буквой Q и измеряется в Дж/кг. Вполне естественно, что различные вещества обладают разной теплотой сгорания. Теплота сгорания разных видов топлива даётся в таблицах. Зная теплоту сгорания топлива и его массу, можно легко определить выделившееся при этом количество теплоты по формуле: Q = q • m.
Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы компенсировать изменение.
Влияние температуры
В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому. N2 + 3H2 ⇄ 2NH3 + Q
Прямая реакция — экзотермическая, а обратная реакция — эндотермическая.Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам: При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
Влияние давления
Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам: При повышении давления равновесие сдвигается в сторону уменьшения газовых молей при понижении давления равновесие сдвигается в сторону увеличения числа газовых молей N2 + 3H2 ↔ 2NH3
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400°С:
| давление, МПа
| 0,1
|
|
|
|
|
|
| объемная доля NH3, %
| 0,4
|
|
|
|
|
|
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
1.При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
2.повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
42. Строение и свойства воды. Характеристика природных вод. Роль воды в окружающем мире очень велика.70,8% земного шара состоит из воды, тело человека на 65%. Природная вода- смесь молекул: Н216О, Н218О, НD16О; тяжёлая вода: D216О, D217О; сверхтяжелая:Т2О. Масса 1мг. очищенной речной воды принята за единицу массы и называется граммом. Вода обладает ономально высокой теплоемкостью-4,18 КДж/кг*К.
Некоторые физико-химические свойства воды: * t плавления-00С,* t плавления-1000С, *удельная теплоёмкость-4,18 кДж/кг*К(при 200С), *диэлектрическая проницаемость-88,3.
Аномалии воды: 1При нагревании от0 до 40С убьем воды не увеличивается, а уменьшается и максимальная плотность достигает при 40С. 2При замерзании расширяется, плотность уменьшается. 3Температура замерзания увеличивается, давление понижается, как этого следовало бы ожидать. 4Большая удельная теплоёмкость. 5Обладает большой растворяющей и диссоциирующей способностью. 6Обладает самыми большими поверхностными натяжениями, за исключением ртути. Реакционное вещество взаимодействует с оксидами металлов и неметаллов: Na2O+H2O=2NaOH. Вода обладает амфотерными свойствами:
Вода может быть как окислителем так и восстановителем. Вода является лигандом и координируется катионами и анионами. Вода вызывает процесс обменного разложения(гидролиз) Na2S+H2O=NaHS+NaON. Водородная связь-связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Характеристики природных вод: По происхождению- атмосферные воды(осадочные), подземные(ключевые, колодезные), поверхностные(речные, озёрные). По принципу использования- питьевые, хозяйственные, технологические, лечебные. По количеству и характеру примесей- пресные, соленые, мягкие, жесткие, прозрачные, бесцветные, мутные, окрашенные. Примеси природных вод в зависимости от размера частиц:1Истино растворенные. 2Колойдные. 3Взвешенные. По химическому составу примесей:1Органические. 2Неогганические.
Основные квантовые числа
| n
| Главное квантовое число: n = 1, 2, …  . .
|
| j
| Квантовое число полного углового момента. j никогда не бывает отрицательным и может быть целым (включая ноль) или полуцелым в зависимости от свойств рассматриваемой системы. Величина полного углового момента J связана с j соотношением J2 = 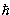 2j(j + 1). 2j(j + 1).  = =  + +  , где , где  и и  векторы орбитального и спинового угловых моментов. векторы орбитального и спинового угловых моментов.
|
| l
| Квантовое число орбитального углового момента l может принимать только целые значения: l = 0, 1, 2, …  . Величина орбитального углового L момента связана с l соотношением L2 = . Величина орбитального углового L момента связана с l соотношением L2 = 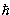 2 l (l + 1). 2 l (l + 1).
|
| m
| Магнитное квантовое число. Проекция полного, орбитального или спинового углового момента на выделенную ось (обычно ось z) равна m 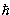 . Для полного момента mj = j, j-1, j-2, …, - (j-1), - j. Для орбитального момента m l = l, l -1, l -2, …, -(l -1), - l. Для спинового момента электрона, протона, нейтрона, кварка m s = ±1/2 . Для полного момента mj = j, j-1, j-2, …, - (j-1), - j. Для орбитального момента m l = l, l -1, l -2, …, -(l -1), - l. Для спинового момента электрона, протона, нейтрона, кварка m s = ±1/2
|
| s
| Квантовое число спинового углового момента s может быть либо целым, либо полуцелым. s - неизменная характеристика частицы, определяемая ее свойствами. Величина спинового момента S связана с s соотношением S2 = 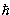 2s(s + 1). 2s(s + 1).
|
| P
| Пространственная четность. Она равна либо +1, либо -1 и характеризует поведение системы при зеркальном отражении. P = (-1) l.
|
Существование сохраняющихся (неизменных во времени) физических величин для данной системы тесно связано со свойствами симметрии этой системы. Так, если изолированная система не изменяется при произвольных поворотах, то у неё сохраняется орбитальный момент количества движения. Это имеет место для атома водорода, в котором электрон движется в сферически симметричном кулоновском потенциале ядра и поэтому характеризуется неизменным квантовым числом l. Внешнее возмущение может нарушать симметрию системы, что приводит к изменению самих квантовых чисел. Фотон, поглощенный атомом водорода, может “перебросить” электрон на другую орбиту с другими значениями квантовых чисел.
Всегда в атоме имеются электроны С близкими значениями энергии, которые и образуют электронные слои в оболочке атома.
Число электронных слоёв равно номеру периода в периодической системе. Максимальное число электронов на слое можно найти с помощью формулы N=2n2,где N -число электронов на слое, n -номер слоя. Произведя простые рассчёты, выясним что на первом электронном слое будет 2 электрона, на втором-8, третьем-18, четвёртом-32. Но на внешнем электронном слое не может быть более 8 электронов, а для первого слоя не более 2. Это небходимо учитывать при распределении электронов по энергетическим слоям.
Рассмотрим несколько примеров заполнения электронных оболочек.

После заполнения второго слоя до восьми электронов появляется третий слой.


Третий электронный слой заполняется до максимального числа -18 электронов. После этого начинает заполняться внешний четвёртый слой до 8 электронов.

Внешний электронный слой заполняется у элементов главных подгрупп, причём число электронов соответствует номеру группы. У элементов побочных подгрупп заполняются предвнешние слои, а на внешнем слое остаётся чаще всего два электрона. У d-элементов заполняется предвнешний слой, а у f-элементов третий снаружи слой.
Распределение электронов по уровням можно записать с помощью ячеек Хунда.
Здесь уровни разделены на подуровни. Вы наверное заметили, что в периодической системе элементы подразделяются на s-, p-, d-, f-элементы. Какой подуровень заполняется последним, к такой группе и относится данный элемент. Например, последний электрон занимает одну из р-орбиталей, то этот элемент относится к р-элементам.
При заполнении ячеек электроны обозначаются стрелками (одна стрелка направлена вверх, другая вниз, это связано с тем, что электроны вращаются вокруг своей оси-один по часовой, другой-против часовой стрелки), причём в одной ячейке могут находиться не более двух электронов.
Порядок заполнения ячеек.
| 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
|
При заполнении ячеек следует учитывать то,что ячейки подуровней заполняются вначале по одному электрону, затем к ним помещают другие электроны.

2. Основные правила квантовой механики(принцип наименьшей энергии, принцип Паули, правило Гунда, правило Клечковского). В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д.
В.М. Клечковский впервые в 1961 г. сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимальным возможным значением n, а с наименьшим значением суммы n + l.
В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением n. Например, на подуровнях Зd, 4р, 5s сумма значений n и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т.е. Зd - 4р – 5s и т.д
Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули. Принцип Паули
В1925 г. швейцарский физик В.Паули (в 1945 г. ему была присуждена Нобелевская премия по физике) установил правило, названное впоследствии принципом Паули (или запретом Паули): В атоме не может быть двух электронов, обладающих одинаковыми свойствами.Поскольку свойства электронов характеризуются квантовыми... Правило Гунда При данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным.Если, например, в трех p-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться.
3. Энергетические эффекты химических реакций. Термохимические уравнения. Закон Гесса. Когда в результате химической реакции при образовании новых связей выделяется энергии БОЛЬШЕ, чем потребовалось для разрушения "старых" связей в исходных веществах, то избыток энергии высвобождается в виде тепла. Примером могут служить реакции горения. В других случаях на разрушение связей в исходных веществах требуется энергии больше, чем может выделиться при образовании новых связей. Такие реакции происходят только при подводе энергии извне и называются ЭНДОТЕРМИЧЕСКИМИ (от латинского "эндо" - внутрь). Примером является образование оксида углерода (II) CO и водорода H
2 из угля и воды, которое происходит только при нагревании. Таким образом, любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже - в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Такая величина называется ТЕПЛОВЫМ ЭФФЕКТОМ РЕАКЦИИ. Уравнения химических реакций, в которых вместе с реагентами и продуктами записан и тепловой эффект реакции, называются ТЕРМОХИМИЧЕСКИМИ УРАВНЕНИЯМИ. Особенность термохимических уравнений заключается в том, что при работе с ними можно переносить формулы веществ и величины тепловых эффектов из одной части уравнения в другую. С обычными уравнениями химических реакций так поступать, как правило, нельзя. Допускается также почленное сложение и вычитание термохимических уравнений. Это бывает нужно для определения тепловых эффектов реакций, которые трудно или невозможно измерить в опыте.
Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком. Это означает, что при образовании любого соединения выделяется (поглощается) столько же энергии, сколько поглощается (выделяется) при его распаде на исходные вещества.
Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса. Это означает, что общий тепловой эффект ряда последовательных реакций будет таким же, как и у любого другого ряда реакций, если в начале и в конце этих рядов одни и те же исходные и конечные вещества.
Закон гесса – тепловой эффект реакции не зависит от пути процесса,а зависит от начального и конечного состояния веществ.
Следствие – тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициэнтов.
4. Катализ. Катализаторы и каталитические реакции. Процесс изменения скорости реакции под воздействием катализаторов наз-ся катализом. Катализаторами наз-ся вещества, которые изменяют скорость хим. Реакций, но сами не испытывают хим. Превращений и остаются в том же количестве. Каталитическими реакциями наз-ся реакции, в которых скорость хим. Реакций изменяется за счет введения катализатора. Катализ гомогенный-катализатор и реагирующее вещества находятся в одном фазовом состоянии. Катализ гетерогенный-катализатор и реагирующее вещества находятся в разных фазовых состояниях. В 1951г. Б.П.Белоусовов изучил окисление лимонной кислоты броматом натрия в растворе серной кислоты, в присутствии катализатора растрвора солей церия. Цвет раствора периодически менялся. Реакции, характеризующиеся колебательными концентраций некоторых промежуточных соединений и соответственно их скоростей, наз-ся колебательными реакциями.
5. Жидкие растворы. Растворимость. Факторы, влияющие на растворимость веществ. Произведение растворимости. Растворы занимают промежуточное место между химическими соединениями и механическими смесями. Однородность растворов делает их схожими с химическими соединениями, так же на химическое взаимодействие между компонентами растворов указывает выделение теплоты при растворении некоторых веществ. Растворы отличаются от химических соединений тем, что состав взаимодействующих веществ может изменяться в широких пределах. В свойствах раствора можно обнаружить многие свойства компонентов его составляющих, что характерно для механических соединений.
Процесс растворения кристалла в жидкости происходит так. Когда кристалл соли, например, хлорида натрия попадает в воду, то распложенные на его поверхности ионы притягивают полярные молекулы воды (ион-дипольное взаимодействие). К ионам натрия молекулы притягиваются своими отрицательными полюсами, а к ионам хлора положительными. Но если ионы протягивают к себе молекулы воды, то и молекулы воды притягивают к себе ионы. В то же время притянутые молекулы воды испытывают толчки со стороны непритянутых молекул воды, находящихся в тепловом движении. И этих толчков, а так же тепловых колебаний самих ионов достаточно для того, чтобы ион хлора или натрия отделился от кристалла и перешел в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой и таким образом идет постепенное растворение кристалла. Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. Гидратация – основная причина диссоциации. Она отчасти затрудняет их обратное соединение (ассоциацию). Под гидратацией обычно понимают совокупность энергетических процессов и структурных изменений, происходящих в растворе при взаимодействии частиц растворенного вещества с водой. Слой частиц воды, непосредственно присоединенных к центральной частице растворенного вещества образует вокруг нее гдратную оболочку. Наименьшее число молекул растворителя, удерживаемое около частицы растворенного вещества называется координатным числом гидратации. Координатное число определить трудно, оно зависит от природы растворенного вещества и растворителя.
Любой раствор состоит из растворителя и растворенного вещества. В случае растворов газов или твердых веществ в жидкостях растворителем обычно считается жидкость, а растворенным веществом – растворенный газ или твердое вещество, независимо от их относительного количественного содержания. Когда компоненты обладают ограниченной смешиваемостью, то растворителем является тот, прибавление которого к раствору возможно в неограниченном количестве без нарушения гомогенности. Если компоненты обладают неограниченной растворимостью, то можно выделить два случая. При значительном различии содержания компонентов растворителем считается вещество, присутствующее в относительно большем количестве. Понятия растворитель и растворенное вещество теряют смысл, когда речь идет о смесях с примерно равными или близкими концентрациями компонентов. В этом случае состав раствора может выражаться различными способами – как с помощью безразмерных единиц – долей или процентов, так и через размерные величины – концентрации. На практике используют более десятка способов выражения концентрации.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ.
Растворы всех веществ можно разделить на две группы: электролиты -проводят электрический ток, неэлектролиты -проводниками не являются. Это деление является условным, потому что все растворы веществ проводят электрический ток, все они в той или иной мере растворяются в воде и распадаются на катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы). Следует различать настоящие и потенциальные электролиты.
Настоящие электролиты находятся в виде ионов уже в индивидуальном состоянии, т.е. до того, как они будут расплавлены или переведены в раствор. К настоящим электролитам относятся все типичные соли, которые в твёрдом состоянии образуют ионную кристаллическую решётку (например NaCl, K2SO4 и т.д.)
Потенциальные электролиты в индивидуальном состоянии ионов не содержат, но образуют их при переходе вещества в раствор. К ним относятся вещества, состоящие из молекул с сильно полярными связями (например HCl).
К неэлектролитам относится большая часть органических соединений, например диэтиловый эфир, бензол, глюкоза, сахароза.
Заряженные частицы появляются только в растворах и расплавах веществ вследствие электролитической диссоциации. Электролитическая диссоациация-это процесс распада веществ на ионы при растворении или расплавлении.
Следовательно, в результате диссоциации в растворе появляются ионы, которые являются предпосылкой для появления у раствора или расплава такого физического свойства как электропроводимость.
Как же происходит процесс растворения?. Разрушение ионной кристаллической решётки происходит под воздействием растворителя, например воды. Полярные молекулы воды настолько снижают силы электростатического притяжения между ионами в кристаллической решётке, что ионы становятся свободными и переходят в раствор.
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Теорию электролитической диссоциации создал в 1884-1887 гг.



 .
.
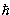 2j(j + 1).
2j(j + 1).  =
=  +
+  , где
, где 







