

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь...
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Интересное:
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
В настоящее время в сельском хозяйстве широко применяются минеральные удобрения, мелиоранты, пестициды, стимуляторы роста растений и другие химикаты.
Удобрения – это вещества, которые вносят в почву или воздействуют ими на растение непосредственно для улучшения питания растений.
Все удобрения делят на минеральные (не содержащие органических веществ), органические (содержащие органические и минеральные вещества) и бактериальные.
Минеральные удобрения делят в зависимости от числа питательных элементов на простые (содержат 1 элемент питания) и комплексные (содержат 2 и более элементов питания).
В зависимости от того, какой именно элемент питания содержит удобрение, различают азотные (содержат азот), фосфорные (фосфор), калийные (калий) удобрения.
1. Азотные удобрения содержат азот в виде NO3- или NH4+
а) нитратные: чилийская (натриевая) селитра NaNO3
норвежская селитра Ca(NO3)2
б) аммиачные: сульфат аммония (NH4)2SO4
хлорид аммония NH4Cl
в) аммиачно-нитратные: аммиачная селитра NH4NO3
г) иные азотные удобрения: карбамид (мочевина) СО(NH2)2
аммиак NH3
2.Фосфорные удобрения:
простой суперфосфат Ca(Н2PO4)2*2CaSО4
двойной суперфосфат Са(Н2РО4)2
преципитат СаНРО4*2Н2О
фосфоритная мука Са3(РО4)2
костяная мука Са3(РО4)2
3.Калийные удобрения:
сильвинит nKCl*mNaCl
хлорид калия КСl
сульфат калия K2SO4
калимаг K2SO4 *MgSO4
поташ К2СО3.
Комплексные удобрения:
а) содержащие 2 элемента питания:
фосфорно-азотные: аммофос NH4Н2PO4
диаммофос (NH4 )2НPO4
ф о с ф о р н о - к а л и й н ы е: метафосфат калия КРО3
азотно-калийные: калийная селитра KNO3
б) содержащие 3 элемента питания - представляют собой смесь различных веществ - Ca(NO3)2, CaHPO4, NH4NO3, KCl и т.д.:
нитрофос - содержит фосфор и нитратный азот;
|
|
нитрофоска - кроме фосфора инитратного азота содержит калий;
нитроаммофоска - включает фосфор, калий, нитратный и аммонийный азот.
Действующим веществом удобрений являются азот N, оксид фосфора Р2О5 и оксид калия К2О.
Мелиоранты – это вещества, способные коренным образом улучшить почвы.
Почвы обладают низким естественным плодородием по нескольким причинам: если они засолены, имеют неблагоприятные значения рН либо неблагоприятный состав обменных катионов.
Наиболее часто в почвах могут встречаться следующие соли: NaCl, Nа2SO4, NaHCO3, Na2CO3, MgSO4, MgCl2, CaCl2, CaSO4, Ca(HCO3)2
Некоторые из этих солей являются токсичными для произрастающих на данных почвах растений. Наиболее токсичными являются соединения натрия, причем их токсичность меняется в следующем ряду:
Na2CO3 > NaHCO3 > NaCl > Na2SO4.
Кроме того присутствие в почвенном растворе солей способствует повышению осмотической силы почвенного раствора, в результате чего растения на получают необходимого количества воды и питательных элементов.
Улучшить свойства засоленных почв можно путем промывки. Однако промывка почв, содержащих карбонаты и гидрокарбонаты натрия, может привести к пептизации почвенных коллоидов и ухудшению свойств почвы.
К полезным для почв солям относят карбонаты и сульфаты кальция.
Оптимальным значением рН для большинства растений является интервал рН = 6-7. Однако многие почвы имеют сильно отличные от оптимального значения рН.
По величине рН почвы группируют следующим образом:
< 4,5 - сильно- и очень сильнокислые;
4,5-5,0 - среднекислые;
5,0-5,5 - слабокислые;
5,5-6,0 - близкие к нейтральным;
6,0-7,5 - нейтральные;
7,5-8,0 - слабощелочные;
8,0-8,5 - среднещелочные;
> 8,5 - сильнощелочные.
В почве в значительном количестве в ионообменном состоянии могут находиться следующие катионы: H+, Na+,К+, Са2+, Mg2+,А13+, NH4+. Практически все почвы содержат ионы Ca2+,Mg2+,K+и NH4+. Ионы H+ и А13+ в значительных количествах присутствуют в кислых почвах, а ионы Na+ - в солонцовых, обуславливая неблагоприятные свойства этих почв.
|
|
Причиной такого влияния катионов на свойства почв является переход их в почвенный раствор вследствие реакций ионного обмена. В почве обменные катионы связаны с почвенным поглощающим комплексом (ППК). ППК - совокупность минеральных, органических и органоминеральных компонентов твердой фазы почвы, обладающих ионообменной способностью.
В кислых почвах возможно протекание следующих реакций при внесении KCI:
ППК - Н + КС1→ ППК - К + НC1

 ППК ≡ AI + 3 КС1 → ППК – + АIC13
ППК ≡ AI + 3 КС1 → ППК – + АIC13
А1С13 + 3Н2О → АI(ОН)3 + 3НC1
Образующаяся в результате этих реакций кислота НС1 способствует снижению величины рН ниже оптимальных для растений значений.
В солонцовых почвах протекает другой процесс:
ППК - Na + Н2О → ППК - Н + NaOH
ППК - Na + Н2О + СО2 → ППК - Н + NaНСОз
Образование NaOH и NaHCO3 способствует подщелачиванию почвенного раствора, в результате чего рН достигает высоких величин, также неприемлемых для нормального развития растений.
Неблагоприятные свойства почв можно улучшить при помощи химической мелиорации. Различают мелиорацию кислых, солонцовых и щелочных почв.
Мелиорация кислых почв заключается в нейтрализации кислотности почвенного раствора, вызванного присутствием обменных ионов Н+ и А13+, при помощи карбоната кальция. Данный метод мелиорации носит название известкования:
 Н
Н 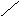 СО2↑
СО2↑
 ППК + СаСОз → ППK=Ca + H2CO3
ППК + СаСОз → ППK=Ca + H2CO3
Н  Н2О
Н2О
Мелиорация солонцовых почв проводится методом гипсования, т.е. добавления гипса CaSО4 ·H2O. При этом происходит следующая реакция:

 |
 ППК + СаSО4 → ППК = Са + Na2SO4
ППК + СаSО4 → ППК = Са + Na2SO4
Мелиорация щелочных почв. Для нейтрализации щелочности, обусловленной присутствием в почве карбонатов и гидрокарбонатов натрия, используют различные кислоты. Чаще применяют серную кислоту:
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
Кислота не только нейтрализует соду, но и способствует вытеснению обменного натрия из ППК:

 | |||
 | |||


 ППК +H2SO4 → ППК +Na2SO4
ППК +H2SO4 → ППК +Na2SO4
Кроме того, серная кислота способна образовывать другой мелиорант – гипс:
СаСО3 + H2SO4 → CaSO4 + Н2О + СО2↑
Nа2СО3 + CaSO4 → СаСО3 + Na2SO4
Такой метод мелиорации носит название кислования. Кроме кислоты возможно применение гидролитически кислых солей, которые способны оказывать действие, аналогичное кислоте, вследствие реакции гидролиза. В качестве подобных мелиорантов обычно используют железный купорос FeSO4·7Н2О:
|
|
FeSO4+ 2Н2О → Fе(ОН)2 + H2SO4.
Пример 1.
Рассчитать содержание действующих веществ (К2О, Р2О5) в монофосфате калия КН2РО4. Сколько этих веществ вносится со 120 кг удобрения?
Решение. Вычислим содержание К2О в удобрении. 1 моль К2О соответствует 2 молям КН2РО4. Масса 1 моля К2О составляет 94 г, а масса 1 моля КН2РО4 - 136 г. Примем массу удобрения за 100 %, тогда массу К2О найдем из пропорции:
 100 % КН2РО4 272 г 100 % КН2РО4 272 г
 х % К2О 94 г х % К2О 94 г
|  % %
|
Содержание Р2О5 рассчитаем на основе пропорции, учитывая, что 1 моль Р2О5 соответствует 2 молям удобрения, а масса 1 моля Р2О5 равна 142 г.
 100 % КН2РО4 272 г 100 % КН2РО4 272 г
 х % Р2О5 142 г х % Р2О5 142 г
|  % %
|
Поскольку содержание К2О в удобрении составляет 34,6 %, а всего вносится 120 кг удобрения, значит К2О:
 ;
;
с той же массой удобрения вносится определенное количество P2O5:
 .
.
Пример 2.
Технический хлорид аммония, применяемый в качестве удобрения,содержит 24 % азота. Какому процентному содержанию NH4Cl это соответствует? Сколько данного удобрения нужно взять, чтобы внести в почву 40 кг азота?
Решение. Поскольку содержание азота в удобрении составляет 24 %, значит, в 100 г этого удобрения содержится 24 г N. 1 моль N соответствует 1 молю NН4C1. Масса 1 моля N равна 14 г, такого же количества NH4C1 -53,5 г. Составим следующую пропорцию:
 14 г N 24 г 14 г N 24 г
 53,5 г NH4Cl х г 53,5 г NH4Cl х г
|  г г
|
100 г данного удобрения содержат 91,7 г NН4C1, т.е. 91,7 %. Рассчитаем необходимое количество удобрения, содержащее 40 кг N:
 100 кг удобрения 24 кг N 100 кг удобрения 24 кг N
 х кг 40 кг х кг 40 кг
|  кг кг
|
Пример 3.
Сколько молотого известняка, содержащего 80 % СаСО3, требуется для мелиорации 5 га, если расчетная доза СаСО3 составляет 2 т/га?
Решение. Рассчитаем количество СаСОз, необходимое для мелиорации 5 га:
1 га ─── 2 т
5 га ─── х х=5·2 = 10т
Зная содержание СаСОз в известняке, найдем требуемое количество известняка по пропорции:
 80 % ──── 10 т
80 % ──── 10 т
100 % ─── х
Вопросы и задачи
226. Написать формулы селитр:натриевой, калийной, кальциевой, аммиачной. Расположить указанные удобрения в порядке возрастания содержания азота (расчет привести полностью). Сколько азота вносится с 80 кг каждого удобрения?
|
|
227. Техническая мочевина, применяемая в качестве удобрения, содержит около 85 % CO(NH2)2. Какому процентному содержанию азота это соответствует? Сколько азота содержится в 150 кг технической мочевины?
228. Технический сульфат аммония, применяемый в качестве удобрения, содержит 20 % азота. Сколько процентов (NН4)2SO4 содержится вэтом удобрении? Сколько нужно взять данногоудобрения, чтобы внести в почву 60 кг азота?
229. Костяная мука, применяемая в качестве удобрения, должна по стандарту содержать не менее 30 % Р2О5. Какому содержанию фосфата кальция это соответствует? Сколько Р2О5 вносится со 180 кгкостяной муки?
230. Образец природного фосфорита содержит 30 % P2O5. Какова массовая доля фосфата кальция в фосфорите? Сколько фосфорита необходимо внести на 1 га, если расчетная доза P2O5 составляет 90 кг/га?
231. Образец апатита содержит 24 % P2O5. Вычислить: а)массовую долю фосфата кальция в апатите; б) сколько килограммов апатита надо взять, чтобы в них содержалось 400 г фосфата кальция?
232. По стандарту соликамский сильвинит должен содержать 15 % К2О. Какова массовая доля КСl в данном удобрении? Сколько К2О вносится со 180 кг сильвинита?
233. В золе подсолнечника содержится в среднем 50 % поташа. Какому процентному содержанию К2О в золе соответствует это содержание поташа? Сколько К2О вносится с200 кг золы?
234. Сколько сульфата аммония надо добавить к 100 кг калийной селитры, чтобы получить в смешанном удобрении равные весовые количества азота и калия в пересчете на N и К2О?
235. Сколько азота, К2О и Р2О5 вносится в почву с 200 кг комплексного удобрения NH4K2PO4? Каково содержание действующих веществ в этом удобрении?
236. Сколько азота, К2О и Р2О5 вносится в почву со 150 кг комплексного удобрения (NH4)2KPO4? Каково содержание действующих веществ в этом удобрении?
237. Рассчитать массовую долю азота, К2О и P2Os в калийной селитре и аммофосе. Сколько действующих веществ вносится со 120 кг каждого удобрения?
238. Рассчитать содержание действующих веществ в фосфате мочевины CO(NН2)2*Н3PO4. Сколько азота и Р2О5 вносится в почву со 150 кг этого удобрения?
239. Какое из перечисленных фосфорно-азотных удобрений – аммофос, диаммофос, фосфат мочевины CO(NH2)2*H3PO4, метафосфат аммония – является более концентрированным по суммарному содержанию азота и P2O5? Расчет привести полностью.
240. Какова массовая доля азота, К2О и P2O5 в смешанном удобрении состава КСl + 2(NH4)2HPO4? Сколько действующих веществ вносится с 200 кг этого удобрения?
241. В золе содержится около 25 % поташа. Какое количество сильвинита, содержащего 18 % К2О, может заменить 100 кг золы?
242. В навозе содержится примерно 0,6% К2О. Каким количеством минерального удобрения, содержащего 35% КСl, можно заменить калий, содержащийся в 1 т навоза?
|
|
243. Какое количество нитрата натрия равноценно 1 кг сульфата аммония по содержанию азота?
244. Каково процентное содержание азота в аммиачной селитре? Сколько процентов из этого количества приходится на аммиачный и сколько на нитратный азот? Сколько аммиачнойселитры необходимо, если расчетная доза азота составляет 80 кг/га?
245. Вычислить, какому количеству сульфата аммония по содержанию азота равноценны 1 кг аммофоса и 1 кг диаммофоса.
246. Какому количеству СаНРО4 равноценны1 кг аммофоса и 1 кг диаммофоса?
247. Вычислить процентное содержание азота в цианамиде кальция CaCN2. Сколько требуется цианамида кальция, чтобы по содержанию азота заменить 1 т аммиачной селитры?
248. Для подкормки одной из полевых культур расходуется 65 кг аммиачной селитры на 1 га. Сколько мочевины требуется, чтобы заменить это количество селитры?
249. Для удобрения требуется внести 10 кг/га азота. Какому количеству аммиачной селитры, сульфата аммония и мочевины это соответствует?
250. Какое из перечисленных удобрений – простой и двойной суперфосфат, преципитат, фосфоритная мука, аммофос, диаммофос – являяется более концентрированным фосфорным удобрением? Сколько Р2О5 вносится с 200 кг самого концентрированного и наименее концентрированного из удобрений? Расчеты привести полностью.
251. Написать уравнения реакций, которые протекают при мелиорации кислой почвы доломитовой мукой. Как изменится рН почвы после мелиорации? Ответ мотивировать.
252. В качестве мелиоранта кислых почв можно применять золу горючих сланцев, содержащую оксиды кальция, магния и калия. Написать уравнения реакций, протекающих в кислой почве при внесении золы.
253. Сколько молотого мела, содержащего 90 % карбоната кальция, нужно внести на 1 га, если известкование производится из расчета 3,5 т СаО на 1 гектар?
254. Сколько молотого известняка, содержащего 20 % примесей, необходимо для мелиорации 50 га, если на 1 га требуется 5 т СаСО3?
255. Сколько мергеля, содержащего 70 % карбоната кальция, необходимо для мелиорации 10 га, если расчетная доза СаСО3 составляет 2 т/га? Написать уравнения реакций, протекающих в кислой почве при ее мелиорации мергелем.
256. Сколько молотого известкового туфа, содержащего 25 % примесей, необходимо для мелиорации 10 га, если расчетная доза СаСО3 составляет 3 т/га?
257. Сколько дефеката - отхода свеклосахарного производства, содержащего 60 % карбоната кальция, необходимо для мелиорации 20 га, если известкование производится из расчета 2 т/га СаСО3?
258. Для определения гидролитической кислотности почв используют раствор ацетата натрия СН3СООNа. Написать уравнения реакций между почвой, насыщенной ионами водорода иалюминия и раствором ацетата натрия. Почему полученные в результате реакции растворы имеют низкие значения рН?
259. Написать уравнения реакций между солонцовой почвой и: а) водой; б) водой, содержащей СО2. Почему солонцовые почвы имеют высокие значения рН? Как можно мелиорировать такие почвы? Ответ подтвердить уравнениями соответствующих реакций.
260. Какой ион определяет неблагоприятные свойства солонцов? Какие вещества можно использовать для мелиорации солонцов? Написать уравнения реакций, протекающих при гипсовании почв. Можно ли для мелиорации солонцов применять СаСО3? Ответ мотивировать.
261. Какое количество глиногипса, содержащего 75 % гипса, необходимо для мелиорации солонца, если расчетная доза гипса составила 2 т/га? Написать уравнения реакций, протекающих при мелиорации солонцов глиногипсомв условиях орошения, учитывая, что в глиногипсе содержится также некоторое количество карбоната кальция.
262. Какое количество фосфогипса, содержащего 68 % CaSO4, необходимо для мелиорации солонца, если расчетная доза гипса составляет 2 т/га? Написать уравнение химической реакции, протекающей при мелиорации солонца фосфогипсом.
263. Какое количество гажи, содержащей 50 % CaSO4, необходимо для мелиорации солонца, если расчетная доза гипса составляет 2 т/га?
264. Для мелиорации содовых солонцов, содержащих карбонаты и гидрокарбонаты натрия, применяют фосфогипс, в состав которого кроме гипса входит фосфорная кислота. Написать уравнения всех возможных реакций, протекающих в содовых солонцах при мелиорации фосфогипсом.
265. Для мелиорации щелочных почв, содержащих карбонаты кальция и натрия и гидрокарбонаты натрия, применяют серную кислоту. Написать в молекулярной и молекулярно-ионной форме уравнения всех химических реакций, протекающих при мелиорации таких почв. Какой из продуктов реакции сам является мелиорантом?
266. Почему почвы, содержащие карбонаты и гидрокарбонаты натрия, имеют высокие значения рН? Какие мелиоранты можно использовать для улучшения свойств таких почв? Ответ подтвердить уравнениями химических реакций в молекулярной и молекулярно-ионной форме.
267. Почему применение сульфата железа (II) в качестве мелиоранта относятк способу кислования? Написать в молекулярной и молекулярно-ионнойформе уравнения всех химических реакций, протекающих при внесении FeSO4 в почву, содержащую карбонаты натрия и кальция.
268. Почему при гипсовании содовых солонцов, содержащих карбонаты натрия, не удается полностью нейтрализовать щелочность почвы? Какой способ мелиорации позволяет снизить рН почвы до нейтральных значений? Ответ подтвердить уравнениями соответствующих реакций в молекулярной и молекулярно-ионной форме.
269. Почему при кисловании содового солонца, содержащего карбонаты кальция и натрия, происходит снижение рН до нейтральных значений и насыщение почвы ионами кальция? Ответ подтвердить соответствующими реакциями в молекулярной имолекулярно-ионной форме, используя в качестве мелиоранта серную кислоту.
270. Для мелиорации солонцовых почв можно применять шлам, получающийся при осаждении серной кислоты из растворов известковым молоком. Сколько гидроксида кальция Са(ОН)2 необходимо взять, чтобы получить количество шлама, достаточное для мелиорации 50 га почвы, если расчетная доза гипса составляет 4,3 т/га?
271. Для вытеснения обменного натрия из почвы требуется 2 т/га CaSO4. Сколько кислоты, содержащей 80 % H2SO4, необходимо для полной мелиорации солонца, содержащего в мелиорируемом слое кроме СаСО3 еще и 3,55 т/га Na2CO3?
272. Сколько отхода, содержащего 40 % H2SO4 необходимо для мелиорации 25 га солонца, если расчетная доза серной кислоты составляет 5 т/га? Сколько сульфата кальция образуется при этом в почве?
273. Для нейтрализации щелочности в почвах рисовых систем требуется вносить в соответствии с расчетом 2,5 т/га серной кислоты. Сколько отработанной кислоты, содержащей 25 % H2SO4, необходимо для этого? Сколько NaHCО3 при этом нейтрализуется?
274. Сколько сернокислотного отхода, содержащего 70 % примесей, необходимо для мелиорации 10 га солонцов, если расчетная доза серной кислоты составляет 2 т/га? Сколько сульфата кальция образуется при этом в почве?
275. Сколько железного купороса, содержащего 50 % FeSO4, необходимо для мелиорации 20 га солонцов, если расчетная доза серной кислоты составляет 2 т/га?
|
|
|

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!