

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Интересное:
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
| Класс воды | Общая жесткость, ммоль/л |
| Очень мягкая | до 1,5 |
| Мягкая | 1,5 – 3,0 |
| Умеренно жесткая | 3 – 6 |
| Жесткая | 6 – 9 |
| Очень жесткая | более 9 |
Жесткость выражается количеством миллимолей эквивалентов ионов кальция, магния или их солей в одном литре воды. Расчет жесткости можно произвести по следующей формуле:

где Ж – жесткость воды, ммоль/л; m – масса ионов кальция или магния (или их солей), г; M Э – эквивалентная масса кальция или магния (или их солей), г/моль; V – объем воды, л.
По указанной формуле жесткость рассчитывается отдельно по кальцию и магнию, а затем суммируется.
Пример 1.
Вычислить жесткость воды, зная, что в 1500 л ее содержится 607,5 г Ca(HCO3)2.
Решение.
Эквивалентная масса Ca(HCO3)2 равна 81 г/моль. Рассчитываем жесткость воды по формуле
 .
.
Класс воды – умеренно жесткая.
Пример 2.
Сколько граммов СaSO4 содержится в 2 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль/л?
Решение.
Эквивалентная масса CaSO4 равна 136,14/2 = 68,07 г/моль.
Выражаем массу соли через формулу определения жесткости:

подставляя значения, получаем:  .
.
Пример 3.
Сколько граммов соды надо прибавить к 750 л воды, чтобы устранить ее жесткость, равную 6 ммоль/л?
Решение.
В 750 л воды содержится 750 × 6 = 4500 ммоль/л солей, обусловливающих жесткость воды. Эквивалентная масса соды Na2CO3 – 53 г/моль. Для устранения жесткости следует прибавить: 4500 × 53 × 10–3 = 238,5 г соды.
Пример 4.
Вычислить карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н. раствора HCl.
Решение.
Вычисляем количество миллимолей соляной кислоты, пошедшей на титрование: 6,25 × 0,08 = 0,5ммоль.
|
|
Такое же количество гидрокарбоната будет содержаться в 100 см3 воды.
В литре воды будет присутствовать  ммоль/л гидрокарбоната кальция.
ммоль/л гидрокарбоната кальция.
Следовательно, карбонатная жесткость воды равна 5 ммоль/л.
Контрольные вопросы и задачи
| 201. | Cколько граммов карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость, равную 3 ммоль/л? |
| 202. | Вода, содержащая только сульфат магния, имеет жесткость 7 мэкв. Сколько граммов сульфата магния содержится в 300 л этой воды? |
| 203. | Вычислите жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбоната магния и 61,2 г сульфата кальция. |
| 204. | Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4 ммоль/л. Сколько 0,1 н. раствора НСl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 см3 этой воды? |
| 205. | В 1 м3 воды содержится 140 г сульфата магния. Вычислите жесткость этой воды. |
| 206. | Вода, содержащая только гидрокарбонат магния, имеет жесткость 3,5 ммоль/л. Сколько граммов гидрокарбоната магния содержится в 200 л этой воды? |
| 207. | К 1 м3 жесткой воды прибавили 132,5 г карбоната натрия. На сколько миллимоль на литр понизилась жесткость? |
| 208. | Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,2 г карбоната натрия? |
| 209. | Сколько граммов CaSO4 содержится в 200 л воды, если жесткость, обусловливаемая этой солью, равна 8 ммоль/л? |
| 210. | Сколько граммов карбоната натрия надо прибавить к 0,1 м3 воды, чтобы устранить жесткость, равную 4 ммоль/л? |
| 211. | К 100 л жесткой воды прибавили 12,95 г гидроксида кальция. На сколько миллимоль на литр понизилась карбонатная жесткость? |
| 212. | Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция? |
| 213. | Сколько граммов гидроксида кальция надо прибавить к 275 л воды, чтобы устранить ее карбонатную жесткость, равную 5,5 ммоль/л? |
| 214. | Скольким миллимолям - эквивалентам равняется жесткость воды, если для устранения ее к 100 л воды потребовалось прибавить 15,9 г соды? |
| 215. | Сколько граммов гашеной извести надо прибавить к 1000 л воды, чтобы устранить ее временную жесткость, равную 2,86 ммоль/л? |
| 216. | Вычислите временную жесткость воды, зная, что на реакцию с гидрокарбонатом, содержащимся в 100 мл этой воды, израсходовано 5 миллилитров 0,1 н. раствора соляной кислоты. |
| 217. | Жесткость воды, содержащей только гидрокарбонат кальция, равна 1,785 ммоль/л. Определите количество гидрокарбоната в литре этой воды. |
| 218. | Какова временная жесткость воды, в литре которой содержится 0,146 г гидрокарбоната магния? |
| 219. | Вычислите постоянную жесткость воды, зная, что для удаления ионов кальция, содержащихся в 50 л этой воды, потребовалось прибавить к воде 10,8 г безводной буры. |
| 220. | Путем анализа было установлено, что в одном литре исследуемой воды содержится 42 мг ионов магния и 112 мг ионов кальция. Вычислите общую жесткость воды. |
|
|
тема 12. Комплексные соединения
Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, называются комплексными соединениями.
Пример образования комплексного соединения:
CuSO4 + 4NH3 = [Cu(NH3)4]SO4.
 Комплексные соединения состоят из двух сфер: внешней и внутренней. В приведенном примере внешняя сфера
Комплексные соединения состоят из двух сфер: внешней и внутренней. В приведенном примере внешняя сфера  , внутренняя –
, внутренняя –  .
.
Внутренняя сфера, называемая комплексом, включает нейтральный ион или атом, вокруг которого координируются отрицательно заряженные ионы или молекулы. При записи комплексного соединения внутреннюю сферу или комплекс заключают в скобки, например [Cu(NH3)4]2+.
Центральный ион или атомназывается комплексообразователем, а координируемые им ионы или молекулы – лигандами.
Число лигандов, координируемых комплексообразователем, называют координационным числом (к.ч.).
В приведенном примере ион Cu2+ – комплексообразователь, молекулы NH3 – лиганды, к.ч. = 4.
Степенью окисления или зарядом комплексообразователя называется его действительный или условный заряд.
В соединении [Cu(NH3)4]SO4 степень окисления (заряд иона) комплексообразователя равна +2 (Cu2+).
Комплексные соединения классифицируют по заряду их внутренней сферы:
а) катионные комплексы. В этих соединениях комплексная часть вещества имеет положительный заряд, например, [Cu(NH3)4]2+, [Ni(H2O)4]2+;
б) анионные комплексы. В соединениях данного типа комплексная часть молекулы имеет отрицательный заряд например, [PtF6]–, [Zn(CN)4]2–.
|
|
в) нейтральные комплексы. К ним относятся комплексные соединения, состоящие только из внутренней сферы, например, [Ni(CO)6], [Pt(NH3)2Cl2].
Заряд комплекса численно равен алгебраической сумме заряда центрального иона и зарядов лигандов. Например, заряд комплекса [Zn(CN)4]2– равен Z = Z Zn2++ 4 Z CN–= 2 + 4(–1) = –2.
Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера. К наиболее распространенным комплексообразователям относятся ионы d- элементов VII, VIII, I и II групп периодической таблицы элементов.
К числу лигандов относятся простые анионы, такие как F–, Cl–, Br–, I–, S2–; сложные анионы, например, CN–, CNS–, NO2; молекулы, например, H2O, NH3, CO. Ионы или отдельные атомы ионов и молекул лигандов имеют неподеленные пары электронов.
Комплексные соединения диссоциируют в растворах как сильные электролиты на внешнюю и внутреннюю сферы (комплексы). Например:
[Cu(NH3)4]SO4 ® [Cu(NH3)4]2+ + SO42–,
K2[Zn(CN)4] ® 2K+ + [Zn(CN)4]2–.
Комплексы (комплексные ионы), в свою очередь, диссоциируют как слабые электролиты, причем диссоциация их происходит как многоступенчатый процесс, например:
[Zn(CN)4]2– «[Zn(CN)3]– + CN– K 1;
[Zn(CN)3]– «[Zn(CN)2] + CN– K 2;
[Zn(CN)2] «[Zn(CN)]+ + CN– K 3;
[Zn(CN)]+ «Zn2+ + CN– K 4;
___________________________________
[Zn(CN)4]2– «Zn2+ + CN– K Н.
Константа суммарной реакции диссоциации комплекса KН называется константой нестойкости и равна произведению констант ступенчатых диссоциаций:
K Н = K 1 K 2 K 3 K 4.
В соответствии с уравнением равновесия суммарной реакции диссоциации комплекса константу нестойкости можно выразить уравнением:

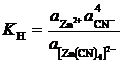 .
.
или в общем виде для диссоциации комплекса:
 ;
;
 ,
,
где Z – заряд комплекса; n + – заряд комплексообразователя; m – заряд лиганда, а – активности продуктов диссоциации, моль/л.
Чем ниже константа нестойкости комплекса, тем прочнее комплекс, тем меньше концентрация в растворе простых ионов, образующихся при диссоциации комплекса.
Константа процесса, обратного диссоциации комплекса, то есть процесса образования комплекса, называется константой устойчивости комплекса.
|
|
Например, константа образования цианистого комплексного иона цинка
Zn2+ + 4CN– «[Zn(CN)4]2–
или константа устойчивости этого комплекса равна,
 ,
,  .
.
Константа устойчивости и соответственно прочность комплекса зависит от природы лигандов и комплексообразователей, а также от значения координационного числа.
Контрольные вопросы и задачи
| 221. | Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях Cu[(NH3)4]SO4, K2[PlCl6], K[Ag(CN)2]. Напишите уравнения диссоциации этих соединений в водных растворах. |
| 222. | Составьте координационные формулы следующих комплексных соединений платины: PtCl4∙6NH3, PtCl4∙6NH3, PtCl4∙6NH3. Координационное число платины (IV) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из них является комплексным неэлектролитом? |
| 223. | Составьте координационные формулы следующих комплексных соединений кобальта: CoCl4∙6NH3, CoCl4∙5NH3, CoCl4∙4NH3. Координационное число кобальта (III) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах. |
| 224. | Определите, чему равны заряд комплексного иона, степень окисления и координационное число сурьмы в соединениях Rb[SbBr6], K[SbCl6], Na[Sb(SO4)2]. Как диссоциируют эти соединения в водных растворах? |
| 225. | Составьте координационные формулы следующих комплексных соединений серебра: Ag∙2NH3, AgCN∙KCN, AgNO2∙NaNO2. Координационное число серебра (I) равно двум. Напишите уравнения диссоциации этих соединений в водных растворах. |
| 226. | Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях K4[Fe(CN)6], K4[TiCl8], K2[HgI4]. Как диссоциируют эти соединения в водных растворах? |
| 227. | Из сочетания частиц Co3+, NH3, NO2–, K+ можно составить семь координационных формул комплексных соединений кобальта, одна из которых [Co(NH3)6](NO2)3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах. |
| 228. | Определите, чему равен заряд следующих комплексных ионов: [Cr(H2O)4Cl2], [HgBr4], [Fe(CN)6], если комплексообразователями являются Cr3+, Hg2+, Fe3+. Напишите формулы соединений, содержащие эти комплексные ионы. |
| 229. | Определите, чему равен заряд комплексных ионов Cr[(NH3)5(NO)3], [Pd(NH3)Cl3], [Ni(CN)4], если комплексообразователями являются Cr3+, Pd2+, Ni2+. Напишите формулы комплексных соединений, содержащих эти ионы. |
| 230. | Из сочетания частиц Cr3+, H2O, Cl– и K+ можно составить семь координационных формул комплексных соединений хрома, одна из которых [Cr(H2O)6]Cl3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах. |
| 231. | Составьте координационные формулы следующих комплексных соединений кобальта: CoCl3∙3NH3∙2H2O, 2KNO2∙NH3∙Co(NO2)3, 3NaNO2∙Co(NO2)3. Координационное число кобальта (III) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах. |
| 232. | Напишите выражения для констант нестойкости комплексных ионов [Ag(NH3)2]+, [Fe(CN)6]4–, [PtCl6]2–. Чему равны степень окисления и координационное число комплексообразователей в этих ионах? |
| 233. | Константы нестойкости комплексных ионов [Co(CN)4]2–, [Hg(CN)4]2–, [Cd(CN)4]2– соответственно равны 8∙10–20, 4∙10–41, 1,4∙10–17. В каком растворе, содержащем эти ионы (при равной молярной концентрации), ионов CN– больше? Напишите выражения для констант нестойкости указанных комплексных ионов. |
| 234. | Напишите выражения для констант нестойкости следующих комплексных ионов: [Ag(CN)2]–, [Ag(NH3)2]+, [Ag(SCN)2]–. Зная, что они соответственно равны 1,0∙10–21, 6,8∙10–8, 2,0∙10–11, укажите, в каком растворе, содержащем эти ионы (при равной молярной концентрации), больше ионов Ag+. |
| 235. | При прибавлении раствора KCN к раствору [Zn(NH3)4]SO4 образуется растворимое комплексное соединение K2[Zn(CN)4]. Напишите молекулярное и ионно-молекулярное уравнения реакции. Константа нестойкости какого иона: [Zn(NH3)4]2+ или [Zn(CN)4]2– больше? Почему? |
| 236. | Напишите уравнения диссоциации солей K3[Fe(CN)6] и NH4Fe(SO4)2 в водном растворе. К каждой из них прилили раствор щелочи. В каком случае выпадает осадок гидроксида железа? Напишите молекулярное и ионное уравнения реакции. Какие комплексные соединения называются двойными солями? |
| 237. | Составьте координационные формулы следующих комплексных соединений платины (II), координационное число которой равно четырем: PtCl2∙3NH3, PtCl2∙NH3∙KCl, PtCl2∙2NH3. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из них является комплексным неэлектролитом? |
| 238. | Хлорид серебра растворяется в растворах аммиака и тиосульфата натрия. Дайте этому объяснение и напишите молекулярные и ионно-молекулярные уравнения соответствующих реакций. |
| 239. | Какие комплексные соединения называются двойными солями? Напишите уравнения диссоциации солей K4[Fe(CN)6] и (NH4)2Fe(SO4)2 в водном растворе. В каком случае выпадает осадок гидроксида железа, если к каждой из солей прилить раствор щелочи? Напишите молекулярное и ионно-молекулярное уравнения реакции. |
| 240. | Константы нестойкости комплексных ионов [Co(NH3)6]3+, [Fe(CN)6]4–, [Fe(CN)6]3– соответственно равны 6,2∙10–36, 1,0∙10–37, 1,0∙10–44. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ионы. |
|
|
Приложение
Варианты заданий и номера задач
| Вариант | Номера задач | |||||||||||
П р о д о л ж е н и е п р и л о ж е н и я
| Вариант | Номера задач | |||||||||||
О к о н ч а н и е п р и л о ж е н и я
| Вариант | Номера задач | |||||||||||
|
|
|

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!