Цель МКТ – это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела – большие тела, состоящие из огромного числа молекул.
Тепловые явления – явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ:
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Броуновское движение - это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
- открыто английским ботаником Р. Броуном в 1827 г.
- дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
- экспериментально подтверждено франц. физиком Ж. Перреном.
Размеры частиц: диаметр любого атома составляет около  см.
см.
Число молекул в веществе:
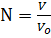 где V – объем вещества,
где V – объем вещества,
Vo – объем одной молекулы
Масса одной молекулы:
 где m – масса вещества,
где m – масса вещества,
N – число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м.:
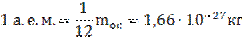
Относительная молекулярная масса вещества:
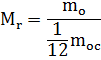 Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
где числитель - это масса молекулы, а знаменатель - 1/12 массы атома углерода
 – величина безразмерная, т.е. не имеет единиц измерения
– величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента:
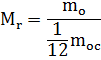
где числитель - это масса атома, а знаменатель - 1/12 массы атома углерода
 – величина безразмерная, т.е. не имеет единиц измерения
– величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
(относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества:
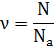 Количество вещества (ν) определяет относительное число молекул в теле.
Количество вещества (ν) определяет относительное число молекул в теле.
где N – число молекул в теле, а Na - постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль – это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Молярная масса (M) - это масса вещества, взятого в одном моле, или иначе - это масса одного моля вещества
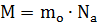 где
где  – масса молекулы,
– масса молекулы, 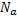 - постоянная Авогадро
- постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.

Масса любого количества вещества:
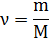
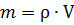
Количество вещества:



 Число молекул в веществе:
Число молекул в веществе:
Молярная масса:
Масса одной молекулы:
Связь между относительной молекулярной массой и молярной массой:
К онцентрации молекул:
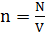 где N - число молекул газа
где N - число молекул газа
V - объем газа
П лотности газа:
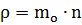 где mo - масса молекулы
где mo - масса молекулы
n - концентрация молекул (1/м3)
Температура

Температура - это мера средней кинетической энергии молекул, характеризует степень нагретости тел.
Прибор для измерения температуры - термометр.
Абсолютная шкала температур
- введена англ. физиком У. Кельвином
- нет отрицательных температур
Единица абсолютной температуры в СИ: [T] = 1K (Кельвин)
Нулевая температура абсолютной шкалы – это абсолютный ноль (0К = -273 С), самая низкая температура в природе. В настоящее время достигнута самая низкая температура - 0,0001К.
По величине 1К равен 1 градусу по шкале Цельсия.
 Связь абсолютной шкалы со шкалой Цельсия: в формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t».
Связь абсолютной шкалы со шкалой Цельсия: в формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t».

pV = 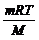
Основное уравнение МКТ газа
Основное уравнение МКТ связывает микропараметры частиц (массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р - давление, V - объем, Т - температура).
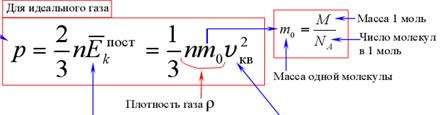
средняя кинетическая энергия поступательного движения молекул средняя квадратичная скорость
р = пkТ
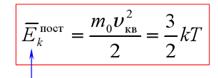
средняя кинетическая энергия поступательного движения молекул
Средняя квадратичная скорость: 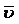 =
= 
Внутренняя энергия одноатомного идеального газа: U = 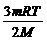 =
=  pV
pV




 см.
см.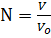 где V – объем вещества,
где V – объем вещества, где m – масса вещества,
где m – масса вещества,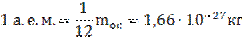
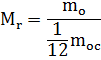 Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода. – величина безразмерная, т.е. не имеет единиц измерения
– величина безразмерная, т.е. не имеет единиц измерения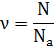 Количество вещества (ν) определяет относительное число молекул в теле.
Количество вещества (ν) определяет относительное число молекул в теле.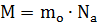 где
где  – масса молекулы,
– масса молекулы, 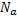 - постоянная Авогадро
- постоянная Авогадро
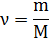
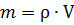



 Число молекул в веществе:
Число молекул в веществе: 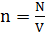 где N - число молекул газа
где N - число молекул газа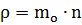 где mo - масса молекулы
где mo - масса молекулы
 Связь абсолютной шкалы со шкалой Цельсия: в формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t».
Связь абсолютной шкалы со шкалой Цельсия: в формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t».
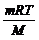

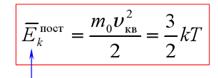
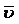 =
= 
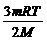 =
=  pV
pV



