В этом опыте вы изучите влияние концентраций исходных веществ и продуктов на положение химического равновесия в гомогенной системе:
FeCl3 + 3KNCS ↔ Fe(NCS)3 + 3KCl.
Смещению данного равновесия вправо соответствует усиление окраски раствора, а смещению влево – её ослабление.
Выполнение:
Приготовьте гомогенную равновесную систему, смешав в пробирке примерно по 2 см3 разбавленных растворов FeCl3 и KNCS. Полученный раствор разделите на 3 части (в пробирках). Одну из них оставьте в качестве контрольной.
В первую пробирку добавьте 1 каплю насыщенного раствора KNCS, во вторую – 2–3 шпателя кристаллов KCl. Содержимое пробирок перемешайте и сравните интенсивность окраски в них с интенсивностью в контрольной пробирке.
Задания:
Запишите наблюдаемые эффекты и объясните их. Сделайте вывод о направлении смещения равновесия при изменении концентраций исходных веществ и продуктов реакции. Запишите выражение константы химического равновесия изученного процесса.
ОПЫТ 5. Изучение влияния температуры на положение равновесия в гомогенной системе
В этом опыте вы изучите влияние температуры на положение равновесия процесса
2NO2 (г) ↔ N2O4 (г) + Q.
Смещению равновесия влево соответствует усиление бурой окраски газа, а вправо – ее ослабление.
Выполнение:
Одну из сообщающихся колб, наполненных смесью оксидов NO2 и N2O4, опустите в стакан с охладительной смесью (NaCl + лёд), а другую – в стакан с горячей водой. Через 1 – 2 минуты сравните интенсивность окраски газа в колбах. Теперь поменяйте колбы местами: охлажденную колбу опустите в стакан с горячей водой, а нагретую – в стакан с охладительной смесью. Наблюдайте за изменением интенсивности окраски газа в колбах.
Задания:
Запишите наблюдаемые явления и объясните их. Сделайте вывод о влиянии температуры на положение химического равновесия. Запишите выражение константы химического равновесия изученного процесса. Пользуясь справочными данными, определите температурные условия осуществления прямой реакции.
Когда и что сделать?
Дома перед занятием:
1. Изучите содержание лабораторной работы, подготовьтесь к опросу по данному материалу.
2. В тетради для лабораторных работ сделайте заготовку отчёта о выполнении работы. В начале отчёта укажите дату, номер работы и её название. После этого перепишите в тетрадь названия и методики выполнения опытов из вышеприведенной «Экспериментальной части», оставляя места для записи наблюдений, объяснений, расчётов, ответов на вопросы и выводов.
На занятии:
3. Выполните экспериментальную часть работы, строго следуя инструкции и тщательно записывая промежуточные результаты в отчёт.
4. Уберите своё рабочее место.
Дома после занятия:
5. Выполните необходимые расчёты и запишите их в отчёт. Постройте график.
6. Ответьте письменно в тетради для лабораторных работ на контрольные вопросы:
а) Дайте определение скорости гомогенной химической реакции. Каковы её физический смысл и единицы?
б) Перечислите факторы, влияющие на величину скорости химических реакций.
в) Какова зависимость скорости химических реакций от концентраций реагентов? Как называется соответствующий закон, определяющий эту зависимость? Как он формулируется?
г) Какова зависимость скорости химических реакций от температуры? Каков физический смысл коэффициента скорости реакции? От каких факторов зависит его величина?
д) Что такое катализаторы? Какие вещества могут выступать в роли катализаторов? Как можно объяснить их влияние на скорость реакций?
е) Какое состояние системы называется химическим равновесием? Сформулируйте принцип Ле Шателье.
ж) Каково влияние концентраций исходных веществ и продуктов реакции на состояние химического равновесия в системе?
з) Каково влияние температуры на состояние химического равновесия в гомогенной системе?
ЛАБОРАТОРНАЯ РАБОТА № 2
«Очистка СОЛЕЙ от РАСТВОРИМЫХ И НЕРАСТВОРИ-
МЫХ ПРИМЕСЕЙ методом перекристаллизации»
Т е о р е т и ч е с к а я ч а с т ь
I. Фильтрование
 Фильтрование – процесс механического разделения твёрдых и жидких компонентов смесей с помощью фильтров. Фильтр – мелкопористый материал, пропускающий жидкость и задерживающий на своей поверхности частицы твёрдого вещества. Жидкость, прошедшая через фильтр, называется фильтратом. В лабораторной практике используются стеклянные и бумажные фильтры.
Фильтрование – процесс механического разделения твёрдых и жидких компонентов смесей с помощью фильтров. Фильтр – мелкопористый материал, пропускающий жидкость и задерживающий на своей поверхности частицы твёрдого вещества. Жидкость, прошедшая через фильтр, называется фильтратом. В лабораторной практике используются стеклянные и бумажные фильтры.
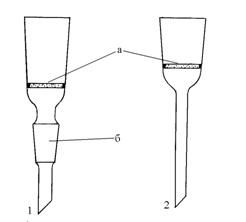
Стеклянные фильтры (или фильтры Шотта) (рис.1) представляют собой стеклянные воронки с вплавленными в них пластинами из спрессованного пористого стекла.
 Такие фильтры химически устойчивы и используются для фильтрования агрессивных жидкостей за исключением плавиковой кислоты и концентрированных растворов щелочей. Они изготавливаются только в заводских условиях, хрупки и требуют бережного обращения.
Такие фильтры химически устойчивы и используются для фильтрования агрессивных жидкостей за исключением плавиковой кислоты и концентрированных растворов щелочей. Они изготавливаются только в заводских условиях, хрупки и требуют бережного обращения.
Бумажные фильтры изготавливают из специальных сортов бумаги разной плотности. По сравнению со стеклянными фильтрами они химически нестойки и легко разрушаются растворами кислот и щелочей, некоторых солей. В то же время бумажные фильтры дёшевы и легко изготавливаются в лабораторных условиях. Различают гладкие и складчатые бумажные фильтры.
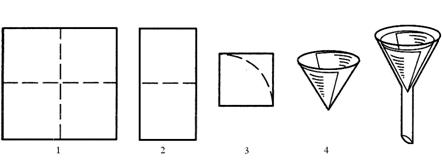
Гладкие фильтры используются тогда, когда целью фильтрования является выделение твёрдого вещества (осадка). Такой фильтр изготавливают из круга фильтровальной бумаги, диаметр которого примерно в раза больше диаметра воронки. Для этого бумажный круг складывают вчетверо (по пунктирам) и образовавшийся сегмент разворачивают в конус, одна половина которого состоит из одного, а вторая – из трёх слоёв бумаги (рис. 2).
При отсутствии круга используют лист бумаги, имеющий форму квадрата со стороной, примерно в 2 раза большей диаметра воронки. Его складывают вчетверо, образовавшийся малый квадрат обрезают ножницами по дуге с таким расчётом, чтобы верхний край фильтра не доходил до края воронки на 3 – 5 мм. Как и в предыдущем случае, сегмент разворачивают в конус
(рис. 3).
Приготовленный фильтр вкладывают в воронку и, прижимая к её стенкам, смачивают небольшим количеством воды.
Если целью фильтрования является получение жидкости, а также при необходимости увеличить скорость фильтрования применяют складчатый фильтр. Его изготавливают так же, как и гладкий фильтр, но при этом полукруг складывают по пунктирам поочерёдно в противоположные стороны с образованием «гармошки» (рис.4). Её расправляют и вставляют в воронку, не смачивая водой.




 Фильтрование – процесс механического разделения твёрдых и жидких компонентов смесей с помощью фильтров. Фильтр – мелкопористый материал, пропускающий жидкость и задерживающий на своей поверхности частицы твёрдого вещества. Жидкость, прошедшая через фильтр, называется фильтратом. В лабораторной практике используются стеклянные и бумажные фильтры.
Фильтрование – процесс механического разделения твёрдых и жидких компонентов смесей с помощью фильтров. Фильтр – мелкопористый материал, пропускающий жидкость и задерживающий на своей поверхности частицы твёрдого вещества. Жидкость, прошедшая через фильтр, называется фильтратом. В лабораторной практике используются стеклянные и бумажные фильтры. Такие фильтры химически устойчивы и используются для фильтрования агрессивных жидкостей за исключением плавиковой кислоты и концентрированных растворов щелочей. Они изготавливаются только в заводских условиях, хрупки и требуют бережного обращения.
Такие фильтры химически устойчивы и используются для фильтрования агрессивных жидкостей за исключением плавиковой кислоты и концентрированных растворов щелочей. Они изготавливаются только в заводских условиях, хрупки и требуют бережного обращения.