НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ «МИСиС»
Кафедра защиты металлов и технологии поверхности
Пустов Ю.А., Ракоч А.Г., Баутин В.А., Бардин И.В.
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
Лабораторный практикум
Допущено учебно-методическим объединением по образованию в области металлургии в качестве учебного пособия для студентов высших учебных заведений, обучающихся по направлению 150400 – «Металлургия», 150100 – «Материаловедение и технология материалов», 150700 – «Физическое материаловедение» по специальности 150701 – «Физико-химия процессов и материалов» и 150702 – «Физика металлов».
Москва Издательский Дом МИСиС 2011
АННОТАЦИЯ
Лабораторный практикум по коррозии и защите металлов составлен коллективом авторов кафедры защиты металлов и технологии поверхности на основе книги Томашов Н.Д., Жук Н.П., Титов В.А., Веденеева М.А. Лабораторные работы по коррозии и защите металлов, М.: Металлургия, 1971, а также лабораторного практикума № 128 под редакцией профессора Опары Б.К. (авторы Пустов Ю.А., Телков В.И., Яковлев В.Б., Васильев В.Ю., Кравчинский А.П., Опара Б.К., Квокова И.М.), и с учетом многолетнего опыта преподавания курса «Коррозия и зашита металлов» на кафедре.
В практикуме, представлены описания 20 работ, экспериментально иллюстрирующих, основные разделы курса. Каждая работа содержит краткое теоретическое введение, описание аппаратуры и методики работы, а также методы обработки опытных данных. В конце практикума приведены необходимые для расчетов справочные данные.
ОГЛАВЛЕНИЕ
| Введение……………………………………………………………………………….
|
|
| Общие правила проведения лабораторных работ и оформления отчета…………
|
|
| Техника безопасности при выполнении лабораторных работ……………………..
|
|
| Лабораторная работа № 1. Кинетика окисления металлов на воздухе……………
|
|
| Лабораторная работа 2. Влияние температуры на скорость окисления металлов на воздухе……………………………………………………………………………...
|
|
| Лабораторная работа 3. Жаростойкость металлов и сплавов на воздухе…………
|
|
| Лабораторная работа 4. Электродные потенциалы металлов……………………...
|
|
| Лабораторная работа 5. Влияние катодных структурных составляющих сплава на скорость электрохимической коррозии………………………………………….
|
|
| Лабораторная работа 6. Поляризация и деполяризация электродов работающей коррозионной пары…………………………………………………………………...
|
|
| Лабораторная работа 7. Кислородная деполяризация катода……………………...
|
|
| Лабораторная работа 8. Перенапряжение водорода на металлах…………………
|
|
| Лабораторная работа 9. Пассивность стали………………………………………...
|
|
| Лабораторная работа 10. Контактная коррозия алюминиевых сплавов…………..
|
|
| Лабораторная работа 11. Расслаивающая коррозия алюминиевых сплавов……...
|
|
| Лабораторная работа 12. Межкристаллитная коррозия сталей и сплавов………..
|
|
| Лабораторная работа 13. Питтинговая коррозия алюминиевых сплавов…………
|
|
| Лабораторная работа 14. Кинетика коррозионного растрескивания сплавов……
|
|
| Лабораторная работа 15. Диагностика коррозионного разрушения………………
|
|
| Лабораторная работа 16. Ингибиторы коррозии металлов………………………...
|
|
| Лабораторная работа 17. Защита сталей от коррозии внешним током…………...
|
|
| Лабораторная работа 18. Защита стали от коррозии с помощью анодного протектора…………………………………………………………………………….
|
|
| Лабораторная работа 19. Защитные металлические покрытия……………………
|
|
| Лабораторная работа 20. Металлические неорганические защитные покрытия на стали………………………………………………………………………………..
|
|
| Библиографический список………………………………………………………….
|
|
| Приложение 1. Физические свойства некоторых металлов и их оксидов………...
|
|
| Приложение 2. Таблица стандартных потенциалов металлов и некоторых окислительно-восстановительных реакций…………………………………………
|
|
| Приложение 3. Средние коэффициенты активности некоторых сильных электролитов γ± в водных растворах при 25 ºС……………………………………..
|
|
| Приложение 4. Произведение растворимостей (L) труднорастворимых веществ в воде…………………………………………………………………………………..
|
|
| Приложение 5. Давление насыщенного водяного пара при температурах от 10 до 39 ºС………………………………………………………………………………...
|
|
ВВЕДЕНИЕ
В связи с необходимостью непрерывного совершенствования методов защиты металлов от коррозии во всех отраслях промышленности важной задачей является повышение качества подготовки инженеров и исследователей-коррозионистов. Дисциплина «Коррозия и защита металлов» базируется на экспериментальных исследованиях, поэтому для ее усвоения необходимо не только изучить основы теоретического курса, но и овладеть современными экспериментальными методами в этой области. При исследовании коррозионных процессов и повреждений используют весь арсенал современных средств изучения свойств металлов и сплавов и растворов электролитов. В кратком курсе невозможно познакомить студентов со всеми методами, которые могут быть использованы для исследования коррозионных процессов. Поэтому в данном практикуме выполнение лабораторных работ основано на использовании современных, наиболее простых методов исследования, наглядно иллюстрирующих соответствующие положения теоретического курса.
Общие правила проведения лабораторных работ и оформления отчета
Продолжительность лабораторных работ – 2 часа, выполнение работы индивидуальное. Студент должен заранее подготовиться к ее выполнению: составить конспект работы, нарисовать и изучить схему установки для исследования, подготовить все таблицы для записи наблюдений. Студент должен также подготовиться к программированному допуску к лабораторной работе.
Образец вопросов контроля-допуска прилагается в конце каждой работы. Подготовка к допуску предусматривает проработку теоретической части лабораторной работы, а подготовка к защите – еще и проработку литературы, указанной в конце практикума в библиографическом списке.
Отчет по лабораторной работе рекомендуется составлять по следующей (примерной) схеме:
1) название работы;
2) цель работы;
3) краткое теоретическое введение;
4) методика работы (схема установки и порядок проведения опыта);
5) результаты опытов (в виде таблицы) и их обработка;
6) выводы.
Первые четыре пункта отчета и таблица для записи результатов измерений оформляются при подготовке к лабораторной работе, пункт пятый – в процессе ведения опыта и после его окончания, пункт шестой – после обработки результатов измерений.
Теоретическое введение должно быть изложено кратко и с предельной ясностью.
Схему установки нужно вычерчивать и снабжать надписями так, чтобы она была наглядна и понятна без устных пояснений.
При описании порядка проведения опыта все выполняемые операции излагают кратко, не повторяя текста практикума.
Результаты опытов записываются в заранее составленную таблицу, примерная форма которой приведена в описании каждой работы. В таблицу записывают результаты непосредственных измерений, а необходимые поправки и расчеты делают до окончания опыта. Результаты измерений, как правило, подлежат дополнительной обработке – аналитической и графической. Аналитическая обработка результатов измерений состоит в пересчете электродных потенциалов на водородную шкалу, в расчете показателя скорости коррозии. Графическая обработка результатов измерений состоит в построении соответствующих графиков, последующем спрямлении кривых и представлении результатов измерений в виде уравнений.
При использовании персонального компьютера аналитическая и графическая обработка результатов экспериментов может быть проведена с использованием программы Microsoft Office Excel или любой подобной. Результаты расчетов на персональном компьютере приводятся в отчете в виде распечатки соответствующих таблиц и графиков.
Отчет по работе завершается краткими выводами, отражающими результаты соответствующей обработки полученных экспериментальных данных.
Лабораторная работа № 1.
Цель работы
Установить закон роста оксидной пленки во времени при окислении металла на воздухе при высокой температуре, определить постоянные коэффициенты в уравнении скорости окисления.
Теоретическое введение
Законы роста оксидной пленки в значительной степени определяются ее структурой и защитными свойствами. По защитной способности оксидные пленки можно разделить на два основных класса: первый класс – если объемное отношение Vок/VМе, т.е. отношение молярного объема оксида на один г-ат. металла к атомному объему металла меньше единицы, то оксид не сможет полностью покрыть поверхность металла и не будет обладать защитными свойствами; второй класс – если объемное отношение Vок/VМе больше единицы, то оксид обладает защитной способностью.
Для первого случая имеет место линейный закон роста оксидной пленки:
Δ m (или δ) = К 1τ, (1)
где К 1 – константа скорости окисления, г/(м2·ч); τ – время окисления, ч; Δ m – удельное увеличение массы образца, г/м2; δ – толщина пленки, м.
Скорость линейного окисления постоянна во времени и не зависит от количества уже прореагировавшего газа или металла. Наиболее заторможенной стадией процесса является реакция на поверхности или фазовой границе (кинетический контроль).
У сплошных пленок, обладающих защитными свойствами (V ок /V Ме > 1), скорость роста пленки лимитируется скоростью термодиффузии реагентов (диффузионный контроль). Процесс сопровождается самоторможением: по мере роста пленки скорость диффузии реагентов (металла и кислорода) через нее уменьшается, что приводит к замедлению скорости коррозионного процесса. В этом случае пленка растет по параболическому закону:
Δ m 2 (или δ2) = К 2τ, (2)
где К 2 – параболическая константа скорости окисления, г2/(м4·ч) (м2/ч).
В случае, если скорость роста пленки лимитируется и скоростью диффузии реагентов, и скоростью химической реакции (смешанный диффузионно-кинетический контроль), рост пленки может быть описан квадратичным уравнением Эванса:
К 1Δ m 2 + К 2Δ m = К 1 К 2τ, (3)
где К 1 и К 2 – постоянные коэффициенты,
или степенным законом:
Δ m n (или δn) = Кn τ, (4)
где Кn – стеленная константа скорости окисления; n – показатель степенного закона, причем 1 < n < 2.
Рост тонких пленок на металлах при низких температурах и на первых стадиях окисления металлов при высоких температурах сопровождается большим самоторможением во времени, чем при параболическом законе. Этому, случаю, соответствуют:
логарифмический закон
Δ m (или δ) = К 3lgτ, (5)
или обратный логарифмический закон
1/Δ m (или 1/δ) = К 4lgτ, (6)
При низких температурах диффузия исков через пленку затруднена, в то время как электроны могут проходить через тонкий слой оксида либо благодаря термоионной эмиссии, либо вследствие туннельного эффекта, обусловливающего высокую проводимость оксидной пленки. При этом на поверхности раздела Ме-МеО образуются катионы, а на поверхности раздела оксид-газ – анионы кислорода. Внутри оксидной пленки создается сильное электрическое поле, благодаря которому главным образом ионы и проникают через пленку, скорость роста которой определяется более медленным, т.е. заторможенным процессом.
В реальных процессах окисления металлов часто наблюдаются нарушения приведенных выше соотношений из-за нарушения сплошности пленки, внутренними напряжениями, возникающими при росте пленки или изменении температуры, а также вследствие других причин.
Требования к отчету
Общие требования к отчету изложены на стр. 5.
Используя справочные данные, представленные в приложении 1, проверяют выполнение условия сплошности пленки для образующегося оксида:
 (21)
(21)
где М, А – молекулярная масса оксида и атомная масса металла соответственно; d Ме, d ок – плотность металла и оксида соответственно; m – число атомов металла в молекуле оксида.
На основании полученных экспериментальных данных строят график зависимости удельного измерения массы образца и толщины пленки во времена: Δ m + = Δ М / S = f(τ) и δ = f(τ) (только для метода А). Графическим дифференцированием определяют для какого-либо значения τ истинную скорость окисления, т.е. dm +/ d τ, и сопоставляют ее со средней скоростью (положительным показателем изменения массы Кm +), рассчитанной из выражения:
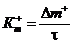 , г/м2·ч (22)
, г/м2·ч (22)
Зная химический состав образующегося оксида, рассчитывают отрицательный показатель изменения массы Кm -:
 г/м2·ч (23)
г/м2·ч (23)
где n ок, n Ме – валентность окислителя (например, кислорода) и металла соответственно; А ок, А Ме – атомная масса окислителя и металла соответственно,
а затем глубинный показатель коррозии П:
 (24)
(24)
Графики зависимостей Δ m + = f(τ) и δ = f(τ) спрямляют в соответствующих координатах, используя одно из возможных уравнений (1-6), и определяют из графиков постоянные коэффициенты найденной эмпирической формулы. Расчет коэффициентов проводится также с помощью персонального компьютера методом наименьших квадратов. Результаты сопоставляются.
При правильной обработке экспериментальных данных (для метода А):
1) изменения массы (Δ m +) и толщины пленки во времени должны описываться уравнением с близкими друг к другу значениями n.
2) изменение массы Δ m +, рассчитанное для какого-либо значения времени c помощью полученной формулы, должно совпадать (в пределах погрешности измерений) с величиной Δ m +, найденной из экспериментальных данных измерения электросопротивления (уравнение 14);
3) при экстраполяции времени на значение τ = 1 год толщина оксидной пленки δ (мм), рассчитанная по полученной эмпирической формуле, должна находиться в соответствии с глубинным показателем коррозии П (мм/год), определяемым из выражения 24.
В выводах указывают, соблюдается ли условие сплошности для образующегося оксида металла или оксидов компонентов сплава; записывают кинетическое уравнение, описывающее закон роста оксидной пленки на металле во времени при заданной температуре, с указанием размерности константы скорости окисления; отмечают результаты проверки правильности обработки экспериментальных данных; формулируют свои представления о механизме окисления металла, контролирующем факторе скорости процесса окисления.
6. Контрольные вопросы
Для допуска к выполнению работы:
1. В чем заключается потенциометрический метод измерения электросопротивления металлов?
2. В каком случае метод измерения электросопротивления может быть использован для изучения окисления металлов и сплавов?
3. Чем определяется защитная способность оксидов металлов и сплавов?
4. Какие факторы могут осложнять процесс образования и роста оксидной пленки?
5. Какое практическое значение имеет знание законов окисления металлов и сплавов?
К защите работы:
1. Какой процесс лимитирует процесс окисления металла в случае образования на нем пористой оксидной пленки?
2. По какому механизму протекает процесс роста защитной оксидной пленки при высоких температурах?
3. Что такое смешанный диффузионно-кинетический контроль процесса окисления?
4. Какие законы роста пленок на металлах описывают окисление металлов при низких температурах? Каков механизм роста пленок?
5. Что показывает константа скорости окисления металлов? Зависит ли эта величина от температуры?
Лабораторная работа 2
Цель работы
Изучить температурную зависимость скорости окисления металлов на воздухе.
Теоретическое введение
Температура оказывает существенное влияние на интенсивность процесса коррозии металлов в газах. С повышением температуры скорость газовой коррозии всегда (за исключением некоторых частных случаев) значительно увеличивается, несмотря на уменьшение ее термодинамической возможности. Для наиболее распространенного процесса газовой коррозии – реакции окисления металла кислородом
 (25)
(25)
термодинамическая возможность может быть определена по изменению энергии Гиббса Δ GT (уравнение изотермы Вант-Гоффа):
 (26)
(26)
где  - стандартное изменение энергии Гиббса (Δ GT при Р O2 = 1,013·105 Па = 1 атм); R = 8,314 Дж/(моль·К) – универсальная газовая постоянная; Т – температура, К; Кр – константа равновесия; (Р О2 )р и Р О2 – парциальное давление кислорода, отвечающее равновесному (упругость диссоциации оксида) и исходному состоянию системы соответственно (для воздуха Р О2 = 0,213·105 Па = 0,21 атм).
- стандартное изменение энергии Гиббса (Δ GT при Р O2 = 1,013·105 Па = 1 атм); R = 8,314 Дж/(моль·К) – универсальная газовая постоянная; Т – температура, К; Кр – константа равновесия; (Р О2 )р и Р О2 – парциальное давление кислорода, отвечающее равновесному (упругость диссоциации оксида) и исходному состоянию системы соответственно (для воздуха Р О2 = 0,213·105 Па = 0,21 атм).
Любой самопроизвольный процесс сопровождается убылью величины Δ GT (Δ GT < 0). Как следует из уравнения 26, окисление возможно при соблюдении условия: Р О2 > (Р О2 )р.
Температурная зависимость скорости окисления металлов обычно выражается экспоненциальным уравнением Аррениуса:
K = K 0exp(- Q / RT) (27)
или
D = D 0exp(- QD / RT), (27’)
где K – константа скорости химической реакции (при кинетическом контроле процесса окисления); D – коэффициент диффузии иона кислорода (или иона металла) или эффективный коэффициент диффузии (при диффузионном контроле); Q и QD – энергия активации химической реакция и диффузии соответственно; K 0 и D 0 имеют смысл константы скорости и коэффициента диффузии при Т → ∞; R = 8,314 Дж/(моль·К) – универсальная газовая постоянная.
Следует однако отметить, что соотношение между скоростью газовой коррозии и температурой может быть нарушено или осложнено при возникновении колебаний температуры, применении попеременного нагрева и охлаждения, вызывающих разрушение оксидных пленок из-за возникновения значительных внутренних напряжений. Кроме того, зависимости (27) и (27’) могут осложняться в том случае, когда металлы образуют два или более оксидов, отвечающих различным температурным интервалам, а также при наличии структурных изменений, происходящих в металле при нагреве (магнитных и аллотропических превращений и др.). При этом температурная зависимость может быть представлена выражением типа:
K = K 01exp(- Q 1/ RT) + K 02exp(- Q 2/ RT) + … (28)
После логарифмирования уравнение (27) (или 27’) преобразуется к виду
ln K = ln K 0 – Q / RT. (29)
Построение гранка в координатах ln K = f(1/ T) дает прямую или в ряде случаев ломаную линию, каждый излом которой соответствует отмеченным ранее изменениям, имеющим место в металле или прилегающей к нему оксидной пленке. Тангенс угла наклона этой прямой (с положительным направлением оси 1/ T), определяемый соотношением
tgα = - Q / R, (30)
дает возможность определить энергию активации процесса, а экстраполяция на бесконечно большую температуру (Т → ∞) – значение K 0 из соотношения
ln K = ln K 0 (при 1/ T = 0 в уравнении 29). (31)
Влияние температуры на скорость окисления металлов может быть определено по изменению каких-либо физических параметров образцов, например, таких как масса, электросопротивление и других, зависящих от количества оксидной фазы на (в) образце, изменения его геометрических размеров (в результате окисления), при испытании в печи при нескольких температурах в течение определенного времени. Однако применение гравиметрического метода и метода измерения электросопротивления имеет ограничения: первый не пригоден в случае образования на образце частично возгоняющихся оксидов (например MoO3 и WO3), второй не применим для сплавов, имеющих различные скорости окисления компонентов, а также для систем, в которых при нагреве могут протекать процессы структурной релаксации.
Требования к отчету
1. Общие требования к отчету изложены на стр. 5.
2. Пользуясь справочными данными (приложение 1), рассчитывают для образующегося оксида или нескольких оксидов (по формуле 21) объемное соотношение, по формуле 26 – Δ GT его образования для каждой из заданных температур и строят график зависимости Δ GT = f(1/ T).
3. На основании опытных данных определяют степень окисления (g) образцов при каждой температуре (уравнение 12) и строят график в координатах lng = f(1/ T); здесь g = Δ R / R 1, Δ R = R 1 – R 0, где R 1, R 0 – электросопротивление образца, измеренное при комнатной температуре до и после испытаний соответственно. Из графика находят постоянные коэффициенты уравнения температурной зависимости скорости газовой коррозии, выраженной в данном случае через степень окисления g:
g = g0exp(- Q / RT). (32)
Обработку данных проводят на персональном компьютере по программе, использующей метод наименьших квадратов.
С помощью уравнений (14, 22-24) проводят расчет удельного прироста массы образцов (Δ m +), положительного и отрицательного показателей изменения массы Кm + и Кm - и глубинного показателя (П) при всех температурах. Затем строят график в координатах ln Кm + = f(1/ T) и определяют (также с помощью персонального компьютера) постоянные коэффициенты в уравнении типа (27).
При правильной обработке экспериментальных данных:
1) значения энергии активации, определенные из температурных зависимостей g и Кm + должны совпадать в пределах погрешности измерений;
2) величины степени окисления, рассчитанные для заданных температур по эмпирической формуле (типа 32) должны быть близки к экспериментально полученным значениям g.
В выводах отмечают, удовлетворяет ли оксид данного металла или оксиды компонентов сплава условию сплошности; делают заключение о влиянии температуры на термодинамическую возможность окисления денного металла кислородом воздуха и скорость газовой коррозии металла или сплава; приводят эмпирические формулы температурной зависимости скорости газовой коррозии и результаты проверки их правильности.
6. Контрольные вопросы
Для допуска к выполнению работы:
1. Каким методом в данной работе проводят изучение влияния температуры на скорость окисления?
2. Какую информацию о защитных свойствах оксидных пленок дает объемное соотношение V ок/ V Ме?
3. В каких случаях метод измерения электросопротивления нельзя применять для изучения процесса окисления металлов?
4. При каком соотношении значений (Р О2 )р и Р О2 возможно окисление металлов?
К защите работы:
1. Каковы причины изменения электрического сопротивления металлов при высокотемпературном окислении?
2. Как изменяется термодинамическая возможность газовой коррозии при повышении температуры?
3. Каким уравнением описывается температурная зависимость скорости окисления металлов?
4. Какие факторы могут оказывать влияние на температурную зависимость скорости окисления металлов?
5. Каков физический смысл постоянных Q и K 0 (или D 0) в уравнении температурной зависимости скорости окисления металлов?
Лабораторная работа 3
Цель работы
Определить жаростойкость металлов и их сплавов с легирующими элементами, повышающими жаростойкость (например, меди и латуней, железа и хромистых сталей и др.), на воздухе при заданной температуре.
Теоретическое введение
Жаростойкость – это способность металла сопротивляться коррозионному воздействию газов при высоких температурах.
В тех случаях, когда в газовой среде при данных температуре и парциальном давлении кислорода или другого окислителя энергия Гиббса системы возрастает или не изменяется, т.е. Δ GT ³ 0, жаростойкость металла обусловлена его термодинамической устойчивостью. Отрицательное значение Δ GT определяет степень реакционной способности металла: чем оно отрицательнее; тем вше химическое сродство металла к окислителю и термодинамическая устойчивость продуктов коррозии.
Жаростойкость металлов в значительной степени зависит от защитных свойств образующихся пленок. При кинетическом контроле процесса газовой коррозии (замедленность химической реакции взаимодействия металла с окислительными компонентами, т.е. в случае образования незащитных пористых пленок, жаростойкость определяется природой металла; при диффузионном контроле процесса (замедленность диффузии ионов металла и окислителя в образовавшейся пленке продуктов коррозии) – свойствами защитной сплошной пленки, т.е. способностью затруднять миграцию реагентов друг к другу, осуществляемую в большинстве случаев путем их диффузии через эту пленку.
Для повышения сопротивления металлов и сплавов высокотемпературному воздействию газов применяют жаростойкое легирование – введение в состав металлов компонентов, улучшающих защитные свойства образующихся оксидных пленок. Существуют три наиболее обоснованные теории жаростойкого легирования, описывающие изменение свойств оксидной пленки в зависимости от механизма воздействия легирующего элемента: теория уменьшения дефектности образующейся окалины; теория образования защитного оксида легирующего элемента; теория образования оксидов типа шпинели. В первом случае ионы легирующего элемента, растворяясь в оксиде основного металла, уменьшают концентрацию дефектов его решетки, что вызывает уменьшение скорости газовой коррозии, контролируемой диффузией ионов. Согласно второй теории, образующийся на поверхности оксид легирующего элемента (например, BeO на бериллиевой бронзе, ZnO на латуни и др.) должен затруднять диффузию реагентов и уменьшать скорость окисления основного металла. Третья теория основана на представлении об образовании шпинелей Me’Me”2O4 (FeCr2O4 на хромистых сталях, FeCr2O4, NiFe2O4, NiCr2O4 на хромоникелевых сталях, NiCr2O4 на нихроме), в состав которых входят как основной, так и легирующий компоненты. Высокие защитные свойства этих оксидов связывают с низкой скоростью диффузии ионов вследствие высокой плотности упаковки этих структур, защитные свойства которых тем выше, чем меньше параметр решетки. Перечисленные теории выдвигают ряд условий к выбору легирующих элементов: необходимость большего сродства к кислороду, чем у основного металла; соблюдение условия сплошности у оксида легирующего металла; определенное соотношение валентностей ионов основного и легирующего компонентов и другие. Каждое из этих требований является необходимым, но недостаточным для повышений жаростойкости металлов, взятые же в совокупности они составляют основу для рационального выбора легирующих элементов.
Необходимая степень жаростойкости металла или сплава установлена стандартами или техническими условиями на соответствующие изделия и детали, изготовленные из них и предназначенные для эксплуатации в соответствующих условиях.
Требования к отчету
На основе опытных данных рассчитывают с помощью уравнения (22) положительный показатель изменения массы Km + для каждого исследуемого образца. Если известен химический состав образующейся окалины, то по формулам (23) и (24) рассчитывают значения отрицательного показателя изменения массы Km - и глубинного показателя коррозии П. Пользуясь справочными данными (приложение 1), вычисляют для оксида металла и оксидов компонентов сплава объемное отношение (формула 21), а из выражения (26) рассчитывают Δ GT их образования.
Используя экспериментальные результаты, строят график зависимости Km + = f(C Me), спрямляют его, находят (при помощи персонального компьютера с использованием программы, использующей в расчетах метод наименьших квадратов) постоянные коэффициенты эмпирической зависимости Km + = f(C Me) и оценивают их правильность: рассчитывают по формуле положительный показатель изменения массы для каждого из исследуемых образцов и сравнивают его с опытными данными.
В выводах отмечают, удовлетворяют ли оксид данного металла или оксиды компонентов сплава условию сплошности, делают заключение о термодинамической устойчивости и жаростойкости металла и влиянии на него данного легирующего элемента.
6. Контрольные вопросы
Для допуска к выполнению работы:
1. Что такое жаростойкость металлов?
2. Чем ограничено применение гравиметрического метода для изучения жаростойкости металлов?
3. С какой целью проводят испытания на жаростойкость образцов с различной концентрацией легирующих компонентов?
4. Какие пленки принято называть защитными?
5. Чем отличается химическое сродство металла к окислителю и термодинамическая устойчивость продуктов коррозии?
К защите работы:
1. На основе каких теорий проводят выбор легирующих компонентов для повышения жаростойкости металлов?
2. Какие оксиды называют шпинелями? В чем причина их повышенной защитной способности?
3. Какие требования предъявляются теориями жаростойкого легирования к легирующим компонентам?
Лабораторная работа 4
Цель работы
Определить значения и природу электродных потенциалов некоторых металлов в различных электролитах.
Теоретическое введение
При погружении металлов в электролит в результате взаимодействия поверхности металла с раствором между ними возникает разность электрических потенциалов, которую называют электродным потенциалом. Если во взаимодействии металла и электролита участвуют только ионы металла, то протекают следующие процессы:
а) переход ионов из металла в раствор с образованием гидратированных ионов (анодный процесс):
Me + mH2O = Men+·mH2O + ne; (33)
б) разряд ионов из раствора на поверхности металла (катодный процесс):
Men+·mH2O + ne = Me + mH2O. (34)
В зависимости от соотношения уровней потенциальной энергии катионов в узлах кристаллической решетки металла и в растворе вначале возможно преобладание процесса (33) или (34). При протекании этих реакций энергетические уровни катионов в металле и в растворе сближаются и становятся одинаковыми – наступает динамическое равновесие. При достижении равновесия (равенство скоростей анодного и катодного процессов) устанавливается постоянное значение потенциала металла. При равенстве скоростей анодного (33) и катодного (34) процессов масса металла не изменяется во времени (Δ m = 0).
Электродные потенциалы металлов, находящихся в равновесии с собственными ионами в растворе, называют обратимыми или равновесными. Они подчиняются уравнению Нернста:
 (35)
(35)
где (E Ме)обр – обратимый электродный потенциал металла, В; (E Ме)обр0 – стандартный электродный потенциал металла: обратимый потенциал металла при активности его ионов в растворе, равной единице; R = 8,31 Дж/(моль·К) – газовая постоянная; Т – абсолютная температура, К; n – валентности ионов металла, переходящих в раствор; F = 96500 Кл/моль – постоянная Фарадея; a Men+ - активность ионов металла в растворе:

где m – моляльность, т.е. концентрация электролита, моль/1000 г H2O; n + - количество катионов (конов металла), образующихся при диссоциаций молекулы растворенной соли металла; g± - средний коэффициент активности электролита данной моляльности.
В настоящее время нет достаточно надежных методов экспериментального определения или теоретического вычисления абсолютных значений электродных потенциалов, поэтому их определяют по отношению к стандартному водородному электроду, потенциал которого при всех температурах условно принят равным нулю. Часто при измерении электродных потенциалов металлов вместо водородного электрода (н.в.э.) применят хлорсеребряный (х.с.э.), а затем пересчитывают полученные значения на водородную шкалу. Для этого к измеряемым значениям потенциала металла (Е изм) прибавляют значения потенциала хлорсеребряного электрода (Е Ag/AgCl):
Е Ме = Е изм + Е Ag/AgCl,
где Е Ag/AgCl = 0,2224 – 6,4·10-4(t - 25), В; t – температура, °С.
Потенциалы электродов, у которых в процессе взаимодействия металла и электролита участвуют не только собственные, но и другие ионы и атомы, являются необратимыми или неравновесными электродными потенциалами металлов. Они не подчиняются термодинамическое уравнению (35); следовательно, их нельзя рассчитывать, а можно определить только опытным путем.
Устойчивое значение необратимого электродного потенциала металла, устанавливающееся при равенстве сумм скоростей анодных и катодных процессов, называется стационарным необратимым электродным потенциалом металла. Величина его зависит от природы металла, состояния его поверхности, природы и концентрации электролита и от физических условий (температуры, давления и др.).
Следует отметить, что потенциалы, установившиеся на поляризованном внешним током металлическом электроде, также являются необратимыми, так как даже при осуществлении анодного и катодного процессов ионами металла нарушается условие равновесия – равенство скоростей анодного и катодного процессов.
Для решения вопроса, является ля электродный потенциал металла в данном растворе обратимым или необратимым, следует сопоставить теоретическое, рассчитанное по уравнению (35) и опытное значения потенциала и сравнить зависимости потенциала металла от активности собственных ионов в растворе, полученные теоретически и опытным путем.
Определения показали, что ряд металлов (Ag, Cu, Cd и др.) в широком диапазоне концентраций собственных ионов имеет обратимые значения потенциалов, однако при очень низких концентрациях собственных ионов значения потенциалов перестают удовлетворять уравнению (35). Это объясняется участием в катодном процессе водородного иона воды:
H+·H2O + e = 1/2H2 + H2O (36)
или растворенного кислорода воздуха:
O2 + 2H2O + 4e = 4



 (21)
(21)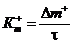 , г/м2·ч (22)
, г/м2·ч (22) г/м2·ч (23)
г/м2·ч (23) (24)
(24) (25)
(25) (26)
(26) - стандартное изменение энергии Гиббса (Δ GT при Р O2 = 1,013·105 Па = 1 атм); R = 8,314 Дж/(моль·К) – универсальная газовая постоянная; Т – температура, К; Кр – константа равновесия; (Р О2 )р и Р О2 – парциальное давление кислорода, отвечающее равновесному (упругость диссоциации оксида) и исходному состоянию системы соответственно (для воздуха Р О2 = 0,213·105 Па = 0,21 атм).
- стандартное изменение энергии Гиббса (Δ GT при Р O2 = 1,013·105 Па = 1 атм); R = 8,314 Дж/(моль·К) – универсальная газовая постоянная; Т – температура, К; Кр – константа равновесия; (Р О2 )р и Р О2 – парциальное давление кислорода, отвечающее равновесному (упругость диссоциации оксида) и исходному состоянию системы соответственно (для воздуха Р О2 = 0,213·105 Па = 0,21 атм). (35)
(35)


