

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...
Топ:
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Под лекарственной резистентностью понимают устойчивость ВИЧ к АРВпрепаратам.
Причинами формирования резистентности являются: 1) высокая генетическая вариабельность популяции ВИЧ и относительная подвижность этих вариантов в присутствии одного или более АРВ препаратов и 2) присутствие АРВ препаратов в субоптимальной концентрации, создающей селективное давление. Лекарственная резистентность формируется только при сочетании двух этих факторов (репликации вируса при наличии субоптимального лекарственного пресса), что обычно наблюдается в условиях некачественного проведения АРТ при низкой приверженности пациента к лечению.
Резистентность подразделяют на первичную, которая определяется у АРТ-наивных пациентов (т.е. вирус имеет резистентность уже к моменту инфицирования человека), и вторичную, которая развивается в процессе применения АРТ у данного конкретного пациента. Частота первичной резистентности зависит от интенсивности предшествующего применения АРТ в отдельном регионе, в развитых странах в среднем составляя 10-20%. Частота первичной резистентности более 5% считается высокой.
Главная причина формирования резистентности ВИЧ к АРВ препаратам в процессе АРТ – это неадекватная приверженность пациента к лечению.
Клиническими последствиями развития резистентности в процессе АРТ являются констатация вирусологической неэффективности текущей схемы АРТ, появление ограничений в последующем выборе препаратов и возможность передачи резистентных штаммов в популяции.
Развитие резистентности в процессе АРТ зависит от генетического барьера препаратов (числа мутаций, необходимых для развития резистентности) и коэффициента ингибирования ВИЧ препаратами (показателя, отражающего насколько легко при снижении концентрации препарата происходит вхождение в зону селективного давления, где развиваются мутации резистентности). Число мутаций, необходимых для развития резистентности, составляет: для всех ННИОТ и 3TC – единичная мутация (быстрое развитие резистентности), для большинства НИОТ и некоторых ИП – 2-4 мутации (среднее развитие), для многих ИП (LPV/r, ATV, DRV) – 5 и более мутаций (медленное развитие). Низкий генетический барьер имеют препараты ННИОТ, высокий – ИП, очень высокий – бустированные ритонавиром ИП.
|
|
Стартовая схема АРТ должна иметь максимальную эффективность, в том числе и с позиций возможного развития резистентности.
При отмене АРВ препарата, к которому развилась резистентность, мутантный штамм ВИЧ перестает быть доминантным, поэтому при лабораторном исследовании может перестать определяться. Но это наблюдаемое «восстановление чувствительности к препарату» является весьма относительным, поскольку при возобновлении приема данного препарата сохраняющиеся в департментах мутантные штаммы могут получить конкурентное преимущество и снова перейти в доминантное состояние. Вероятно поэтому повторное назначение того же АРВ препарата значительно менее эффективно, чем первое назначение.
Тесты для лабораторной диагностики при ВИЧ-инфекции
К тестам для лабораторной диагностики при ВИЧ-инфекции можно отнести:
1) тесты для постановки диагноза ВИЧ-инфекции:
§ скрининговые для определения антител к ВИЧ (антител и антигенов ВИЧ): иммуноферментный анализ (ИФА), быстрые тесты;
§ подтверждающие для определения антител к ВИЧ: иммунный блотинг (ИБ);
§ методы амплификации нуклеиновых кислот ВИЧ: качественная ПЦР (ДНК-ПЦР) в культуре лимфоцитов крови;
2) тесты для слежения за течением ВИЧ-инфекции:
§ методы амплификации нуклеиновых кислот ВИЧ: количественная ПЦР (РНК-ПЦР, вирусная нагрузка) в плазме;
|
|
§ определение иммунного статуса: CD4 лимфоциты в плазме крови;
3) тесты для определения лекарственной резистентности.
Выделение культуры вируса в клинической практике практически не используется (применяется обычно в исследовательских целях), поэтому в данную классификацию данный метод не включен.
Ниже будут более подробно рассмотрены указанные тесты для лабораторной диагностики при ВИЧ-инфекции, а затем – их клиническое применение.
Лабораторные тесты
Иммуноферментный анализ
Иммуноферментный анализ (ИФА, англ. – EIA или ELISA) подразумевает определение суммарных антител и/или антигенов ВИЧ в биологических жидкостях.
Биологические жидкости, в которых можно определять антитела к ВИЧ:
§ сыворотка крови, полученная путем центрифугирования цельной крови, – наиболее распространено определение антител именно в сыворотке крови;
§ цельная капиллярная кровь, взятая из пальца;
§ транссудат слизистой полости рта, собранный с помощью специальной пластинки (тесты OraSure, Oral Fluid, OMT-EIA);
§ моча (быстрый тест Calypte HIV-1 Test для постановки врачом);
§ вагинальные выделения (быстрый тест Wellcozyme для определения IgG у жертв изнасилования).
Принцип метода ИФА-диагностики представлен на рис. 3.
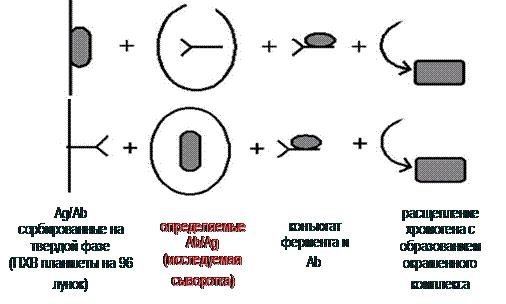
Рис. 3. Принцип постановки иммуноферментного анализа (ИФА)
Существуют несколько поколений тестов для ИФА (табл. 1). Тесты всех поколений выявляют общие (суммарные) антитела к ВИЧ, а тесты 4 поколения – еще и р24 антиген ВИЧ («комбинированный тест»).
Таблица 1 – Характеристика тестов для ИФА различных поколений
| поколение тестов | определение Ab | определение Ag |
| первое | основаны на нативном вирусе | нет |
| второе | основаны на рекомбинантных белках или синтетических пептидах | нет |
| третье | в качестве конъюгата меченные белки ВИЧ | нет |
| четвертое | в качестве конъюгата меченные белки ВИЧ | определяют р24 антиген |
В Беларуси в последнее время применяются ИФА тесты 3 и 4 поколений. Они обладают высокой чувствительностью – приближающейся к 100% (то есть вероятность получения ложноотрицательного результата практически исключается) и чуть более низкой специфичностью – около 98-99% (то есть у небольшой части обследованных, до 2%, результат будет ложноположительным). Поэтому ИФА считается не диагностическим, а скрининговым тестом, и при получении положительного результата ИФА-теста следует провести подтверждающий тест (иммуноблотинг).
|
|
ИФА тесты 4 поколения позволяют выявить кровь ВИЧ-позитивного человека уже вскоре после появления виремии, включая большую часть периода «серологического окна», когда антитела еще не наработаны, но в крови уже имеется р24 антиген (рис. 4). Поэтому в Беларуси ИФА тесты 4 поколения используются при тестировании донорской крови.

Рис. 4. Возможности различных тестов в раннем выявлении ВИЧ-инфекции [цит. по Р.Торстенссону, Шведский институт по контролю за инфекционными заболеваниями, 2005]
Определение р24 антигена ранее (до появления ДНК ПЦР) применяли также для диагностики ВИЧ-инфекции у детей, рожденных ВИЧ-позитивными матерями, поскольку у таких детей в первые месяцы жизни (до 18 месяцев) могут циркулировать как собственные, так и материнские антитела, следовательно, определение антител не имеет большой информативности. Также определение р24 антигена использовали в качестве экономичного способа определения вирусной нагрузки в условиях ограниченных ресурсов.
Иммуноблотинг
Иммуноблотинг (ИБ, англ. – western blot, WB) подразумевает определение антител к отдельным белкам ВИЧ в биологических жидкостях.
По своей сути метод ИБ схож с ИФА. Отличие состоит в том, что сыворотку пациента добавляют не в лунку с адсорбированным «общим» антигеном ВИЧ, а вносят на панель с отдельными вирусными белками, которые предварительно были электрофоретически «разогнаны» на отдельные фракции сообразно их молекулярной массе. То есть в результате постановки ИБ мы получаем заключение о наличии в образце не общих антител к ВИЧ, а антител к отдельным белкам ВИЧ-1, в том числе к белкам сердцевины вируса (p17, p24, p55), гликопротеинам оболочки (gp41, gp120, gp160) и ферментам (p31, p51, p66).
Принцип метода ИБ представлен на рис. 5.

| 1. Электрофоретическое разделение белков ВИЧ-1 (стандартный реагент) по их молекулярной массе 2. Инкубация с добавлением исследуемой сыворотки – специфическое соединение белков ВИЧ с соответствующими отдельными антителами к ВИЧ из добавленной сыворотки 3. Инкубация с добавлением меченных ферментом антител к человеческим Ig 4. Детекция окрашенных полос |
|
|
Рис. 5. Принцип постановки иммуноблотинга (ИБ) [цит. по Э. Фаучи, К. Лэйн, 2003]
Критериями положительного результата ИБ являются:
§ по ВОЗ: сочетание 2 полос, соответствующих gp41 и gp120/gp160;
§ по CDC/APHL: сочетание 2 полос, соответствующих любым 2 из 3 антигенов ВИЧ – p24, gp41, gp120/gp160.
Критерием отрицательного ИБ является отсутствие полос.
Критерием неопределенного ИБ является наличие любых полос, сочетание которых не удовлетворяет критериям положительного результата.
Трактовку результатов ИБ осуществляет врач-лаборант, который выдает клиницисту заключение «ИБ положительный» или «ИБ отрицательный». Примеры интерпретации результатов ИБ приведены на рис. 6.

| 1. Положительный ИБ к ВИЧ-1 2. Отрицательный ИБ (у здорового человека, иммунизированного белками внешней оболочки ВИЧ-1) 3. Сомнительный ИБ (у инфицированного ВИЧ-2) 4. Сомнительный ИБ (наличие антител, перекрестно реагирующих с p24 Ag) 5. Отрицательный ИБ |
Рис. 6. Трактовка результатов иммуноблотинга (ИБ) [цит. по Э. Фаучи, К. Лэйн, 2003]
Тесты для ИБ более дороги, чем для ИФА, но обладают значительно более высокой специфичностью. Поэтому ИБ не применяется для скрининга, а является подтверждающим тестом при получении положительного результата в ИФА. При проведении обследования пациента, от момента заражения которого прошло >3 месяцев, по стандартной методике с двукратным тестированием в ИФА и подтверждением в ИБ чувствительность составляет 99,5% (95%CI 98-99,9%), а специфичность – 99,994%.
Ложноотрицательные результаты определения антител к ВИЧ в ИФА/ИБ у некоторых пациентов (около 0,3% в популяциях с высокой распространенностью ВИЧ-инфекции и <0,001% в популяциях с низкой распространенностью) обусловлены возможностью затягивания периода «серологического окна» до 6 месяцев, появления серореверсии на поздних стадиях ВИЧ-инфекции или у длительно получающих АРТ пациентов, идиопатической «атипичной иммунной реакцией», агаммаглобулинемией, инфицированием штаммом ВИЧ-2 или ВИЧ-1 О- или N- групп, а также возможностью технической или канцелярской ошибки.
Ложноположительные результаты определения антител к ВИЧ в ИФА/ИБ являются казуистикой (частота встречаемости 0,0004-0,0007%) и могут быть обусловлены появлением аутоантител, обнаружением поствакцинальных антител (у пациентов, участвующих в клинических испытаниях вакцин против ВИЧ), а также возможностью технической или канцелярской ошибки. Ложноположительный результат можно заподозрить, если у пациента отсутствуют факторы риска инфицирования ВИЧ, не определяется вирусная нагрузка и показатели количества CD4 лимфоцитов в пределах нормы. В этом случае серологическое обследование следует провести повторно.
|
|
Кроме всего прочего, пациенты могут сообщать врачу ложные сведения о якобы отрицательных результатах теста на ВИЧ (что наблюдается достаточно часто при фиксировании пациента на «стадии отрицания» нормальной реакции принятия диагноза) или о якобы положительных результатах теста (пациенты с синдромом Мюнхгаузена).
Неопределенные результаты ИБ получают достаточно часто – в 4-20% случаев. Неопределенный результат ИБ может быть обусловлен обследованием во время сероконверсии (обычно первыми появляются антитела к р24, затем – другие) или на поздних стадиях ВИЧ-инфекции (когда обычно исчезают антитела к белкам сердцевины), при наличии перекрестно реагирующих неспецифических антител (при коллагенозах, васкулитах, других аутоиммунных заболеваниях, лимфомах, заболеваниях печени, инъекционном потреблении наркотиков, рассеянном склерозе, во время беременности и после недавней иммунизации), при инфицировании штаммом ВИЧ-2 или ВИЧ-1 О- или N- групп, при обнаружении поствакцинальных антител (у пациентов, участвующих в клинических испытаниях вакцин против ВИЧ), а также возможностью технической или канцелярской ошибки.
При получении неопределенного результата ИБ рекомендуется оценить риск инфицирования ВИЧ у данного пациента, провести повторное серологическое тестирование (у не имеющих риска инфицирования пациентов – через 3 месяца, у имеющих риск инфицирования пациентов – через 1, 2 и 6 месяцев) и предложить пациенту принимать меры по профилактике передачи вируса вплоть до подтверждения его отсутствия. В спорных случаях возможно тестирование на наличие ДНК ВИЧ в качественной ПЦР (см. ниже).
Быстрые тесты
Быстрые тесты (или экспресс тесты) позволяют выявлять антитела к ВИЧ быстро (за 10-30 минут) и без использования специальной лабораторной техники.
Быстрые тесты выявляют антитела к ВИЧ, методики их постановки разнятся.
В табл. 2 приведена информация об экспресс-тестах на ВИЧ, на рис. 7 – пример использования наиболее распространенного теста OraQuick.
Таблица 2 – Экспресс-тесты на ВИЧ, одобренные FDA [цит. по Дж. Бартлетту, 2006]
| тест | производитель | образец | требования к лаборатории (CILA) | чувствительность, % | специфичность, % | что определяет | время постановки |
| OraQuick | OraSure Technologies | Кровь * Плазма Транссудат слизистой ротовой полости | Простые (не требуют сертификации) ** | 99,6 99,6 99,6 | 99,8 99,8 99,7 | ВИЧ-1 и 2 | 20 мин 20-40 мин |
| UniGold Recombigen | Trinity Biotech | Кровь * Плазма Сыворотка | Простые (не требуют сертификации) ** | 99,7 99,8 99,8 | ВИЧ-1 | 10 мин | |
| Reveal G2 | MedMira Inc. | Плазма Сыворотка | Средней сложности | 99,8 99,8 | 99,1 98,6 | ВИЧ-1 | 5 мин |
| Multispot HIV-1/HIV-2 HIV-2 | Bio-Rad Labs | Сыворотка Сыворотка | Средней сложности | 99,9 | Различает ВИЧ-1 и ВИЧ-2 | 15 мин |
* при исследовании образца крови не требуется проводить центрифугирование или использовать другое лабораторное оборудование
** не требуется наличия специального образования у медицинского персонала, контроля качества проведения тестов и профессионального уровня персонала, могут проводиться в лабораториях, клиниках, машинах медслужб, кабинетах врачей и т. п.

| Тестполоска OraQuick® методика использования: § специальным скарификатором взять из пальца каплю цельной капиллярной крови, § перенести во флакон c буфером и перемешать, § через 20 минут в окошке можно считывать результат. |
Рис. 7. Принцип постановки быстрого теста OraQuick [цит. по A.M. Khalsa, Pacific AIDS Education and Training Center KECK School of Medicine, 2003]
Чувствительность и специфичность быстрых тестов составляют 99-100%, то есть эти показатели сопоставимы с получаемыми в ИФА. Отрицательный результат тестирования свидетельствует об отсутствии антител к ВИЧ и не нуждается в подтверждении другими тестами. При положительном результате быстрого теста диагноз ВИЧ-инфекции должен быть обязательно подтвержден по стандартной методике (с использованием ИФА и ИБ). При получении неопределенного результата тестирование следует провести повторно через месяц.
Быстрые тесты применяют:
§ для экстренного уточнения ВИЧ-статуса в медучреждениях (обследование беременных, поступивших рожать с неизвестным ВИЧ-статусом, и обследование биоматериала при профессиональных контактах);
§ для обследования пациентов, которые с малой вероятностью придут за результатами тестирования, в том числе посетителей венерологических клиник и пациентов, которым оказывается неотложная помощь;
§ для домашнего использования (неоднозначное отношение в мире).
Методикой постановки быстрого теста должен владеть любой медработник, оказывающий экстренную помощь, работающий с беременными или вступающий в контакт с кровью пациента – например, акушер дежурной бригады или врач приемного покоя.
В комплект теста для домашнего использования входит информационный буклет для пациентов, где разъяснена техника постановки теста.
Полимеразная цепная реакция
Полимеразная цепная реакция (ПЦР, англ. – PCR) подразумевает определение нуклеиновых кислот (РНК или ДНК) ВИЧ в биологических жидкостях.
Принцип метода ПЦР-диагностики представлен на рис. 8.
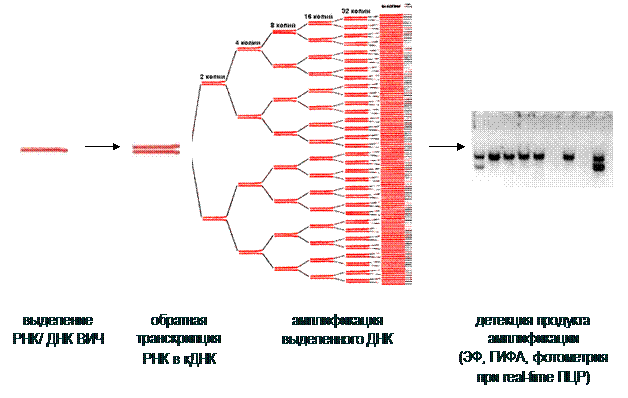
Рис. 8. Принцип постановки полимеразной цепной реакции (ПЦР)
При ВИЧ-инфекции используются два варианта ПЦР: качественная и количественная, или вирусная нагрузка (табл.3).
Таблица 3 – Характеристики качественной и количественной ПЦР, используемых для диагностики ВИЧ
| что определяет | материал для исследования | клиническое использование | |
| качественная | «ДНК-ПЦР»: наличие ДНК ВИЧ, интегрированного в геном клетки-мишени (лимфоцита) – резервуара инфекции | культура лимфоцитов крови | - определение ВИЧ-статуса в случаях, когда использование для этих целей ИФА/ИБ некорректно |
| количественная (вирусная нагрузка) | «РНК-ПЦР»: наличие РНК свободных вирионов ВИЧ, находящихся в плазме | плазма крови | - прогнозирование течения ВИЧ-инфекции у пациентов без терапии; - контроль эффективности АРТ (стартовая VL и в динамике); - выбор тактики ведения ВИЧ-позитивных беременных |
Качественная ПЦР проводится с целью определения ДНК ВИЧ в лимфоцитах крови для установления ВИЧ-статуса пациента.
Порог чувствительности выявления ДНК ВИЧ методом качественной ПЦР составляет около 5 копий на 106 клеток. Метод тем не менее считается несколько менее точным для диагностики ВИЧ-инфекции, чем ИФА/ИБ, и используется в следующих случаях:
1) когда использование ИФА/ИБ для установления ВИЧ-статуса некорректно:
§ у ВИЧ-экспонированных детей (если у ребенка первых 18 месяцев жизни выявляются антитела к ВИЧ, то неясно чьи они – собственные или материнские);
§ в период «серологического окна» (т.е. когда у инфицированного ВИЧ пациента антитела еще отсутствуют или субопределяемы – см. рис. 4): после профессиональных контактов, при наличии клиники острого ретровирусного синдрома, при тестировании донорской крови (исследование пулированных образцов);
2) для уточнения неопределенных результатов тестирования в ИФА/ИБ.
Для постановки качественной ПЦР с целью установления ВИЧ-статуса ребенка, рожденного ВИЧ-позитивной матерью, не используют пуповинную кровь, так как она может содержать материнскую кровь, а исследуют только кровь ребенка.
Положительный результат ПЦР-определения ДНК ВИЧ в первые 48 часов жизни ребенка позволяет предположить внутриутробное заражение. Вероятность обнаружения ДНК ВИЧ в первые 48 часов жизни ребенка составляет всего 17-38%. Если на первой неделе жизни ПЦР-определение ДНК ВИЧ дает отрицательный результат, а впоследствии – положительный, то считается, что заражение ребенка произошло во время родов. К возрасту 1 месяца ДНК ВИЧ обнаруживается практически у всех инфицированных детей: чувствительность составляет 98%, а специфичность – 99%.
Для постановки диагноза ВИЧ-инфекции ребенку, рожденному ВИЧ-позитивной матерью, обычно проводится двукратное ПЦР-исследование с интервалом 2-3 месяца. Получение отрицательного результата свидетельствует об отсутствии ВИЧ-инфекции, но требует подтверждения путем параллельного получения отрицательного результата в ИФА/ ИБ.
Вирусная нагрузка (ВН, англ. – VL), или количественная ПЦР, проводится с целью определения количества вирусов (РНК ВИЧ) в плазме крови пациента.
Определение вирусной нагрузки имеет значение для:
§ прогноза течения ВИЧ-инфекции (вирусная нагрузка позволяет предсказать скорость снижения количества CD4 лимфоцитов);
§ контроля эффективности проводимой АРТ в динамике (вирусологическая эффективность), вирусная нагрузка – самый важный тест для оценки эффективности терапии;
§ прогноза вероятности передачи ВИЧ (она выше при высокой вирусной нагрузке) как при профессиональных и половых контактах, так и при передаче ВИЧ от матери ребенку, и, соответственно, для выбора схемы медикаментозной постконтактной профилактики и выбора тактики ведения ВИЧ-позитивных беременных;
§ для постановки предварительного диагноза ВИЧ-инфекции пациенту, имеющему симптомы острой ВИЧ-инфекции (диагноз можно предполагать только при обнаружении высокой вирусной нагрузки – выше 100 тысяч копий/мл, и в последующем диагноз следует подтвердить стандартными методами – ИФА/ИБ).
Характеристика используемых для измерения уровня вирусной нагрузки тест-систем представлена в табл. 4.
Таблица 4 – Тест-системы для измерения уровня вирусной нагрузки, одобренные FDA [цит. по Дж. Бартлетту, 2006]
| Торговое название | Amplicor HIV Monitor 1.5 | Versant HIV-1 RNA3.0 | NucliSens HIV-1 QT |
| Производитель | Roche | Bayer | bioMerieux |
| Техника | ОТ-ПЦР | рДНК | NASBA |
| Сравнение результатов | Результаты, получаемые методом ОТ-ПЦР, сравнимы с результатами, получаемыми методом рДНК (Versant) с использованием тест-систем 2.0 и 3.0 | Результаты, получаемые методом рДНК, сравнимы с результатами, получаемыми методом ОТ-ПЦР (Amplicor) | Результаты, по-видимому, сравнимы с результатами, получаемыми методами ОТ-ПЦР и рДНК, но пока не получено достаточно данных |
| Преимущества / недостатки | • Меньше ложноположительных результатов у ВИЧ-отрицательных пациентов по сравнению с тест-системами фирмы Bayer. | • Занимает меньше времени. • Хороший динамический диапазон, но выше порог неопределяемой вирусной нагрузки. | • Может применяться для обнаружения вируса в тканях и биологических жидкостях, например, выделениях половых путей. • Самый большой динамический диапазон. |
| Динамический диапазон | • Стандартный: (Amplicor 1.5) 400-750 000 копий/мл • Суперчувствительный: (Ultra-Direct 1.5) 50-100 000 копий/мл | рДНК 3.0: 75-500 000 копий/мл* | Количественный тест на ВИЧ-1 NucliSens: 176-3 500 000 копий/мл; динамический диапазон зависит от объема |
| Подтип вируса | Тест-система 1.5: от А до G | от А до G | от А до G |
| Необходимый объем материала для исследования | • Amplicor: 0,2 мл • Суперчувствительный: 0,5 мл | 1 мл | От 10 мкл до 2 мл |
| Пробирки | ЭДТА (пробирка с сиреневой крышкой) | ЭДТА (пробирка с сиреневой крышкой) | ЭДТА, гепарин, цельная кровь, любая биологическая жидкость, МКПК, семенная жидкость, ткани и т. д. |
| Требования | Отделить плазму не позже чем через 6 часов после забора крови, перед транспортировкой заморозить при температуре -20°С или -70°С. | Отделить плазму не позже чем через 4 часа после забора крови, перед транспортировкой заморозить при температуре -20°С или -70°С. | Отделить сыворотку или плазму не позже чем через 4 часа после забора крови, перед транспортировкой заморозить при температуре -20°С или -70°С. |
* нижний порог измерений, установленный FDA, равен 50 копий/мл
Используемые для определения вирусной нагрузки тесты обычно определяют наличие РНК ВИЧ-1 субтипов В или А-G (группа М). Тесты недостаточно точны для выявления ВИЧ-1 групп N или О, а также ВИЧ-2.
Вирусная нагрузка определяется обычно в плазме крови, но некоторыми тестами ее можно определять и в других биологических жидкостях, например, в семенной жидкости, вагинальных выделениях, спинномозговой жидкости, грудном молоке, слюне.
Диапазон определяемых значений вирусной нагрузки различен для разных тест-систем. Минимальный порог определения для используемых в настоящее время в Беларуси тестов составляет 1 500 копий/мл, то есть термин «неопределяемая вирусная нагрузка» не означает отсутствия вируса в крови, а говорит о том, что его количество составляет менее порога определения для данной тест-системы (в нашем случае < 1 500 копий/мл).
Чувствительность теста составляет около 100% при острой ВИЧ-инфекции; специфичность в среднем 97%, но при вирусной нагрузке >10 000 копий/мл приближается к 100%.
Специфичность теста составляет 91-98%, поэтому тест не используется для диагностики ВИЧ-инфекции. Ложноположительные результаты у неинфицированных пациентов регистрируются в 2-9%, обычно показывая низкую концентрацию вируса (<10 000 копий/мл). Диагноз ВИЧ-инфекции, выставленный при обнаружении РНК ВИЧ в крови, должен быть подтвержден стандартными тестами – постановкой качественной ПЦР (определение ДНК ВИЧ) или постановкой ИБ (с повтором ИБ спустя 2-4 месяца после начального сомнительного или отрицательного теста).
Приведенная в табл. 5 градация уровней вирусной нагрузки является в определенной степени условной, но позволяет выделять порог возможного старта прогрессирования ВИЧ-инфекции, при регистрации которого требуется дополнительная оценка клинического статуса и количества CD4 лимфоцитов для решения вопроса о начале АРТ. Вирусная нагрузка в пределах до 5 тысяч копий/мл говорит о низком риске прогрессирования ВИЧ, порог возможного старта прогрессирования составляет > 55 тысяч копий/мл для подростков и взрослых и > 100 тысяч копий/мл (или даже более высокие значения) для детей.
Таблица 5 – Условная градация уровней вирусной нагрузки
| градация уровней | VL, копий/мл (методом RT-PCR) |
| порог определения | < 50 * < 1 500 ** |
| очень низкий уровень | 1 500 - 7 тысяч |
| низкий уровень | 7 - 20 тысяч |
| умеренный уровень | 20 - 55 тысяч |
| порог возможного старта прогрессирования ВИЧ-инфекции | > 55 тысяч у подростков и взрослых > 100 тысяч у детей |
| высокая вирусная нагрузка | > 80 - 100 тысяч |
* порог определения, достигаемый при использовании некоторых тест-систем и принятый в клинических рекомендациях по оценке эффективности АРТ
** порог определения для используемых в настоящее время в Беларуси тест-систем
Вирусная нагрузка у мужчин на фоне сохранного иммунитета может быть несколько выше, чем у женщин (до 2 раз), но при снижении количества CD4 лимфоцитов (<300 клеток/мкл) эти различия исчезают. Поэтому при оценке уровня вирусной нагрузки при принятии лечения о начале АРТ пол пациента не учитывают.
Клиническая трактовка результатов определения вирусной нагрузки сложна, так как:
§ возможны естественные колебания VL в условиях полного благополучия;
§ транзиторное повышение уровня VL могут вызвать появление острого эпизода оппортунистической инфекции или вакцинация;
§ определяемый уровень вирусной нагрузки в крови может не отражать уровень вирусной нагрузки в других тканях (например, в эпителии и выделениях из половых путей, в лимфатических узлах, в ЦНС, в ЖКТ).
Поэтому при трактовке результатов определения вирусной нагрузки следует учитывать следующее:
§ забор крови на VL следует проводить не ранее чем через 2-4 недели после исчезновения симптомов острой инфекции (если невозможно – то все заборы проводить в примерно схожем клиническом состоянии пациента) или вакцинации;
§ исследование крови следует проводить всегда одним и тем же методом в одной и той же лаборатории;
§ значимыми колебаниями VL следует считать колебания более чем в 2-3 раза (поскольку 95%CI для результатов теста составляет 0,3-0,5 lg) – например, повышение с 20 тысяч до более чем 40-60 тысяч копий/мл; при сомнениях, выросла ли VL или осталась на прежнем уровне, следует повторить анализ;
§ результаты определения VL должны заново перепроверяться перед стартом или изменением АРТ.
Существуют особенности вирусной нагрузки у детей:
§ в целом дети имеют более высокие уровни VL, высокой считается VL > 100 тысяч копий/мл;
§ при перинатальной ВИЧ-инфекции: при рождении VL обычно не определяется или низкая (до 10 тысяч копий/мл), ко 2 месяцу жизни достигает высоких значений (более 100 тысяч копий/мл), а затем в течение нескольких лет медленно снижается (в течение первых 2 лет в среднем на 0,6 lg в год, в течение следующих 4-5 лет – на 0,3 lg в год).
На основании уровня вирусной нагрузки нельзя судить о степени повреждения функции иммунной системы и о чувствительности вируса к АРВ препаратам.
|
|
|

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!