Критерии равновесия могут быть выражены через интенсивные величины T,P,μ для изолированной системы.
Пусть система изолирована.
Мы уже знали, что для равновесия двух фаз (лёд и вода) необходимо, чтобы они находились при одинаковых T и P. Это можно доказать. Рассмотрим обратимый перенос бесконечно малого количества теплоты dq от фазы α к равновесной фазе β. (Пусть фазы α и β находятся в равновесии)
Условие равновесия для изолированной системы состоит в том, что энтропия не должна меняться при таком переходе.
dS=0=>dSα+dSβ=0
Т.к. процесс обратим:
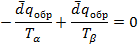

Равенство давлений в обеих фазах при равновесии можно доказать, рассматривая увеличение объёма фазы α на бесконечно малую величину dV и уменьшение объёма фазы β на ту же величину
-dVα+dVβ
Если Т и V в системе постоянны, то|dVα|=|dVβ|
dF=0 => dFα+dFβ=0
-PαdV+PβdV=0
Pα=Pβ
Рассмотрим дополнительные ограничения, возникающие при переносе вещества из одной фазы в другую.
Пусть имеет место перенос малого количества вещества из фазы α в фазу β равновесную с ней.
Т.к. T,P const всей системы, то
dG=0
dGα+dGβ=0
Знаем (2.27) dG=-SdT+VdP+  =>
=>
-μiαdni+μiβdni=0
μiα=μiβ
(3.2)
При равновесии химический потенциал компонента во всех фазах одинаков
Если фаза α не находится в равновесии с фазой β и малое количество вещества dni переходит из α в β, способствуея приближению равновесия, то при P,T const
dGα+dGβ<0
или -μiαdni+μiβdni<0
dni>0 => μiα>μiβ
Таким образом, вещество будет стремиться самопроизвольно переходить из фазы, где оно имеет более высокий μ, в фазу, где его μ ниже.
Аналогично этому вещество будет самопроизвольно диффундировать из области, где его n и μ выше в область более разбавленного раствора.
В этом отношении химический потенциал подобен другим потенциалам: электрическому, гравитационному. Всегда самопроизвольный переход происходит в направлении более низкого потенциала => химический потенциал получил своё название.
Правило фаз
В 1876 году Гиббс вывел простую формулу, связывающую число фаз, находящихся в равновесии, число компонентов и число независимых интенсивных переменных, необходимых для полного описания состояния системы.
Определение:
с -число компонентов в системе - это наименьшее число веществ, с помощью которых можно описать состав любой фазы системы в отдельности, Sопт=с.
S – число веществ, совокупность которых образует систему.
Всегда с<S, т.к. концентрации различных веществ при равновесии могут быть связаны определёнными соотношениями, => нет необходимости использовать для описания системы концентрации всех S веществ.
Существует два типа связи: уравнение химического равновесия и начальные условия.
Для любой отдельной химической реакции число независимых концентраций при равновесии уменьшается на единицу.
Например:
H2O=H2+1/2O2
Пусть молекулярный водород и молекулярный кислород, находящиеся в равновесии с водой, тогда существует не больше двух независимых компонента (H2O и O2; H2O и H2; H2 и O2), т.к.концентрация третьего компонента определяется константой равновесия:



P=CRT
Pi – парциальные давления различных газов; Ci – число молей газа в литре.
Если указаны нормальные условия, то число компонентов уменьшается ещё на один, т.е. до единицы.
Например, если H2 и O2 образуются только из воды, то существует дополнительное уравнение:

Число компонентов выражается:
C=S-n-m,
Где S-число веществ; n – число независимых химических реакций; m – число соотношений между концентрациями, определённых нормальными условиями.
Выбор компонентов произволен, но число их является важной характеристикой системы.
Определение:
Число степеней свободы – наименьшее число независимых переменных (P,T, концентраций веществ во всех фазах), которые необходимо задать, чтобы полностью описать состояние системы.
Пример:
Пусть количество газа фиксировано, как видели ранее, для описания его состояния необходимо определить только две переменные (T и P; P и V; V и T). Третью компоненту можно рассчитать из уравнения состояния f(P,V)=θ. Таким образом чистый газ имеет две степени свободы.
Рассмотрим равновесную систему из p-фаз:
P-число различных типов фаз (в тройной точке воды – 3 фазы).
Видели:
Если фаза содержит «с» компонентов, то её состав можно описать с помощью с -1 концентраций. Концентрацию одного любого компонента можно найти из соотношения

Где xi – мольная доля i компонента.
Следовательно, общее число концентраций, которое характеризует систему равно (с -1) для каждой из p фаз, т.е. всего (с -1) p.
Кроме того, нужно ещё рассмотреть T и P и поэтому общее число независимых переменных (T + P)= (с -1) p +2.
Понятно, что учитывать T,P для каждой фазы в отдельности не нужно, т.к. фазы находятся в равновесии.
Если один из параметров поддерживается постоянным, то число независимых переменных (с -1) p +1
Если система находится в поле воздействия сил магнитного поля, то число независимых переменных (с -1) p +3
Рассмотрим условия равновесия:
Мы знаем, что в этих условиях должны выполняться определённые соотношения.
Например:
μ всех компонент во всех фазах один и тот же.

Число фаз: (α,β,γ…)=p
Для любого компонента количество равновесных состояний p-1.
Например, при наличии двух фаз существует лишь одно равновесное состояние для любого компонента.
Если число компонентов с, каждый из которых равновесно распределён между фазами, то общее количество равновесных состояний c (p -1).
Тогда:
число степеней свободы = общее число переменных – общее количество равновесных состояний между этими переменными.
Другими словами
v - дополнительное число переменных, которые должны быть заданы для полного определения состояния системы.
Для систем, с которыми мы имеем дело переменными являются T, P, концентрация:
v=[p(c-1)+2]-c(p-1),
с - число компонентов,
p - число фаз (все фазы находятся в равновесии).
v=c-p+2 - Правило фаз Гиббса
(3.3)
Выводы:
Чем больше компонентов в системе, тем больше степеней свободы.
Чем больше фаз, тем меньше переменных (T, P, концентрация) необходимо определить для полного описания системы.
Для каждого числа компонентов число фаз максимально, когда v=0 (система называется инвариантной).
Для однокомпонентной системы максимальное число фаз p: при равновесии p=c-v+2=1+0+2=3.
[Пример - тройная точка воды существует при единственном сочетании T=0,010C и P=4,58 мм.рт.ст]
Првило фаз для однокомпонентной системы:
v=3-p
(3.3)
Таблица
| p
| v
| Название системы
| Переменные
|
|
|
| бивариантна
| Одна фаза, например, водяной пар, то нужно определить T и P
|
|
|
| моновариантна
| 2 фазы: водяной пар в равновесии с жидкой водой. Необходимо определить либо Т, либо P, т.к. для данной T существует только одно равновесное P и наоборот.
|
|
|
| инвариантна
| Сосуществование трёх фаз возможно при единственном сочетании T и P
|



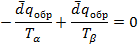

 =>
=>








