Окислительно-восстановительное титрование
К окислительно-восстановительным относятся химические процессы, которые сопровождаются изменением степени окисления атомов веществ, участвующих в реакции.
Вещества, атомы которых в ходе реакции понижают степень окисления благодаря присоединению электронов, называются окислителями, т.е. они являются акцепторами электронов. При этом окислители сами восстанавливаются. Восстановители, являясь донорами электронов, окисляются.
Продукт восстановления окислителя называется восстановленной формой, а продукт окисления восстановителя – его окисленной формой. Окислитель со своей восстановленной формой составляет полупару окислительно-восстановительной системы, а другой полупарой является восстановитель со своей окисленной формой. Таким образом, восстановитель с окисленной формой и окислитель со своей восстановленной формой составляют две полупары (редокс пары) окислительно-восстановительной системы.
Все ОВ процессы (редокс реакции) можно разделить на три типа
а) межмолекулярные, когда в ходе реакции ОВ переход электронов происходит между частицами различных веществ. Например

В данной реакции роль окислителя в присутствии Н3О+ играют ионы  а в качестве восстановителя выступают ионы
а в качестве восстановителя выступают ионы 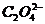
б) дисмутационные (диспропорционирования), в ходе которых переход электронов происходит между частицами одного и того же вещества. В результате диспропорционирования степень окисления одной части атомов понижается за счет другой части таких же атомов, степень окисления которых становится больше.
Например: 
в) внутримолекулярные, в которых переход электронов происходит между двумя атомами, входящими в состав одной и той же частицы вещества, приводящие к разложению вещества на более простые.
Например: 
Способы установления Т.Э.
Для определения точки эквивалентности при окислительно-восстановительном титровании используют:
а) безиндикаторные методы. В случае, когда раствор титруемого вещества или титранта имеют окраску, ТЭ можно определить по исчезновению или появлению этой окраски, соответственно;
б) специфические индикаторы – изменяющие цвет при появлении титранта или исчезновении определяемого вещества. Например, для системы J2/2J-, специфическим индикатором является крахмал, окрашивающий растворы, содержащие J2 в синий цвет, а для ионов Fe3+ специфическим индикатором являются ионы SCN- (ионы тиоцианата), образующийся комплекс окрашен в кроваво-краный цвет;
в) ОВ (редокс-) индикаторы – изменяющие цвет при изменении ОВ потенциала системы. Одноцветные индикаторы – дифениламин, двухцветные – ферроин.
Редокс – индикаторы существуют в двух формах – окисленной (Indок) и восстановленной (Indвосс), причем цвет одной формы отличается от другой. Переход индикатора от одной формы в другую и изменение его окраски происходит при определенном потенциале перехода, который наблюдается при равенстве концентраций окисленной и восстановленной форм индикатора и по уравнению Нернста –Петерса:

Интервал перехода редокс-индикаторов очень невелик в отличие от кислотно-основных индикаторов.
Кривые ОВ титрования
Кривые ОВ титрования ОВ изображают изменение ОВ потенциала системы по мере приливания раствора титранта.
Редуктометрия, когда раствор окислителя титруется стандартным раствором восстановителя
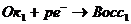
В редуктометрии кривые титрования рассчитывают:
1) 
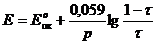
2) 
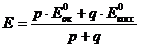
3) 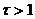
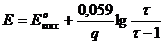

Оксидиметрия, когда раствор восстановителя титруется стандартным раствором окислителя
В оксидиметрии кривые титрования рассчитывают:
1) 

2) 
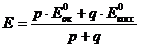
3) 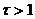
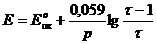

Пример. Рассчитаем кривую титрования 100 см3 раствора FeSO4 c молярной концентрацией эквивалента 0,1 моль/дм3 раствором КMnO4 такой же концентрации.
Уравнение реакции:

Константа равновесия этой реакции равна

Большое числовое значение константы равновесия показывает, что равновесие реакции практически целиком сдвинуто вправо. После добавления первых же капель титранта в растворе образуются две ОВ пары: 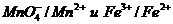 , потенциал каждой из которых можно вычислить по уравнению Нернста:
, потенциал каждой из которых можно вычислить по уравнению Нернста:
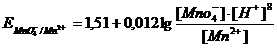
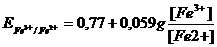
В данном случае раствор восстановителя титруется раствором окислителя, т.е. титрование относится к методу оксидиметрии, расчет кривой титрования проводим по соответствующей схеме.
1) До Т.Э. 




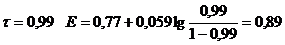

2) В Т.Э. 

3) После Т.Э. 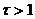
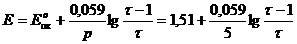
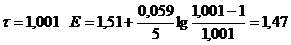
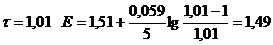


Расчетные данные для построения кривой титрования
| №
п/п
| τ
| Расчетная формула
| E, В
|
|
| 0,10
| 
| 0,71
|
| 0,50
| 0,77
|
| 0,90
| 0,83
|
| 0,99
| 0,89
|
| 0,999
| 0,95
|
|
|
| 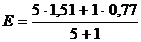
| 1,39
|
|
| 1,001
| 
| 1,47
|
| 1,01
| 1,49
|
| 1,10
| 1,50
|
| 1,50
| 1,505
|
По данным таблицы строим кривую титрования:
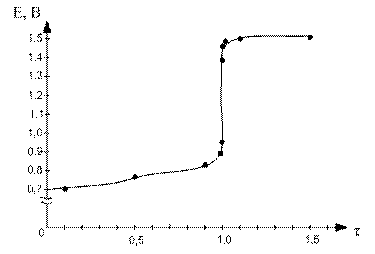
Для ошибки титрования ± 0,1 % скачок титрования
∆E = Eτ=1,001 - Eτ=0,999 = 1,47 – 0,95 = 0,52.
Для ошибки титрования ± 1,0 % скачок титрования
∆E = Eτ=1,01 - Eτ=0,99 = 1,49 – 0,89 = 0,60.
В области ТЭ при переходе от раствора недотитрованного на 0,1 % к раствору перетитрованному на 0,1 % потенциал изменяется больше, чем на 0,5 В. Скачок потенциала позволяет использовать для обнаружения ТЭ непосредственно потенциометрические измерения или ОВ индикаторы, окраска которых изменяется при изменении потенциала. Кроме того в этом случае в качестве титранта используется окрашенный раство, следовательно Т.Э. можно определить по появлению слабо-розовой окраски от одной избыточной капли перманганата калия.
ПЕРМАНГАНАТОМЕТРИЯ
В основе метода лежит окисление растворов восстановителей перманганатом калия КМnО4. Окисление восстановителей можно проводить в различных средах, причем марганец (VII) восстанавливается в кислой среде до ионов Мn2+, в нейтральной - до марганца (IV) и в щелочной - до марганца (VI). Обычно в методе перманганатометрии проводят реакцию в кислой среде. При этом протекает полуреакция

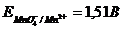
Титрованный раствор 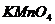 по точной навеске приготовить нельзя, т.к. он содержит в своем составе
по точной навеске приготовить нельзя, т.к. он содержит в своем составе  . Поэтому сначала готовят раствор
. Поэтому сначала готовят раствор 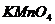 приблизительно нужной концентрации, оставляют в темной бутыли на 7-10 дней, отфильтровывают выпавший в осадок
приблизительно нужной концентрации, оставляют в темной бутыли на 7-10 дней, отфильтровывают выпавший в осадок  , а затем устанавливают точную концентрацию полученного раствора
, а затем устанавливают точную концентрацию полученного раствора 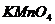 . Стандартизацию раствора
. Стандартизацию раствора 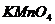 проводят по титрованному раствору щавелевой кислоты (
проводят по титрованному раствору щавелевой кислоты (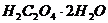 ) или оксалата натрия (
) или оксалата натрия ( ).
).

Индикатором служит сам перманганат, окрашенный в красно-фиолетовый цвет. Конец реакции легко определяется по изменению окраски от одной избыточной капли перманганата. В кислой среде титруемый раствор окрашивается в розовый цвет за счет избыточных МnО4- -ионов. Большим недостатком окислительно-восстановительных реакций является их небольшая скорость, что затрудняет процесс титрования. Для ускорения медленно идущих реакций применяют нагревание. Как правило, с повышением температуры на каждые 10° скорость реакции увеличивается в 2-3 раза. Реакцию окисления перманганатом щавелевой кислоты, проводят при температуре 70-80 °С. В этих условиях титрование проходит нормально, так как скорость реакции значительно увеличивается.
Если нагревание применять нельзя (улетучивание одного из веществ, разложение и т. д.), для ускорения реакции увеличивают концентрации реагирующих веществ. На скорость реакции может оказывать влияние введение в раствор катализатора.
Реакцию окисления перманганатом щавелевой кислоты можно каталитически ускорить прибавлением МnSО4, роль которого сводится к следующему:

Образовавшийся диоксид марганца окисляет щавелевую кислоту, восстанавливаясь до марганца (III):

Затем

Таким образом, прибавленный к раствору марганец (II) полностью регенерируется и на реакцию не расходуется, но сильно ускоряет реакцию. В перманганатометрии одним из продуктов реакции окисления щавелевой кислоты являются ионы Мn2+, которые по мере образования в растворе ускоряют процесс реакции. Такие реакции называют автокаталитическими. Первые капли перманганата при титровании горячего подкисленного раствора щавелевой кислоты обесцвечиваются медленно. По мере образования небольшого количества ионов Мn2+ дальнейшее обесцвечивание перманганата происходит практически мгновенно, так как образовавшиеся ионы Мn2+ играют роль катализатора.
Окислительно-восстановительное титрование
К окислительно-восстановительным относятся химические процессы, которые сопровождаются изменением степени окисления атомов веществ, участвующих в реакции.
Вещества, атомы которых в ходе реакции понижают степень окисления благодаря присоединению электронов, называются окислителями, т.е. они являются акцепторами электронов. При этом окислители сами восстанавливаются. Восстановители, являясь донорами электронов, окисляются.
Продукт восстановления окислителя называется восстановленной формой, а продукт окисления восстановителя – его окисленной формой. Окислитель со своей восстановленной формой составляет полупару окислительно-восстановительной системы, а другой полупарой является восстановитель со своей окисленной формой. Таким образом, восстановитель с окисленной формой и окислитель со своей восстановленной формой составляют две полупары (редокс пары) окислительно-восстановительной системы.
Все ОВ процессы (редокс реакции) можно разделить на три типа
а) межмолекулярные, когда в ходе реакции ОВ переход электронов происходит между частицами различных веществ. Например

В данной реакции роль окислителя в присутствии Н3О+ играют ионы  а в качестве восстановителя выступают ионы
а в качестве восстановителя выступают ионы 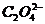
б) дисмутационные (диспропорционирования), в ходе которых переход электронов происходит между частицами одного и того же вещества. В результате диспропорционирования степень окисления одной части атомов понижается за счет другой части таких же атомов, степень окисления которых становится больше.
Например: 
в) внутримолекулярные, в которых переход электронов происходит между двумя атомами, входящими в состав одной и той же частицы вещества, приводящие к разложению вещества на более простые.
Например: 




 а в качестве восстановителя выступают ионы
а в качестве восстановителя выступают ионы 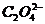



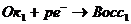

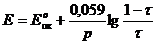

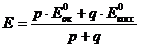
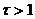
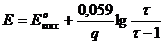



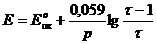



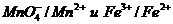 , потенциал каждой из которых можно вычислить по уравнению Нернста:
, потенциал каждой из которых можно вычислить по уравнению Нернста: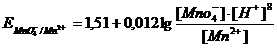
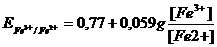




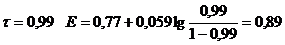


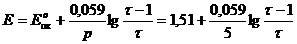
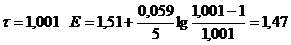
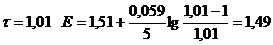



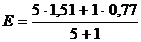



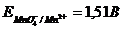
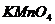 по точной навеске приготовить нельзя, т.к. он содержит в своем составе
по точной навеске приготовить нельзя, т.к. он содержит в своем составе  . Поэтому сначала готовят раствор
. Поэтому сначала готовят раствор 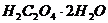 ) или оксалата натрия (
) или оксалата натрия ( ).
).





