

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...
Топ:
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Часа
Цель работы: Научиться определять константу скорости химической реакции по изменению концентрации реагирующего вещества.
План занятия
1. Сдача теоретического минимума (допуска) к работе.
2. Экспериментальное определение константы скорости химической реакции.
3. Составление отчета о работе.
Основная литература
1. Зимон А.Д. Физическая химия. Изд. 3-е. М.: Агар, 2006. – с. 36-44.
2. Зимон А.Д. Коллоидная химия. Изд. 5-е. М.: Агар, 2007. – с. 170-178.
Дополнительная литература
1. Болдырев А. И. Физическая и коллоидная химия. – М.: Высшая школа, 2003
2. Чанг Р. Физическая химия с приложениями к биологическим системам.-
М.: Мир, 1990
Вопросы для самоподготовки
1. Приведите примеры гомогенных и гетерогенных химических реакций.
2. Сформулируйте ЗДМ и приведите его математическое выражение для необратимых и обратимых химических реакций.
3. Что называется константой скорости химической реакции? От каких факторов она зависит? Не зависит?
4. Почему молекулярность реакций не всегда совпадает с порядком реакции? Что называют порядком реакции?
5. Напишите кинетическое уравнение для вычисления константы скорости реакций первого и второго порядков. Назовите входящие в эти уравнения величины.
6. От каких факторов зависит скорость химической реакции? Поясните действие этих факторов.
7. Сформулируйте правило Вант-Гоффа и приведите его математические выражения.
8. Что называют энергией активизации химической реакции? Приведите уравнение Аррениуса для расчета энергии активизации и поясните входящие в него члены.
9. Зависит ли константа скорости реакции от промежутка времени?
Краткие методические рекомендации
|
|
Опыты по определению константы скорости и должны проводиться при постоянной температуре. Поэтому все химические реактивы должны иметь одинаковую температуру. Для этой цели используют водяной термостат или выдерживают все вещества при температуре опыта 2-3 суток. При сливании реактивов колбы и пробирки берутся за верхнюю часть, чтобы избежать случайного подогрева компонентов. Тиосульфат натрия из бюретки добавляются, при возможности, быстро. Перемешивание содержимого колбы проводится непрерывно плавными кругообразными движениями. Опыт повторяется не менее трех раз. После каждого опыта колба, в которой протекала реакция, тщательно моется содовым раствором или посуде могут остаться следы катализатора, который окажет свое действие мыльной водой и ополаскивается. В противном случае в плохо промытой на реакцию и следующий (повторный) опыт будет испорчен. Промежутки времени между окрашиванием раствора отмечаются секундомером с точностью + 0,2 секунды.
Принадлежности для работы
Термостат; бюретка на 25 мл с делениями для титрования; одна коническая колба на 150 мл; секундомер или часы с секундой стрелкой; 0,05 М растворы  и
и  ; 1 М раствор
; 1 М раствор 
 ; 0,4% раствор КI; 0,5% раствор крахмала; 0,1М раствор молибдата аммония.
; 0,4% раствор КI; 0,5% раствор крахмала; 0,1М раствор молибдата аммония.
Ход работы
Пользуясь мерным цилиндром или пипеткой в коническую колбу на 150 мл последовательно вносят: 10 мл 0,4 % KI и 1 мл 1М раствора серной кислоты. Колбу помещают в термостат ( C) на 10 мин. Если термостат отсутствует, то колбу ставят на воздух при комнатной температуре. При этом следует избегать случайного нагревания колбы, т.е. не ставить ёё вблизи нагревательных приборов и не согревать рукой, т.к. всякое изменение температуры скажется на скорости реакций.
C) на 10 мин. Если термостат отсутствует, то колбу ставят на воздух при комнатной температуре. При этом следует избегать случайного нагревания колбы, т.е. не ставить ёё вблизи нагревательных приборов и не согревать рукой, т.к. всякое изменение температуры скажется на скорости реакций.
Реакция 2 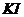 +
+ 
 =
= 
 + 2
+ 2  (1) протекает практически мгновенно и сопровождается незначительным тепловым эффектом, т. К. для реакции взяты очень малые массы реагирующих веществ.
(1) протекает практически мгновенно и сопровождается незначительным тепловым эффектом, т. К. для реакции взяты очень малые массы реагирующих веществ.
В отдельную пробирку помещают 10 мл 0,05 М раствора  имеющего ту же температуру, что и
имеющего ту же температуру, что и 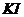 и
и  . В колбу с раствором, содержащим HI, из бюретки добавляют 0,5 М раствора
. В колбу с раствором, содержащим HI, из бюретки добавляют 0,5 М раствора  и пять капель крахмала (индикатор на йод) и 10 мл 0,05 М раствора
и пять капель крахмала (индикатор на йод) и 10 мл 0,05 М раствора  , эквивалентные А мл 0,05 М раствора тиосульфата натрия (см. ниже). Тщательно перемешивают содержимое колбы и по секундомеру или по часам отмечают в таблице (см. в конце работы) время первого появления голубого окрашивания
, эквивалентные А мл 0,05 М раствора тиосульфата натрия (см. ниже). Тщательно перемешивают содержимое колбы и по секундомеру или по часам отмечают в таблице (см. в конце работы) время первого появления голубого окрашивания  . Быстро прибавляют из бюретки ещё 1 мл 0,05 М раствора
. Быстро прибавляют из бюретки ещё 1 мл 0,05 М раствора  , перемешивают (вледствии чего голубое окрашивание исчезает) и вновь отмечают время появления голубого окрашивания
, перемешивают (вледствии чего голубое окрашивание исчезает) и вновь отмечают время появления голубого окрашивания  и т.д., повторив эти операции 4-5 раз. Затем прибавляют несколько капель 0,1 М раствора молибдата аммония (катализатор) и выделившийся йод титруют 0,05 М раствором
и т.д., повторив эти операции 4-5 раз. Затем прибавляют несколько капель 0,1 М раствора молибдата аммония (катализатор) и выделившийся йод титруют 0,05 М раствором  до исчезновения голубой окраски.
до исчезновения голубой окраски.
|
|
Таким образом устанавливают, какому общему числу А мл 0,05 М раствора  (считая с самого начала работы) эквивалентны взятые для работы 10 мл 0,05 М раствора
(считая с самого начала работы) эквивалентны взятые для работы 10 мл 0,05 М раствора  .
.
При добавлении пероксида и тиосульфата идут реакции:
2 HI +  =
=  + 2
+ 2 
 + 2
+ 2 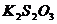 = 2 KI +
= 2 KI + 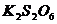
Обе эти реакции протекают значительно медленнее, чем реакции образования HI (реакция 1). Особенно медленно идет реакция (2), она является лимитирующей. Концентрацию HI можно считать постоянной, а скорость реакции (2) будет определяться лишь концентрацией  (в условиях опыта). Таким образом, реакция (2) является фактически реакцией первого порядка.
(в условиях опыта). Таким образом, реакция (2) является фактически реакцией первого порядка.
Промежутки времени  ,
,  и т.д. отсчитывают от момента окрашивания
и т.д. отсчитывают от момента окрашивания  , принимаемого за начало опыта. Таким образом, в начальный момент опыта
, принимаемого за начало опыта. Таким образом, в начальный момент опыта  содержится А -1 мл 0,05 М раствора
содержится А -1 мл 0,05 М раствора  и, следовательно, a = А-1. К моменту второго появления окрашивание
и, следовательно, a = А-1. К моменту второго появления окрашивание  прореагирует еще 1 мл 0,05 М раствора
прореагирует еще 1 мл 0,05 М раствора  и, следовательно x =2 и т.д.
и, следовательно x =2 и т.д.
Вычисления.
Для вычисления константы скорости реакции удобнее использовать следующее уравнение:
K = 

Подставив в это уравнение значение А и x в миллилитрах 0,05 М раствора  , t – в минутах, вычисляют константу скорости К отдельно для каждого промежутка времени
, t – в минутах, вычисляют константу скорости К отдельно для каждого промежутка времени  ,
,  и т.д. с точностью до третьего десятичного знака.
и т.д. с точностью до третьего десятичного знака.
При тщательной работе разница в найденных для каждого промежутка времени значениях константы не должна превышать несколько тысячных долей. Это указывает на то, что константа скорости не зависит от концентрации пероксида водорода. Берут среднее арифметическое значение константы скорости, указав температуру, при которой проводился опыт. Результаты работы заносятся в таблицу, учитывая, что 10 мл 0,05 М раствора  эквивалентны 10 мл 0,05 раствора (А = 10)
эквивалентны 10 мл 0,05 раствора (А = 10)  .
.
|
|
Таблица 6
| Появление окрашивания | Промежутки времени между окрашиваниями | А-1- x | lg (А-1- x) | lg (А-1)- lg (А-1- x) |

|
Отчет о работ
Рассчитать величину константы для каждого промежутка времени (между окрашиваниями) и сделать вызов о зависимости константы скорости от концентрации реагирующих веществ.
Работа №6. Криоскопия
Часа
Цель работы:
1. Практически ознакомиться с криоскопическим методом определения молярной массы растворенного вещества.
2. Определить молярную массу неизвестного вещества криоскоическим методом.
План занятия
1. Сдача теоретического минимума (допуска) к работе.
2. Ознакомление с термометром Бекмана и установкой для криоскопических определений молярных масс.
3. Определение молярной массы неизвестного вещества методом криоскопии.
4. Составление отчета о работе.
Основная литература
1. Зимон А.Д. Физическая химия. Изд. 3-е. М.: Агар, 2006. – с. 138-152.
2. Зимон А.Д. Коллоидная химия. Изд. 5-е. М.: Агар, 2007. – с. 180-188.
Дополнительная литература
1. Болдырев А. И. Физическая и коллоидная химия. – М.: Высшая школа, 2003.
2. Физическая химия. / К.С. Краснов, Н. К. Воробьев, И. Н. Годнев и др.; Под. Ред. К. С. Краснова. – М.: Высшая школа, 1995.
Вопросы для самоподготовки:
1. На чем основан криоскопический метод определения молярой массы растворённых веществ?
2. Что называют криоскопической постоянной? Каков её физический смысл?
3. Как влияет электролитическая диссоциация на величину Δ t?
4. Для каких веществ можно определить молярную массу криоскопическим методом?
5. Что называют температурой замерзания раствора? От каких факторов она зависит?
6. Напишите формулу, которая позволяет вычислить относительную молярную массу растворённого вещества по понижению температуры замерзания и поясните входящие в нее члены.
Краткие методические рекомендации
Прежде чем приступить к выполнению работы, необходимо тщательно ознакомиться с устройством термометра Бекмана, рассмотреть шкалу и научиться снимать с него показания температуры. Охлаждающая смесь должна быть приготовлена в соотношении 3:1. Три весовые части снега или льда и одна весовая часть поваренной соли. Прибор определения молярной массы собирается точно по схеме. Масса навески неизвестного вещества определяется на аналитических весах, а масса растворителя на технических. Определение понижения температуры замерзания раствора и чистого растворителя проводится не менее двух раз.
|
|
Принадлежности для работы
Прибор для криоскопических изменений; термометра Бекмана; лупа; лед и хлорид натрия для приготовления охладительной смеси; вода (растворитель); глюкоза; мочевина или другое вещество, растворимое в воде.
Описание прибора
Основная часть прибора пробирка 6 с боковым отростком 7. Верхнее отверстие ее плотно закрывают пробкой 9, через которую проходят термометр 10 и мешалка 11 из тонкой проволоки. Один конец мешалки загнут в виде кольца, свободно охватывающего нижнюю часть термометра. Пробирку 6 со вставленным в нее термометром и мешалкой через пробку вводят в широкую пробирку 4, служащую воздушной рубашкой. Полностью собранный прибор через отверстие в крышке 2 погружают в толстостенный стакан 1, который заполняют перед опытом охладительной смесью (вода с толченным льдом). Мешалку 3 из толстой проволоки используют для размешивания охладительной смеси.
Установка термометра Бекмана.
При опытах не требуется измерять действительные температуры замерзания растворителя и раствора, а нужно только с большой точностью измерить разность между этими температурами. Для этого пользуются дифференциальными (разностными) термометрами Бекмана. В лабораторной практике обычно применяют термометр длиной 50 см, причем около 3 см общей длины приходится на долю резервуара со ртутью, около 12 см – на капилляр до основания шкалы, около 24 – на шкалу и около 10 см - на верхнюю часть термометра. Капилляр в верхней части загнут и переходит в расширение (рис. 3), частично заполненное ртутью. Вся шкала обыкновенно разделена только на  С с делениями в
С с делениями в 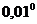 . Но с помощью увеличительного стекла (лупы) можно на глаз делать отсчеты температуры с точностью до
. Но с помощью увеличительного стекла (лупы) можно на глаз делать отсчеты температуры с точностью до  С.
С.
Ход работы
Опыт 1.Стакан 1 наполняют почти до верху охладительной смесью (снег с солью). Взвешивают пустую пробирку 6 с точностью до 0,01 г, ее массу обозначают 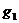 . Наливают в пробирку столько
. Наливают в пробирку столько  , чтобы ртутный резервуар термостата был целиком погружен в жидкость. Затем взвешивают пробирку 6 с
, чтобы ртутный резервуар термостата был целиком погружен в жидкость. Затем взвешивают пробирку 6 с  , массу ее обозначают
, массу ее обозначают  , тогда
, тогда 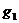 -
-  = g (навеска
= g (навеска  ). Укрепляют при помощи пробирки 9 термометр 10 в пробирке 6. Сняв крышку 2 и рубашку 4, погружают пробирку 6 с водой в воду со льдом и охлаждают при перемешивании до начала выпадения кристаллов.
). Укрепляют при помощи пробирки 9 термометр 10 в пробирке 6. Сняв крышку 2 и рубашку 4, погружают пробирку 6 с водой в воду со льдом и охлаждают при перемешивании до начала выпадения кристаллов.
|
|
Температуру начала выпадения кристаллов замечают как приблизительную температуру замерзания чистой 
 . Затем вынимают из охладительной смеси пробирку с водой и нагревают ее рукой до полного расплавления кристаллов. Снова погружают пробирку с водой в воду со льдом и при помешивании охлаждают приблизительно до температуры
. Затем вынимают из охладительной смеси пробирку с водой и нагревают ее рукой до полного расплавления кристаллов. Снова погружают пробирку с водой в воду со льдом и при помешивании охлаждают приблизительно до температуры  +
+  С, предварительно надев крышку 2, но без рубашки 4. прекращают помешивают помешивание и спокойно охлаждают пробирку приблизительно до температуры
С, предварительно надев крышку 2, но без рубашки 4. прекращают помешивают помешивание и спокойно охлаждают пробирку приблизительно до температуры  +
+ 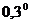 С. Быстро ставят на место рубашку 4, укрепляют в ней пробирку 6 и заканчивают охлаждение без помешивания, чтобы переохладить жидкость до температуры около -
С. Быстро ставят на место рубашку 4, укрепляют в ней пробирку 6 и заканчивают охлаждение без помешивания, чтобы переохладить жидкость до температуры около -  С. Поднимая и опуская мешалку 11, вызывают замерзание переохлажденного бензола. Отмечают при помощи лупы с точностью до
С. Поднимая и опуская мешалку 11, вызывают замерзание переохлажденного бензола. Отмечают при помощи лупы с точностью до  С максимальное показание термометра
С максимальное показание термометра  , которое отвечает “истиной” температуре замерзания чистого бензола. Еще раз расплавляют выделившиеся кристаллы, после чего снова определяют
, которое отвечает “истиной” температуре замерзания чистого бензола. Еще раз расплавляют выделившиеся кристаллы, после чего снова определяют  . Определения повторяют не менее двух раз, добиваясь, чтобы расхождение между предыдущим и последующим измерениями температуры не превышало 0,02. Для величины t берут среднее арифметическое из них.
. Определения повторяют не менее двух раз, добиваясь, чтобы расхождение между предыдущим и последующим измерениями температуры не превышало 0,02. Для величины t берут среднее арифметическое из них.
От преподавателя получают исследуемое вещество для определения его молярной массы и берут точную его навеску. Через отросток 7 навеску вводят в пробирку 6 для растворения в бензоле. После того, как все введенное вещество растворится, отверстие отростка 7 плотно закрывают пробкой. Указанным выше способом определяют сначала приблизительную, а затем температуру замерзания раствора  .
.
Таким образом, получают понижение температуры замерзания раствора:
 -
-  =
= 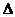 t
t
Молярную массу растворенного вещества рассчитывают по формуле.
При работе необходимо:
1) следить за тем, чтобы термометр не касался стенки пробирки 6 и мешалка 11 не терлась о термометр;
2) следить за тем, чтобы кристаллы бензола полностью были расплавлены, в противном случае не удастся переохладить раствор;
3) следить за тем, чтобы в охладительной смеси в течении всего опыта было достаточное количество льда» не забывать помешивать воду со льдом;
4) переохлаждать раствор каждый раз приблизительно на одно и то же число десятых долей градуса (около –  С);
С);
5) продолжать помешивать охладительную смесь во время отсчета показаний термометра; при этом размешивать не слишком энергично. (Почему?)
Вычисления
Вычисление молярной массы растворенного вещества производят с точностью до первого десятичного знака. Результат выражается при соответствующем округлениями целыми числами.
Форма записи результатов
Масса пустой пробирки - 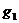 в г;
в г;
масса пробирки с водой -  в г;
в г;
навеска воды –  =
=  -
- 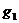
навеска исследуемого вещества - m в г.
Отчет по работе состоит из непосредственной записи наблюдений и вычислений по указанной выше формуле.
Таблица 7
| Компоненты раствора | Температура замерзания ( С) С)
| М по формуле | ||
| приблизительная | истинная | истинная средняя | ||
| Растворитель Раствор |

| 1)  2)
2)  1)
1)  2)
2) 
|
 
 
|  М =
М = 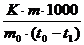
|
Работа 7.
|
|
|

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!