|
| Немeталл
| Кислотный оксид
| Кислота
| Соль
|
| Металл
| = Соль (10)
| ―
| = Соль +... (8)
| = Соль + Металл (9)
|
| Основной оксид
| ―
| = Соль (4)
| = Соль + Вода (3)
| ―
|
| Основание
| ―
| = Соль + Вода (2)
| = Соль + Вода (1)
| = Соль + Основание (5)
|
| Соль
| ―
| ―
| = Соль + Кислота (6)
| = Соль + Соль (7)
|
Взаимодействие оснований с кислотами:
ОСНОВАНИЕ + КИСЛОТА = СОЛЬ + ВОДА.
Например:
NaOH + HCL = NaCl + Н2О;
Сu(ОН)2 + H2SO4 = CuSO4 + 2Н2О.
Взаимодействие оснований с кислотными оксидами:
ОСНОВАНИЕ + КИСЛОТНЫЙ ОКСИД = СОЛЬ + ВОДА.
Например:
Са(ОН)2 + СО2 = СаСОз + Н2О;
2NH4OH + SO3 = (NH4)2SO4 + Н2О.
Взаимодействие основных оксидов с кислотами:
ОСНОВНЫЙ ОКСИД + КИСЛОТА = СОЛЬ + ВОДА.
Например:
ВаО + H2SO4 = BaSO4 + Н2О;
CuO + 2HNO3 = Cu(NO3)2 + Н2О.
Взаимодействие основных оксидов с кислотными оксидами:
ОСНОВНЫЙ ОКСИД + КИСЛОТНЫЙ ОКСИД = СОЛЬ.
Например:
СаО + СО2 = СаСО3;
ZnO + SO3 = ZnSO4.
Взаимодействие растворимых оснований (щелочей) с солями:
РАСТВОР ЩЁЛОЧИ + РАСТВОР СОЛИ = СОЛЬ + ОСНОВАНИЕ.
Например:
3NaOH + FeCl3 = 3NaCl + Fe(OH)3;
Ba(OH)2 + Na2SO4 = BaSO4 + 2NaOH.
Взаимодействие солей с кислотами:
СОЛЬ + КИСЛОТА = СОЛЬ + КИСЛОТА.
Например:
AgNO3 + HCl = AgCl + HNO3;
BaCl2 + H2SO4 = BaSO4 + 2HCl.
Взаимодействие двух солей между собой:
СОЛЬ(1) + СОЛЬ(2) = СОЛЬ(3) + СОЛЬ(4).
Например:
AgNO3 + NaCl = AgCl + NaNO3;
Na2CO3 + BaCl2 = BaCO3 + 2NaCl.
Взаимодействие металлов с кислотами:
ME + КИСЛОТА = СОЛЬ + Н2.
Водород выделяется при взаимодействии металлов со всеми кислотами, кроме азотной кислоты HNO3 и концентрированной серной кислоты H2SO4.
Например:
Mg + H2SO3 = MgSO3 + H2;
Zn + 2HCl = ZnCl2 + H2.
Взаимодействие металлов с растворами солей:
МЕ(1) + РАСТВОР СОЛИ(1) = РАСТВОР СОЛИ(2) + МЕ(2).
Ме(1) должен быть более активным металлом, чем Ме(2).
Например:
Сu + HgCl2 = CuСl2 + Hg;
Zn + Cu(NO3)2 = Zn(NO3)2 + Сu.
Взаимодействие металлов с неметаллами
ME + НЕМЕ = СОЛЬ.
Кроме этих общих способов получения солей возможны и некоторые частные способы:
Взаимодействие металлов, оксиды и гидроксиды которых являются амфотерными, с растворимыми основаниями (щелочами):
ME + РАСТВОРИМОЕ ОСНОВАНИЕ (ЩЕЛОЧЬ) = СОЛЬ + Н2.
Например:
Zn + 2NaOH = Na2Zn02 + Н2.
С водными растворами щелочей реакция идет по уравнению:
Zn + 2NaOH + 2Н2О = Na2[Zn(OH)4] + Н2.
Сплавление солей с некоторыми кислотными оксидами:
СОЛЬ + КИСЛОТНЫЙ ОКСИД = СОЛЬ + КИСЛОТНЫЙ ОКСИД.
Например:
K2CO3 + SiO2 = K2SiO3 + CO2.
Взаимодействие растворимых оснований (щелочей) с галогенами:
Cl20+2KOH = KCl-1+ KCl+1O+H2O;
3Cl2 + 6КОН = 5КСl + КСlO3 + 2Н2О;
Вr2 + 2NaOH = NaBr + NaBrO + Н2О.
Взаимодействие галогенидов с галогенами:
СОЛЬ + НAl2(1) = СОЛЬ + НAl2(2);
НAl2(1) ― более активный, чем НAl2(2).
Окислительная активность галогенов уменьшается в ряду: F2, Cl2, Вr2, I2.
2КВr + Сl2 = 2KCL + Вr2;
2NAl + Вr2 = 2NaBr + I2.
Тема: «Генетическая связь между классами неорганических соединений»
Генетической называется связь между веществами разных классов, основанная на их взаимопревращениях и отражающая единство их происхождения. С помощью химических реакций можно проследить превращения одних веществ в другие.
Представленная ниже схема иллюстрирует эту связь:
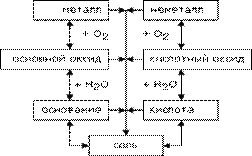
Признаки генетического ряда элемента
в каждом веществе генетического ряда содержится один и тот же химический элемент;
рассматриваются разные формы существования этого химического элемента: простое вещество и соединения ― оксиды, основания, соли;
прослеживаются взаимопревращения веществ разных классов.
Генетический ряд металлов отражает взаимосвязь веществ разных классов, в основу которой положен один и тот же металл.
Металл → основный оксид → основание → соль;
Металл → основный оксид → соль → основание → основный оксид → металл.
Например: Сu → CuO → CuCl2 Cu(OH)2 → CuO → Сu.
Генетический ряд неметаллов отражает взаимосвязь веществ разных классов, в основу которой положен один и тот же неметалл.
Неметалл → кислотный оксид → кислота → соль;
Неметалл → кислотный оксид → соль → кислота → кислотный оксид → неметалл.
Например, P → P2O5 → H3PO4 → Mg3(PO4)2.
«Обратные» генетические ряды ― это те же привычные нам генетические цепочки, только записанные в обратном порядке и без уравнений химических реакций («в статике»).
Например:
Fe(NO3)3 → Fe3+(OH)3 → Fe2O3 → Fe
↓
HNO3 → N2O5 → N2.
Выполнение типового задания
Задание
Напишите молекулярные и ионные уравнения реакций, при помощи которых можно осуществить следующие превращения:
Fe(OH)3 → Fe2О3 → Fe2(SO4)3 → Fe(OH)3 → FeOH(NO3)2 → Fe(NO3)3.
Решение:
Получим оксид железа (III):
2Fe(OH)3 = Fe3O3+3H2O.
Действуя на оксид железа (III) серной кислотой, получим сульфат железа (III):
Fe2O3+3H2SO4 = Fe2(SO4)3+ЗН2О;
Fe2O3+6Н++3SO42- = 2Fe3++3SO42-+3H2O;
Fe2O3+6H+ = 2Fe3++3H2O.
Гидроксид железа (III) Fе(ОН)3 получим, действуя на раствор соли раствором щелочи:
Fe2(SO4)3+6NaOH = 2Fe(OH)3+3Na2SO4;
2Fe3++3SO42-+6Na++6OH- = 2Fe(OH)3+6Na++3SO42-;
Fe3++3ОН- = Fe(OH)3.
Чтобы получить основную соль, подействуем на Fe(OH)3 азотной кислотой, взятой в количестве, достаточном для замены двух гидроксидных групп на кислотные остатки, т. е. на один моль Fe(OH)3 ― два моля HNO3:
Fe(OH)3+2HNO3 = FeOH(NO3)2+2H2O;
Fe(OH)3+2H++2NO3 = FeOH2++2NO3-+2Н2О;
Fe(OH)3+2Н+ = FeOH2++2Н2О.
Для получения нормальной соли к основной соли прибавим необходимое количество кислоты (на один моль FeOH(NO3)2 ― один моль HNO3):
FeOH(NO3)2+HNO3 = Fe(NO3)3+Н2О;
FeOH2++2NO3-+H++3NO3- = Fe3++3NO3-+Н2О;
FeOH2++H+ = Fe3++H2O.
Вопросы для самоподготовки
1. Что такое соли?
2. На какие типы делятся соли?
3. Какие физические свойства солей вы знаете?
4. Как взаимодействуют соли с металлами?
5. Как взаимодействуют соли с кислотами?
6. Как взаимодействуют соли с другими солями?
7. Какие способы получения солей вы знаете?
8. что называется генетической связью между классами неорганических соединений?
9. Какие соединения называются комплексными?
10. Приведите строение комплексного иона. Отметьте части комплексного соединения.
11. Определите степень окисления и координационное число комплексообразователя в соединениях: Cu2[Fe(CN)6], [Cr(NH3)4]SO4, [Cr(NH3)3CL3].
Задания для самоподготовки
Заполните таблицу:
| | Н2О
| Оксиды
| Соли
| Основания
| Кис-лоты
|
| Осно-вные
| Кисло-тные
| Амфо-терные
| Осно-вные
| Кис-лые
| Сред-ние
| Щело-чи
| Осно-вания
| Амфо-терные
|
| Немее-талл
| | | | | | | | | | | |
| металл
| | | | | | | | | | | |
| Н2О
| | | | | | | | | | | |
| Основ-
ной
оксид
| | | | | | | | | | | |
| Кисло-
тный
оксид
| | | | | | | | | | | |
| Амфо-
терный
оксид
| | | | | | | | | | | |
| Осно-вная
соль
| | | | | | | | | | | |
| Кислая
соль
| | | | | | | | | | | |
| Средняя
Соль
| | | | | | | | | | | |
| Щелочь
| | | | | | | | | | | |
| Осно-вание
| | | | | | | | | | | |
| Амфоте-рный
Гидро-ксид
| | | | | | | | | | | |
| Кис-лоты
| | | | | | | | | | | |
ОБЛАСТНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«СМОЛЕНСКИЙ БАЗОВЫЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
Учебно-методическое пособие для студентов по
подготовке к практическому занятию
Тема: «Растворы.







