Пример 10. Рассчитать массу осадка, который выделится при смешивании 200 мл раствора хлорида кальция ω(CaCl2) = 10%, ρ1 = 1,08 г/мл и 150 мл раствора фосфата натрия ω(Na3PO4) = 8%, ρ2 = 1,06 г/мл.
Решение:
CaCl2 + Na3PO4 → Ca3(PO4)2↓ + NaCl (схема реакции)
В соответствии с законом эквивалентов:
n( CaCl2) = n(
CaCl2) = n( Na3PO4) = n(
Na3PO4) = n( Ca3(PO4)2)
Ca3(PO4)2)
Масса выделившегося осадка будет равна:
m(Ca3(PO4)2) = n( Ca3(PO4)2)·
Ca3(PO4)2)·  ·M(Ca3(PO4)2)
·M(Ca3(PO4)2)
Рассчитываем n( CaCl2) и n(
CaCl2) и n( Na3PO4):
Na3PO4):
m(CaCl2) = ω(CaCl2)·V1·ρ1 = 0,1·200·1,08 = 21,6 г
n( CaCl2) =
CaCl2) =  =
=  = 0,389 моль
= 0,389 моль
m(Na3PO4) = ω(Na3PO4)·V2·ρ2 = 0,08·150·1,06 = 12,72 г
n( Na3PO4) =
Na3PO4) =  =
=  = 0,232 моль
= 0,232 моль
Из сравнения величин n( CaCl2) и n(
CaCl2) и n( Na3PO4) видно, что хлорид кальция взят в избытке. Отсюда все дальнейшие расчеты производят по Na3PO4:
Na3PO4) видно, что хлорид кальция взят в избытке. Отсюда все дальнейшие расчеты производят по Na3PO4:
n( Ca3(PO4)2) = n(
Ca3(PO4)2) = n( Na3PO4) = 0,232 моль
Na3PO4) = 0,232 моль
Рассчитываем массу осадка:
m(Ca3(PO4)2) = 0,232·  ·310,2 = 11,99 г
·310,2 = 11,99 г
Ответ: масса выпавшего осадка составляет 11,99 г.
Пример 11. Для осаждения ионов железа (II), содержащихся в 20 мл раствора FeSO4, израсходовано 30 мл раствора гидроксида калия, С(KOH) = 0,3 моль/л. Определить молярную и молярную концентрацию эквивалента раствора сульфата железа (II).
Решение:
Фактор эквивалентности FeSO4 = 
По закону эквивалентов:
n( FeSO4) = n(KOH)
FeSO4) = n(KOH)
n(KOH) = С(KOH)·V = 0,3·0,03 = 0,009 моль
Найдем молярную концентрацию эквивалента раствора FeSO4:
С( FeSO4) =
FeSO4) = 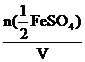 =
=  = 0,45 моль/л
= 0,45 моль/л
Найдем молярную концентрацию раствора FeSO4:
С(FeSO4) =  С(
С( FeSO4) =
FeSO4) =  = 0,225 моль/л
= 0,225 моль/л
Ответ: С(FeSO4) = 0,225 моль/л, С( FeSO4) = 0,45 моль/л.
FeSO4) = 0,45 моль/л.
2. 5. Задания для самостоятельной работы
1. Рассчитать концентрацию вещества (Х)%:
|
| Вариант
|
| а
| б
| в
| г
| д
|
| Вещество (Х)
| K2SO4
| CuCl2
| CuSO4·5H2O
| FeSO4·7H2O
| MgSO4·7H2O
|
| Объем р-ра, л
| 0,6
| 1,2
| 1,5
| 2,0
| 3,0
|
| m(X), г
|
|
|
|
|
|
2. Определить молярную концентрацию вещества (Х):
|
| Вариант
|
| а
| б
| в
| г
| д
|
| Вещество (Х)
| Н2SO4
| Н3РO4
| Са(ОН)2
| Na2SO4
| AgNO3
|
| ω(Х),%
|
|
|
|
|
|
| ρ, г/мл
| 1,14
| 1,10
| 1,08
| 1,05
| 1,01
|
3. Определить С(Х) и ω(Х) в растворе:
|
| Вариант
|
| а
| б
| в
| г
| д
|
| Вещество (Х)
| HCl
| H2S
| NH3
| SO2
| CO2
|
| Объем воды, л
|
|
|
|
|
|
| Объем вещества, л
|
|
|
|
|
|
| ρ, г/мл
| 1,01
| 1,03
| 1,05
| 1,038
| 1,02
|
4. Определить массу вещества (Х), содержащегося в растворе:
|
| Вариант
|
| а
| б
| в
| г
| д
|
| Вещество (Х)
| K2CrO4
| KMnO4
| Al2(SO4)3
| Н3РO4
| Н2SO4
|
| Объем р-ра, мл
|
|
|
|
|
|
| С(Х), моль/л
|
|
|
|
| 0,5
|
5. Определить объем растворенного HCl (н.у.):
|
| Вариант
|
| а
| б
| в
| г
| д
|
| Объем р-ра, мл
|
|
|
|
|
|
| С(Х), моль/л
| 0,2
| 0,5
| 0,75
| 1,2
| 1,5
|
6. Рассчитать объем концентрированного раствора KCl (л), который надо разбавить водой для приготовления определенного объема разбавленного раствора:
|
| Вариант
|
| а
| б
| в
| г
| д
|
| С1(KCl), моль/л
|
| 6,5
| 6,2
| 5,6
| 5,35
|
| V, мл
|
|
|
|
|
|
| С2(KCl), моль/л
| 3,5
| 2,75
| 2,5
| 2,25
| 1,8
|
7. До какого объема следует упарить разбавленный раствор НNO3, чтобы получить более концентрированный?
|
| Вариант
|
| а
| б
| в
| г
| д
|
| V1, мл
|
|
|
|
|
|
| С1(НNO3), моль/л
| 0,02
| 0,2
| 0,3
| 0,45
| 0,5
|
| С2(НNO3), моль/л
| 0,1
| 0,56
| 0,65
| 0,98
| 1,2
|
8. Смешали два раствора CuSO4 различной концентрации. Вычислить молярную концентрацию CuSO4 в полученном растворе (контракцией растворов можно пренебречь):
|
| Вариант
|
| а
| б
| в
| г
| д
|
| V1, мл
|
| 1,5
|
| 3,5
|
|
| С1(CuSO4), моль/л
| 0,2
| 0,32
| 0,45
| 0,68
| 0,72
|
| V2, мл
| 1,5
| 2,5
| 2,75
| 2,9
| 3,2
|
| С2(CuSO4), моль/л
|
|
|
|
|
|
| ρ2, г/мл
| 1,08
| 1,1
| 1,11
| 1,13
| 1,14
|
9. Определить молярную концентрацию раствора AlCl3, полученного смешиванием двух растворов с различной концентрацией AlCl3:
|
| Вариант
|
| а
| б
| в
| г
| д
|
| ω1(AlCl3), %
|
|
|
|
|
|
| V1, л
| 1,25
|
| 1,5
| 1,71
| 1,28
|
| ρ1, г/мл
| 1,15
| 1,13
| 1,14
| 1,12
| 1,16
|
| ω2(AlCl3), %
|
|
|
|
|
|
| V2, л
|
| 2,2
| 1,5
| 1,8
| 2,5
|
| ρ2, г/мл
| 1,32
| 1,28
| 1,33
| 1,38
| 1,35
|
| ρ, г/мл
| 1,22
| 1,20
| 1,23
| 1,24
| 1,25
|
10. Определить молярную концентрацию эквивалента вещества (Х):
|
| Вариант
|
| а
| б
| в
| г
| д
|
| Вещество (Х)
| K2SO4
| AlCl3
| Н3РO4
| Н2S
| НCl
|
| Масса, г
|
|
|
|
|
|
| V, л
|
|
|
|
|
|
11. Определить массу вещества, содержащегося в растворе:
|
| Вариант
|
| а
| б
| в
| г
| д
|
| Вещество (Х)
| NaCl
| MgSO4
| Al2(SO4)3
| FeSO4
| Ca(OH)2
|
| V, л
|
| 2,25
| 2,5
| 2,75
|
|
С( Х), моль/л Х), моль/л
| 1,25
| 1,5
| 1,75
|
| 2,25
|
12. Определить молярную концентрацию и молярную концентрацию эквивалента вещества (Х) в растворе:
|
| Вариант
|
| а
| б
| в
| г
| д
|
| Вещество (Х)
| LiCl
| Н2SO4
| Ba(OH)2
| AlCl3
| AgNO3
|
| ω(Х),%
|
|
|
|
|
|
| ρ, г/мл
| 1,1
| 1,16
| 1,08
| 1,12
| 1,14
|
13. До какого объема следует разбавить концентрированный раствор вещества (Х) для получения разбавленного раствора?
|
| Вариант
|
| а
| б
| в
| г
| д
|
| Вещество (Х)
| Н3PO4
| Ba(NO3)2
| Ca(OH)2
| Н2SO4
| HCl
|
| ω(Х),%
|
|
|
|
|
|
| ρ1, г/мл
| 1,3
| 1,18
| 1,08
| 1,732
| 1,152
|
| V1, мл
|
|
|
|
|
|
С( Х), моль/л Х), моль/л
|
| 0,5
| 0,2
|
| 0,7
|
14. До какого объема следует упарить разбавленный раствор Ca(NO3)2, чтобы получить более концентрированный раствор?
|
| Вариант
|
| а
| б
| в
| г
| д
|
| С1(Ca(NO3)2), моль/л
| 0,01
| 0,05
| 0,15
| 0,20
| 0,25
|
| V1, л
|
|
|
|
|
|
С2( Ca(NO3)2), моль/л Ca(NO3)2), моль/л
|
|
|
|
|
|
15. Смешали два раствора вещества (Х) различной концентрации. Определить молярную концентрацию и молярную концентрацию эквивалента вещества (Х) в полученном растворе (контракцией растворов можно пренебречь):
|
| Вариант
|
| а
| б
| в
| г
| д
|
| Вещество (Х)
| NaOH
| KOH
| CаCl2
| HNO3
| Н2SO4
|
| ω1(Х),%
|
|
|
|
|
|
| V1 р-ра, л
| 0,5
| 0,8
| 0,92
|
| 1,25
|
| ρ1, г/мл
| 1,332
| 1,176
| 1,158
| 1,225
| 1,503
|
| V2 р-ра, л
|
| 0,5
| 1,5
| 1,75
| 1,8
|
| С2(Х), моль/л
|
|
|
| 4,5
|
|
16. Определить молярную концентрацию эквивалента вещества BaCl2 в растворе, полученном при смешивании двух растворов BaCl2 различной концентрации:
|
| Вариант
|
| а
| б
| в
| г
| д
|
| ω1(BaCl2),%
|
|
|
|
|
|
| V1 р-ра, л
| 0,6
| 0,8
| 1,0
| 1,2
| 1,4
|
| ρ1, г/мл
| 1,2
| 1,22
| 1,24
| 1,26
| 1,28
|
| ω2(BaCl2),%
| 5,0
| 7,0
| 7,2
| 7,6
| 7,7
|
| V2 р-ра, л
| 1,2
| 1,4
| 1,6
| 1,8
| 2,0
|
| ρ2, г/мл
| 1,04
| 1,06
| 1,07
| 1,08
| 1,09
|
| ρ, г/мл
| 1,09
| 1,10
| 1,12
| 1,14
| 1,16
|
17. Какой объем раствора кислоты (Х) в литрах требуется для нейтрализации раствора КОН?
|
| Вариант
|
| а
| б
| в
| г
| д
|
| Вещество (Х)
| Н2SO4
| HNO3
| HCl
| Н3PO4
| Н2S
|
| ω(Х),%
|
|
|
|
| 0,6
|
| ρ, г/мл
| 1,5
| 1,18
| 1,07
| 1,06
| 1,03
|
| ω(КОН),%
|
|
|
|
|
|
| V р-ра, мл
|
|
|
|
|
|
| ρ, г/мл
| 1,41
| 1,29
| 1,18
| 1,12
| 1,08
|
18. Для нейтрализации определенного объема щелочи с заданной концентрацией потребовался соответствующий объем раствора кислоты. Определить молярную концентрацию эквивалента кислоты:
|
| Вариант
|
| а
| б
| в
| г
| д
|
| V щелочи, мл
|
|
|
|
|
|
С( щелочи) щелочи)
| 0,2
| 0,3
| 0,32
| 0,4
| 0,43
|
| V кислоты, мл
|
|
|
|
|
|
19. Какая масса CaCl2·6Н2О (г) требуется для осаждения сульфат-ионов из раствора Н2SO4?
|
| Вариант
|
| а
| б
| в
| г
| д
|
| ω(Н2SO4), %
|
|
|
|
|
|
| V, мл
|
|
|
|
|
|
| ρ, г/мл
| 1,069
| 1,083
| 1,098
| 1,112
| 1,127
|
Литература
1. Коровин Н. В. Общая химия. – М.: Высшая школа, 2002. – 558 с.
2. Никольский А. Б., Суворов А. В. Химия: Учебное пособие для вузов. – СПб.: Химиздат, 2001. – 512 с.
3. Глинка Н. Л. Задачи и упражнения по общей химии. – М.: Интеграл-Пресс, 2004. – 240 с.
4. Задачи и упражнения по общей химии: Учебное пособие / Б. И. Адамсон, О. Н. Гончарук, В. Н. Камышова и др. / Под ред. Н. В. Коровина. – М.: Высшая школа, 2003. – 255 с.
5. Суворов А. В., Никольский А. Б. Вопросы и задачи по общей химии. – СПб.: Химиздат, 2002. – 304 с.



 CaCl2) = n(
CaCl2) = n( Na3PO4) = n(
Na3PO4) = n( Ca3(PO4)2)
Ca3(PO4)2) =
=  = 0,389 моль
= 0,389 моль =
=  = 0,232 моль
= 0,232 моль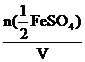 =
=  = 0,45 моль/л
= 0,45 моль/л = 0,225 моль/л
= 0,225 моль/л Х), моль/л
Х), моль/л



