Концентрации растворов
Методические указания к самостоятельной работе студентов
Великий Новгород
2006 г
Концентрации роастворов: Методические указания к самостоятельной работе студентов / Сост. В.П. Кузьмичева, Г.Н.Олисова, Н.И.Ульянова. – Великий Новгород: НовГУ, 2006.
СОДЕРЖАНИЕ
Стр.
1. Расчёт массовой доли растворённого вещества……………………………………………….4
1. 1. Вычисление массы растворённого вещества или растворителя по массе раствора…...5
1. 2. Вычисление массы раствора определённой концентрации по заданной массе растворённого вещества или растворителя……………………………………………………6
1. 3. Разбавление и концентрирование растворов…………………………………………….7
1. 4. Расчёты, связанные со смешиванием растворов………………………………………...9
1. 5. Задания для самостоятельной работы……………………………………………………11
2. Молярная концентрация………………………………………………………………………..14
2. 1. Определение молярной концентрации вещества С(Х) по массе вещества и массы вещества по заданной молярной концентрации………………………………………………15
2. 2. Расчёты, связанные с разбавлением и концентрированием растворов………………..17
2. 3. Расчёты, связанные со смешиванием растворов различной концентрации…………...17
2. 4. Расчёты материального баланса химических процессов: избыток (недостаток)
реагентов………………………………………………………………………………………...19
2. 5. Задания для самостоятельной работы……………………………………………………21
Литература…………………………………………………………………………………………25
1. Расчет массовой доли растворенного вещества
Пример 1. Вычислить массовую долю хлорида натрия в растворе, если 40 г его растворено в 280 мл воды.
Решение:
ω(NaCl) = 
Масса раствора m(р-ра) = m(NaCl) + m(H2O)
m(H2O) = V(H2O)·ρ(H2O) = 280 мл ·1 г/мл = 280 г,
ω(NaCl) =  = 0,125 или 12,5%
= 0,125 или 12,5%
Ответ: ω(NaCl) = 0,125 или 12,5%.
Пример 2. В 258,3 г воды растворили 41,7 г кристаллогидрата FeSO4·7H2O. Определить массовую долю FeSO4 в полученном растворе.
Решение:
ω(FeSO4) = 
Сначала рассчитываем массу раствора:
m(р-ра) = m(FeSO4·7H2O) + m(H2O) = 41,7 + 258,3 = 300 г
Далее определяем массу FeSO4:
m(FeSO4) = n(FeSO4)·m(FeSO4) = n(FeSO4·7H2O)·m(FeSO4) =
=  ·m(FeSO4) =
·m(FeSO4) =  = 22,8 г,
= 22,8 г,
ω(FeSO4) =  = 0,076 или 7,6%
= 0,076 или 7,6%
Ответ: ω(FeSO4) = 0,076 или 7,6%.
Пример 3. Определить массовую долю хлороводородной кислоты, если в 1 л воды растворили 350 л HCl (н.у.).
Решение:
ω(HCl) = 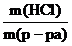
Массу HCl определяем по формуле:
m(HCl) = n(HCl)·m(HCl) =  ·m(HCl) =
·m(HCl) =  ·36,5 = 570,3 г.
·36,5 = 570,3 г.
Масса раствора m(р-ра) = m(HCl) + m(H2O) = m(HCl) + V(H2O)·ρ(H2O)
ω(HCl) =  = 0,363 или 36,3%
= 0,363 или 36,3%
Ответ: ω(HCl) = 0,363 или 36,3%.
Пример 4. Определите объем хлороводорода, измеренного при н.у., и объем воды, необходимые для приготовления 500 г раствора с массовой долей HCl 20%.
Решение:
Находим массу HCl:
m(HCl) = ω(HCl)·m(р-ра) = 0,2·500 = 100 г.
Рассчитываем объем HCl:
V(HCl) = n(HCl)·VM =  ·22,4 л/моль = 61,37 л.
·22,4 л/моль = 61,37 л.
Вычисляем m(H2O):
m(H2O) = m(р-ра) – m(HCl) = 500 – 100 = 400 г.
V(H2O) =  =
=  = 400 мл
= 400 мл
Ответ: V(HCl) = 61,37 л, V(H2O) = 400 мл.
Вычисление массы растворенного вещества
Или растворителя по массе раствора
Пример 5. Определите массу нитрата натрия и воды, необходимые для приготовления 800 г раствора с ω(NaNO3) = 12%.
Решение:
Масса растворенной соли:
m(NaNO3) = ω(NaNO3)·m(р-ра) = 0,12·800 = 96 г.
m(р-ра) = m(NaNO3) + m(H2O)
Отсюда
m(H2O) = m(р-ра) – m(NaNO3) = 800 – 96 = 704 г.
Ответ: m(NaNO3) = 96 г, m(H2O) = 704 г.
Пример 6. Определите массу кристаллогидрата CuSO4·5H2O и воды, необходимые для приготовления 0,4 кг раствора с ω(CuSO4) = 8%.
Решение (см. пример 2):
ω(CuSO4) =  =
= 
m(H2O) = m(р-ра) – m(CuSO4·5H2O)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·M(CuSO4·5H2O)
n(CuSO4·5H2O)·= n(CuSO4) = 
Находим
m(CuSO4) = ω(CuSO4)·m(р-ра) = 0,08·400 = 32 г.
n(CuSO4) =  = 0,2 моль.
= 0,2 моль.
Отсюда m(CuSO4·5H2O) = 0,2·250 = 50 г
Масса воды m(H2O) = 400 – 50 = 350 г
Ответ: m(CuSO4·5H2O) = 50 г, m(H2O) = 350 г.
Вычисление массы раствора определенной концентрации
Молярная концентрация
Молярная концентрация (молярность) – это количество моль вещества, содержащееся в 1 литре раствора.
С(Х) =  , моль/л
, моль/л
где Х – количество вещества, моль;
V – объем раствора, л.
Объем раствора связан с массой раствора следующим образом:
V =  , мл,
, мл,
где ρ – плотность раствора, г/мл.
Молярная концентрация эквивалента – это количество моль вещества эквивалента, содержащееся в 1 литре раствора.
С( Х) =
Х) =  , моль/л
, моль/л
где n( Х) – количество вещества эквивалента, моль;
Х) – количество вещества эквивалента, моль;
V – объем раствора, л.
n( Х) =
Х) =  =
= 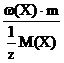
где m(X) – молярная масса растворенного вещества;
m(X) – масса растворенного вещества;
m – масса раствора;
ω(Х) – массовая доля раствора.
Молярная концентрация эквивалента всегда больше или равна молярной концентрации. Это положение используется при проверке полученных данных.
С( Х) =
Х) = 
Молярную концентрацию эквивалента часто называют нормальной и обозначают
1,0 н.; 0,5 н. и т.д.
Приведенные выше расчетные формулы позволяют определять объем раствора, количество вещества и количество вещества эквивалента:
V =  или V =
или V = 
n(X) = C(X)·V или n( X) = C(
X) = C( X)·V
X)·V
Литература
1. Коровин Н. В. Общая химия. – М.: Высшая школа, 2002. – 558 с.
2. Никольский А. Б., Суворов А. В. Химия: Учебное пособие для вузов. – СПб.: Химиздат, 2001. – 512 с.
3. Глинка Н. Л. Задачи и упражнения по общей химии. – М.: Интеграл-Пресс, 2004. – 240 с.
4. Задачи и упражнения по общей химии: Учебное пособие / Б. И. Адамсон, О. Н. Гончарук, В. Н. Камышова и др. / Под ред. Н. В. Коровина. – М.: Высшая школа, 2003. – 255 с.
5. Суворов А. В., Никольский А. Б. Вопросы и задачи по общей химии. – СПб.: Химиздат, 2002. – 304 с.
Концентрации растворов
Методические указания к самостоятельной работе студентов
Великий Новгород
2006 г
Концентрации роастворов: Методические указания к самостоятельной работе студентов / Сост. В.П. Кузьмичева, Г.Н.Олисова, Н.И.Ульянова. – Великий Новгород: НовГУ, 2006.
СОДЕРЖАНИЕ
Стр.
1. Расчёт массовой доли растворённого вещества……………………………………………….4
1. 1. Вычисление массы растворённого вещества или растворителя по массе раствора…...5
1. 2. Вычисление массы раствора определённой концентрации по заданной массе растворённого вещества или растворителя……………………………………………………6
1. 3. Разбавление и концентрирование растворов…………………………………………….7
1. 4. Расчёты, связанные со смешиванием растворов………………………………………...9
1. 5. Задания для самостоятельной работы……………………………………………………11
2. Молярная концентрация………………………………………………………………………..14
2. 1. Определение молярной концентрации вещества С(Х) по массе вещества и массы вещества по заданной молярной концентрации………………………………………………15
2. 2. Расчёты, связанные с разбавлением и концентрированием растворов………………..17
2. 3. Расчёты, связанные со смешиванием растворов различной концентрации…………...17
2. 4. Расчёты материального баланса химических процессов: избыток (недостаток)
реагентов………………………………………………………………………………………...19
2. 5. Задания для самостоятельной работы……………………………………………………21
Литература…………………………………………………………………………………………25
1. Расчет массовой доли растворенного вещества
Пример 1. Вычислить массовую долю хлорида натрия в растворе, если 40 г его растворено в 280 мл воды.
Решение:
ω(NaCl) = 
Масса раствора m(р-ра) = m(NaCl) + m(H2O)
m(H2O) = V(H2O)·ρ(H2O) = 280 мл ·1 г/мл = 280 г,
ω(NaCl) =  = 0,125 или 12,5%
= 0,125 или 12,5%
Ответ: ω(NaCl) = 0,125 или 12,5%.
Пример 2. В 258,3 г воды растворили 41,7 г кристаллогидрата FeSO4·7H2O. Определить массовую долю FeSO4 в полученном растворе.
Решение:
ω(FeSO4) = 
Сначала рассчитываем массу раствора:
m(р-ра) = m(FeSO4·7H2O) + m(H2O) = 41,7 + 258,3 = 300 г
Далее определяем массу FeSO4:
m(FeSO4) = n(FeSO4)·m(FeSO4) = n(FeSO4·7H2O)·m(FeSO4) =
=  ·m(FeSO4) =
·m(FeSO4) =  = 22,8 г,
= 22,8 г,
ω(FeSO4) =  = 0,076 или 7,6%
= 0,076 или 7,6%
Ответ: ω(FeSO4) = 0,076 или 7,6%.
Пример 3. Определить массовую долю хлороводородной кислоты, если в 1 л воды растворили 350 л HCl (н.у.).
Решение:
ω(HCl) = 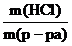
Массу HCl определяем по формуле:
m(HCl) = n(HCl)·m(HCl) =  ·m(HCl) =
·m(HCl) =  ·36,5 = 570,3 г.
·36,5 = 570,3 г.
Масса раствора m(р-ра) = m(HCl) + m(H2O) = m(HCl) + V(H2O)·ρ(H2O)
ω(HCl) =  = 0,363 или 36,3%
= 0,363 или 36,3%
Ответ: ω(HCl) = 0,363 или 36,3%.
Пример 4. Определите объем хлороводорода, измеренного при н.у., и объем воды, необходимые для приготовления 500 г раствора с массовой долей HCl 20%.
Решение:
Находим массу HCl:
m(HCl) = ω(HCl)·m(р-ра) = 0,2·500 = 100 г.
Рассчитываем объем HCl:
V(HCl) = n(HCl)·VM =  ·22,4 л/моль = 61,37 л.
·22,4 л/моль = 61,37 л.
Вычисляем m(H2O):
m(H2O) = m(р-ра) – m(HCl) = 500 – 100 = 400 г.
V(H2O) =  =
=  = 400 мл
= 400 мл
Ответ: V(HCl) = 61,37 л, V(H2O) = 400 мл.
Вычисление массы растворенного вещества




 = 0,125 или 12,5%
= 0,125 или 12,5%
 ·m(FeSO4) =
·m(FeSO4) =  = 22,8 г,
= 22,8 г, = 0,076 или 7,6%
= 0,076 или 7,6%
 ·m(HCl) =
·m(HCl) =  ·36,5 = 570,3 г.
·36,5 = 570,3 г. = 0,363 или 36,3%
= 0,363 или 36,3% ·22,4 л/моль = 61,37 л.
·22,4 л/моль = 61,37 л. =
=  = 400 мл
= 400 мл =
= 

 = 0,2 моль.
= 0,2 моль. , моль/л
, моль/л , мл,
, мл, Х) =
Х) =  , моль/л
, моль/л =
= 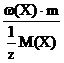

 или V =
или V = 



