Оптические методы анализа
Из методов спектроскопического анализа наиболее часто применяется группа методов оптического анализа, оперирующих с электромагнитным излучением оптического диапазона, включающим УФ–, видимое и ИК–излучение с длинами волн от 100 до 100000 нм.
Оптические методы делятся на оптическую атомную и оптическую молекулярную спектроскопию. В первом случае аналитические сигналы (испускание или поглощение излучения) являются следствием электронных переходов в атомах, во втором – в молекулах.
Оптические методы молекулярного анализа основаны на явлениях взаимодействия электромагнитного излучения оптического диапазона с молекулами вещества или испускания ими этого излучения.
Взаимодействие электромагнитного излучения оптического диапазона с веществом может носить различный характер. По типу взаимодействия с веществом методы оптического молекулярного анализа классифицируются следующим образом:
1. Методы, связанные с явлениями поляризации молекул вещества: рефрактометрия, интерферометрия, поляриметрия.
2. Методы, основанные на измерении поглощения веществом излучения, – абсорбционные методы: колориметрия, фотоколориметрия, спектрофотометрия.
3. Методы, основанные на измерении интенсивности света, излучаемого веществом, – эмиссионные методы: флуориметрия.
4. Методы, основанные на измерении интенсивности света, пропущенного или рассеянного суспензией вещества: нефелометрия, турбидиметрия.
Фотометрические методы анализа
Молекулярный абсорбционно-спектроскопический анализ (фотометрия) основан на избирательном поглощении (абсорбции) электромагнитного излучения молекулами или сложными ионами вещества в нерассеивающей излучение однородной среде. Это один из наиболее распространенных оптических методов.
Избирательный характер поглощения тесно связан с природой вещества, что позволяет на основе спектров поглощения (зависимость величин поглощения от длины волны излучения) проводить качественный анализ вещества. Зависимость между величиной поглощения монохроматического излучения и концентрацией вещества в растворе используется для количественного анализа.
Из методов молекулярного абсорбционного анализа можно выделить: колориметрию – сравнение окраски анализируемого и стандартного растворов вещества визуальным способом; фотоколориметрию (фотоэлектроколориметрию) – измерение интенсивности светового потока, прошедшего через раствор вещества, фотоэлектрическим способом; спектрофотометрию – измерение интенсивности монохроматического (определенной длины волны) светового потока, прошедшего через раствор вещества, фотоэлектрическим способом.
Фотоэлектрическая регистрация основана на преобразовании световой энергии в электрический сигнал.
В зависимости от диапазона длин волн применяемого электромагнитного излучения различают спектрофотометрию в ультрафиолетовой (УФ), видимой и инфракрасной (ИК) области спектра.
Наибольшее распространение получили фотометрические методы анализа, основанные на поглощении в видимой области спектра, т.е. в интервале длин волн 400-780 нм. Это объясняется возможностью получения множества интенсивно окрашенных органических и неорганических соединений, пригодных для их фотометрического определения в видимой области спектра с помощью достаточно несложных и относительно недорогих приборов.
Если анализируемое вещество не поглощает или слабо поглощает излучение в исследуемой спектральной области, то дополнительно проводят химическую реакцию, в результате которой образуется соединение, интенсивно поглощающее излучение. Такую реакцию называют фотометрической.
Абсорбционно-спектроскопический анализ обладает рядом достоинств: высокой избирательностью, низким пределом обнаружения, высокой чувствительностью, простотой измерения и быстротой выполнения анализа. Методики абсорбционно-спектроскопического анализа разработаны почти для всех химических элементов и очень многих органических соединений.
Каждый прибор для измерения светопоглощения включает источник излучения, устройство для выделения нужного интервала длин волн (монохроматор или светофильтр), кюветное отделение, детектор, преобразователь сигнала, индикатор сигнала (шкалу или цифровой датчик).
Фотоколориметрические методы используют сравнительно несложную аппаратуру, в которой необходимый интервал длин волн выделяется светофильтром. Фотоэлектроколориметры (ФЭКи) пригодны для измерений в видимой и ближней (до 300 нм) УФ-областях, они обеспечивают достаточную точность (погрешность определения составляет 1-3% отн.) и широко применяются для определения концентрации растворов.
В спектрофотометрических методах применяют более сложные приборы – спектрофотометры, в которых для монохроматизации излучения используют монохроматоры и которые часто снабжены электронными устройствами. Они позволяют проводить анализ в видимой, УФ– и ИК–областях спектра. Наиболее совершенные спектрофотометрические методы анализа характеризуются высокой точностью (погрешность определения 0,5 – 1 % отн.).
Электромагнитного излучения
При прохождении света через слой окрашенного вещества часть его отражается, часть поглощается и часть света проходит через слой вещества. Потеря света за счет рассеяния при работе с истинными растворами ничтожно мала.
Чтобы скомпенсировать потери энергии излучения за счет отражения, интенсивность потока излучения, прошедшего через кювету с поглощающим раствором, сравнивают с интенсивностью потока, прошедшего через такую же кювету с растворителем. Пользуются одинаковыми кюветами, для которых интенсивность отраженной части светового потока постоянна и мала. Ослабление света происходит главным образом за счет поглощения (абсорбции) световой энергии окрашенным раствором.
Пропускание (Т) – это отношение интенсивности излучения, прошедшего через раствор (I), к интенсивности излучения, падающего на раствор (Io):

Величину lg(Io /I) называют оптической плотностью и обозначают буквой А:

Величины Т и А измеряются непосредственно. В этих величинах проградуированы шкалы спектрохимических приборов. Величина Т может принимать значения от 0 до 1, или от 0 до 100%; величина А от 0 до бесконечности. Современные приборы позволяют измерять оптическую плотность от 0 до 2.
в основе большинства фотометрических методов анализа лежит объединенный закон светопоглощения Бугера–Ламберта–Бера.
Для практических целей удобна логарифмическая форма закона Бугера–Ламберта–Бера:
 )
)
где k – коэффициент поглощения.
Абсолютное значение коэффициента k зависит от способа выражения концентрации вещества в растворе и толщины поглощающего слоя.
Если концентрация выражена в моль/л, а толщина слоя в см, то коэффициент поглощения называется молярным коэффициентом поглощения и обозначается буквой e.
При соблюдении основного закона светопоглощения оптическая плотность раствора прямо пропорциональна молярному коэффициенту светопоглощения, молярной концентрации поглощающего вещества и толщине слоя раствора:

При графическом изображении зависимости оптической плотности от концентрации (при постоянном значении l) получается прямая линия.
Уравнения (1-3) выведены для монохроматического света. В фотоколориметрии измерение интенсивности световых потоков производят не в монохроматическом, а в полихроматическом свете, т.е. на довольно широком участке спектра – в интервале длин волн 20-100 нм. В этом случае в уравнение (3) вместо молярного коэффициента светопоглощения e следует подставлять значение среднего молярного коэффициента светопоглощения 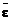 , зависящее от характеристики светофильтра.
, зависящее от характеристики светофильтра.
Если состав поглощающего вещества неизвестен, используют массовую концентрацию и тогда постоянную k обозначают через  и называют удельным коэффициентом светопоглощения.
и называют удельным коэффициентом светопоглощения.
Закон Бугера-Ламберта соблюдается во всех случаях. Закон Бера соблюдается только для разбавленных растворов с концентрацией менее 0,01 моль/л. Отклонения от закона Бера могут быть вызваны немонохроматичностью излучения или участием поглощающего излучение вещества в процессах, конкурентных фотометрической реакции (в процессах диссоциации, ассоциации, гидролиза, комплексообразования и др.).
При отсутствии взаимодействия между поглощающими веществами и при выполнении законов светопоглощения поглощение (оптическая плотность) раствора равно сумме поглощений (оптических плотностей) каждого компонента смеси при той же длине волны:
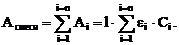
Это соотношение выражает закон аддитивности. Соблюдение этого закона является обязательным условием абсорбционно-спектроскопического анализа многокомпонентных систем.
Фотометрических реакций
Выбор спектральной области
Чувствительность и погрешность фотометрического определения зависят от выбранного интервала длин волн поглощаемого света. Оптимальная спектральная область, в которой проводят фотометрические измерения, определяется спектрами поглощения фотометрируемого комплекса и применяемого реагента.
Если спектры фотометрируемого комплекса и применяемого реагента не перекрываются, то измерение оптической плотности фотометрируемого раствора желательно производить в той области спектра, в которой поглощение света определяемым соединением является максимальным.
Фотометрическое определение при перекрывании спектров комплекса и реагента проводят в области оптимального поглощения, т.е. в том интервале длин волн (или при такой длине волны), где наблюдается максимальная разность ∆e комплекса и реагента.
Растворы сравнения
Точная оценка абсолютных значений интенсивностей падающего и проходящего через раствор излучения связана с большими экспериментальными трудностями. Поэтому поглощение испытуемого раствора измеряют относительно так называемого раствора сравнения. Если в испытуемом растворе поглощает только одно определяемое вещество, то в качестве раствора сравнения берут чистый растворитель.
Если, кроме определяемого вещества, поглощают и другие компоненты раствора, то раствор сравнения должен содержать все эти компоненты, что и в анализируемом растворе, но без определяемого вещества.
Фотометрические методы определения
Метод одного стандарта
Если заранее известно, что градуировочный график линеен, то можно использовать метод одного стандарта.
В этом случае готовят один эталонный раствор, концентрация определяемого вещества в котором близка к концентрации этого вещества в испытуемом растворе.
Измеряют поглощение того и другого раствора и рассчитывают неизвестную концентрацию по формуле:

Метод определения концентрации по величине молярного
коэффициента светопоглощения
Если величина молярного или удельного коэффициента светопоглощения известна заранее, то измеряют поглощение анализируемого раствора при той длине волны, для которой известна величина e или  , и рассчитывают неизвестную концентрацию по формулам:
, и рассчитывают неизвестную концентрацию по формулам:
 моль/л,
моль/л,
Дифференциальная фотометрия
При определении поглощения интенсивно окрашенных растворов с А > 1, соответствующих высокому содержанию определяемого вещества в растворе, погрешность определения концентрации будет велика. Ее можно уменьшить, используя метод дифференциальной фотометрии. В отличие от обычной фотометрии в качестве раствора сравнения в этом методе используют не растворитель, а раствор определяемого вещества с известной концентрацией. При этом концентрация поглощающего вещества в растворе сравнения близка к его концентрации в фотометрируемом растворе. Оптический нуль фотометра по шкале поглощений (А = 0, Т = 100%) устанавливают по раствору сравнения. Обычно таким раствором сравнения является один из эталонных растворов. Выполняя измерение оптической плотности фотометрируемого раствора относительно этого эталонного раствора, может быть достигнуто расширение фотометрической шкалы и уменьшение погрешности измерения поглощения..
Неизвестную концентрацию Сх находят либо методом градуировочного графика, либо расчетным путем. Градуировочный график не проходит через начало координат, а исходит из точки на оси концентраций, соответствующей концентрации определяемого вещества в растворе сравнения.
Результат определения может быть найден также с помощью формул:

где Ах и Аst - поглощение анализируемого и стандартного растворов, измеренное относительно раствора сравнения с концентрацией Со;
F - фактор пересчета, который определяют экспериментально из 5-7 стандартных растворов и берут среднее из полученных значений.
По фотометрическому анализу
1. Прежде, чем приступить к выполнению лабораторной работы, необходимо внимательно прочитать методические указания по выполняемой работе, познакомиться с описанием прибора и порядком выполнения измерений на нем по соответствующим разделам настоящего руководства и инструкциям к приборам.
2. Строго следовать методике приготовления растворов. Особенно важно соблюдать указанный порядок прибавления реагентов.
3. Конечные объемы эталонных и испытуемых растворов должны быть строго одинаковыми, поэтому готовят их, как правило, в мерных колбах.
4. Объем стандартного раствора для приготовления эталонных растворов следует измерять с максимальной точностью (бюреткой или пипеткой).
5. Кюветы, в которых проводят измерение интенсивности поглощения, должны быть чистыми. Их обычно обрабатывают концентрированной хлороводородной кислотой, промывают проточной водой, ополаскивают дистиллированной водой и насухо вытирают снаружи. Перед заполнением кювету ополаскивают небольшой порцией испытуемого раствора во избежание его разбавления. При работе с органическими растворителями, не смешивающимися с водой, кюветы перед заполнением ополаскивают спиртом или ацетоном и высушивают струей воздуха с помощью резиновой груши.
6. Кюветы заполняют до такого уровня, чтобы поток излучения целиком проходил через слой раствора и устанавливают в кюветное отделение всегда в строго определенном положении. Это позволяет избежать ошибок, связанных с неодинаковым отражением и рассеянием излучения.
7. Приборы следует включать не позже, чем за 15-20 мин до начала работы, для прогревания источников излучения и усилителей.
8. Измерение на приборе проводят 2-3 раза до получения воспроизводимых результатов.
9. По окончании работы прибор необходимо выключить, как указано в инструкции, и тщательно вымыть кюветы.
Лабораторная работа
Ход работы
1. В 5 мерных колб емкостью 50,0 мл градуированной пипеткой емкостью 10,00 или 5,00 мл поместите последовательно 0,50; 1,00; 1,50; 2,00; 2,50 мл стандартного раствора соли титана (IV), содержащего 1,0 мг титана в 1 мл. Затем в каждую колбу добавьте по 20 мл воды, по 5 мл раствора серной кислоты (1:1) и по 5 мл 3% раствора пероксида водорода, доведите водой до метки и тщательно перемешайте.
2. Рассчитайте титр Тi(Ti) и молярную концентрацию Сi(Ti(IV)) полученных эталонных растворов.
3. К полученному у лаборанта анализируемому раствору в мерной колбе емкостью 50,0 мл добавьте по 20 мл воды, по 5 мл раствора серной кислоты (1:1) и по 5 мл 3% раствора пероксида водорода. Доведите объем до метки водой и тщательно перемешайте.
Вопросы для защиты лабораторной работы
1. Какие методы относятся к молекулярному абсорбционному анализу?
2. Какая реакция называется фотометрической?
3. Что такое оптическая плотность раствора?
4. Как связаны оптическая плотность А и пропускание Т?
5. Какой закон лежит в основе фотометрических методов анализа?
6. Что характеризует молярный коэффициент поглощения, удельный коэффициент поглощения?
7. Каковы причины отклонения от основного закона светопоглощения?
8. Какие правила необходимо соблюдать при фотометрировании?
9. Какими методами рассчитывается концентрация определяемого вещества при фотометрическом анализе?
10. Какие вещества могут быть определены фотометрией?
Лабораторная работа
Вопросы для защиты лабораторной работы
1. В чем состоит принципиальное отличие дифференциальной фотометрии от непосредственной фотометрии?
2. Что такое фактор пересчета и каково его математическое выражение?
3. Какой вид имеет градуировочные график в методе дифференциальной фотометрии?
4. В каких случаях используются метод дифференциальной фотометрии?
5. Что используют в качестве раствора сравнения в дифференциальной фотометрии?
6. Приведите формулу для расчета концентрации определяемого вещества в дифференциальной фотометрии.
7. Напишите реакцию, которая лежит в основе определения меди (II) дифференциальным методом.
Оптические методы анализа
Из методов спектроскопического анализа наиболее часто применяется группа методов оптического анализа, оперирующих с электромагнитным излучением оптического диапазона, включающим УФ–, видимое и ИК–излучение с длинами волн от 100 до 100000 нм.
Оптические методы делятся на оптическую атомную и оптическую молекулярную спектроскопию. В первом случае аналитические сигналы (испускание или поглощение излучения) являются следствием электронных переходов в атомах, во втором – в молекулах.
Оптические методы молекулярного анализа основаны на явлениях взаимодействия электромагнитного излучения оптического диапазона с молекулами вещества или испускания ими этого излучения.
Взаимодействие электромагнитного излучения оптического диапазона с веществом может носить различный характер. По типу взаимодействия с веществом методы оптического молекулярного анализа классифицируются следующим образом:
1. Методы, связанные с явлениями поляризации молекул вещества: рефрактометрия, интерферометрия, поляриметрия.
2. Методы, основанные на измерении поглощения веществом излучения, – абсорбционные методы: колориметрия, фотоколориметрия, спектрофотометрия.
3. Методы, основанные на измерении интенсивности света, излучаемого веществом, – эмиссионные методы: флуориметрия.
4. Методы, основанные на измерении интенсивности света, пропущенного или рассеянного суспензией вещества: нефелометрия, турбидиметрия.
Фотометрические методы анализа
Молекулярный абсорбционно-спектроскопический анализ (фотометрия) основан на избирательном поглощении (абсорбции) электромагнитного излучения молекулами или сложными ионами вещества в нерассеивающей излучение однородной среде. Это один из наиболее распространенных оптических методов.
Избирательный характер поглощения тесно связан с природой вещества, что позволяет на основе спектров поглощения (зависимость величин поглощения от длины волны излучения) проводить качественный анализ вещества. Зависимость между величиной поглощения монохроматического излучения и концентрацией вещества в растворе используется для количественного анализа.
Из методов молекулярного абсорбционного анализа можно выделить: колориметрию – сравнение окраски анализируемого и стандартного растворов вещества визуальным способом; фотоколориметрию (фотоэлектроколориметрию) – измерение интенсивности светового потока, прошедшего через раствор вещества, фотоэлектрическим способом; спектрофотометрию – измерение интенсивности монохроматического (определенной длины волны) светового потока, прошедшего через раствор вещества, фотоэлектрическим способом.
Фотоэлектрическая регистрация основана на преобразовании световой энергии в электрический сигнал.
В зависимости от диапазона длин волн применяемого электромагнитного излучения различают спектрофотометрию в ультрафиолетовой (УФ), видимой и инфракрасной (ИК) области спектра.
Наибольшее распространение получили фотометрические методы анализа, основанные на поглощении в видимой области спектра, т.е. в интервале длин волн 400-780 нм. Это объясняется возможностью получения множества интенсивно окрашенных органических и неорганических соединений, пригодных для их фотометрического определения в видимой области спектра с помощью достаточно несложных и относительно недорогих приборов.
Если анализируемое вещество не поглощает или слабо поглощает излучение в исследуемой спектральной области, то дополнительно проводят химическую реакцию, в результате которой образуется соединение, интенсивно поглощающее излучение. Такую реакцию называют фотометрической.
Абсорбционно-спектроскопический анализ обладает рядом достоинств: высокой избирательностью, низким пределом обнаружения, высокой чувствительностью, простотой измерения и быстротой выполнения анализа. Методики абсорбционно-спектроскопического анализа разработаны почти для всех химических элементов и очень многих органических соединений.
Каждый прибор для измерения светопоглощения включает источник излучения, устройство для выделения нужного интервала длин волн (монохроматор или светофильтр), кюветное отделение, детектор, преобразователь сигнала, индикатор сигнала (шкалу или цифровой датчик).
Фотоколориметрические методы используют сравнительно несложную аппаратуру, в которой необходимый интервал длин волн выделяется светофильтром. Фотоэлектроколориметры (ФЭКи) пригодны для измерений в видимой и ближней (до 300 нм) УФ-областях, они обеспечивают достаточную точность (погрешность определения составляет 1-3% отн.) и широко применяются для определения концентрации растворов.
В спектрофотометрических методах применяют более сложные приборы – спектрофотометры, в которых для монохроматизации излучения используют монохроматоры и которые часто снабжены электронными устройствами. Они позволяют проводить анализ в видимой, УФ– и ИК–областях спектра. Наиболее совершенные спектрофотометрические методы анализа характеризуются высокой точностью (погрешность определения 0,5 – 1 % отн.).
Основные величины и законы поглощения
Электромагнитного излучения
При прохождении света через слой окрашенного вещества часть его отражается, часть поглощается и часть света проходит через слой вещества. Потеря света за счет рассеяния при работе с истинными растворами ничтожно мала.
Чтобы скомпенсировать потери энергии излучения за счет отражения, интенсивность потока излучения, прошедшего через кювету с поглощающим раствором, сравнивают с интенсивностью потока, прошедшего через такую же кювету с растворителем. Пользуются одинаковыми кюветами, для которых интенсивность отраженной части светового потока постоянна и мала. Ослабление света происходит главным образом за счет поглощения (абсорбции) световой энергии окрашенным раствором.
Пропускание (Т) – это отношение интенсивности излучения, прошедшего через раствор (I), к интенсивности излучения, падающего на раствор (Io):

Величину lg(Io /I) называют оптической плотностью и обозначают буквой А:

Величины Т и А измеряются непосредственно. В этих величинах проградуированы шкалы спектрохимических приборов. Величина Т может принимать значения от 0 до 1, или от 0 до 100%; величина А от 0 до бесконечности. Современные приборы позволяют измерять оптическую плотность от 0 до 2.
в основе большинства фотометрических методов анализа лежит объединенный закон светопоглощения Бугера–Ламберта–Бера.
Для практических целей удобна логарифмическая форма закона Бугера–Ламберта–Бера:
 )
)
где k – коэффициент поглощения.
Абсолютное значение коэффициента k зависит от способа выражения концентрации вещества в растворе и толщины поглощающего слоя.
Если концентрация выражена в моль/л, а толщина слоя в см, то коэффициент поглощения называется молярным коэффициентом поглощения и обозначается буквой e.
При соблюдении основного закона светопоглощения оптическая плотность раствора прямо пропорциональна молярному коэффициенту светопоглощения, молярной концентрации поглощающего вещества и толщине слоя раствора:

При графическом изображении зависимости оптической плотности от концентрации (при постоянном значении l) получается прямая линия.
Уравнения (1-3) выведены для монохроматического света. В фотоколориметрии измерение интенсивности световых потоков производят не в монохроматическом, а в полихроматическом свете, т.е. на довольно широком участке спектра – в интервале длин волн 20-100 нм. В этом случае в уравнение (3) вместо молярного коэффициента светопоглощения e следует подставлять значение среднего молярного коэффициента светопоглощения 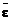 , зависящее от характеристики светофильтра.
, зависящее от характеристики светофильтра.
Если состав поглощающего вещества неизвестен, используют массовую концентрацию и тогда постоянную k обозначают через  и называют удельным коэффициентом светопоглощения.
и называют удельным коэффициентом светопоглощения.
Закон Бугера-Ламберта соблюдается во всех случаях. Закон Бера соблюдается только для разбавленных растворов с концентрацией менее 0,01 моль/л. Отклонения от закона Бера могут быть вызваны немонохроматичностью излучения или участием поглощающего излучение вещества в процессах, конкурентных фотометрической реакции (в процессах диссоциации, ассоциации, гидролиза, комплексообразования и др.).
При отсутствии взаимодействия между поглощающими веществами и при выполнении законов светопоглощения поглощение (оптическая плотность) раствора равно сумме поглощений (оптических плотностей) каждого компонента смеси при той же длине волны:
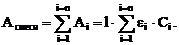
Это соотношение выражает закон аддитивности. Соблюдение этого закона является обязательным условием абсорбционно-спектроскопического анализа многокомпонентных систем.





 )
)
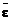 , зависящее от характеристики светофильтра.
, зависящее от характеристики светофильтра. и называют удельным коэффициентом светопоглощения.
и называют удельным коэффициентом светопоглощения.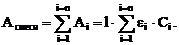

 , и рассчитывают неизвестную концентрацию по формулам:
, и рассчитывают неизвестную концентрацию по формулам: моль/л,
моль/л,


