

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...
Топ:
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Интересное:
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Дисциплины:
|
из
5.00
|
Заказать работу |
Лаки – это растворы пленкообразующих веществ в растворителях (или воде), которые после высыхания образуют однородное, твердое, прозрачное (кроме битумного лака) покрытие. Их состав не содержит пигменты и наполнители.
Краски – суспензии пигментов в пленкообразующих веществах, которые после высыхания образуют непрозрачное однородное покрытие.
Эмаль – суспензия пигментов, наполнителей в лаке, которая после высыхания образует непрозрачное, твердое покрытие различной структуры и блеска.
Грунтовка – суспензия пигментов с наполнителями в пленкообразующем веществе, которая после высыхания образует однородную непрозрачную пленку.
Шпаклевка – смесь наполнителей, пигментов и пленкообразующих веществ, пастообразная вязкая масса, предназначена для заполнения дефектов поверхности, придания ей равномерной.
42. Сущность электролизных процессов. Схема электролизной установки. Заряды анода и катода. Анодные и катодные процессы
Электролиз – совокупность ОВР протекающих на электродах при пропускании постоянного электрического тока через раствор или расплав электролита.
Электролиз – вынужденный процесс. При включении генератора происходит перекачка электронов на катод.
При прохождении тока через расплав катионы под воздействием электрического поля движутся к отрицательному электроду. Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются. Анод – электрод, на котором происходит процесс окисления. Анод имеет положительный заряд (+)
Катод – электрод, на котором происходит процесс восстановления. Катод имеет отрицательный заряд (-). Три группы катионов:
1)  Катионы
Катионы  . Данные катионы всегда восстанавливаются из водных р-ров.
. Данные катионы всегда восстанавливаются из водных р-ров.
2) Металлы  . Восстанавливаются из водных растворов, но в некоторых случаях может идти процесс восстановления воды.
. Восстанавливаются из водных растворов, но в некоторых случаях может идти процесс восстановления воды.
3) Металлы 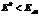 . Никогда не восстанавливаются из водных растворов. Всегда идет процесс восстановления воды. Данные металлы можно выделить только путем электролиза расплавов.
. Никогда не восстанавливаются из водных растворов. Всегда идет процесс восстановления воды. Данные металлы можно выделить только путем электролиза расплавов.

 - восстановление воды
- восстановление воды
P.S. Рассматривая катодные процессы, протекающие при электролизе водных растворов, ограничимся важнейшим случаем — катодным восстановлением, приводящим к выделению элементов в свободном состоянии. Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода и имеет значение  В. Поэтому, если катионом электролита является металл, электродный потенциал значительно более отрицательный, чем —0,41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений — приблизительно до титана. Последовательность разрядки ионов на катоде: Легче всего из раствора восстановить частицы стандартных электронных потенциалов
В. Поэтому, если катионом электролита является металл, электродный потенциал значительно более отрицательный, чем —0,41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений — приблизительно до титана. Последовательность разрядки ионов на катоде: Легче всего из раствора восстановить частицы стандартных электронных потенциалов  , который имеет наибольшее значение.
, который имеет наибольшее значение.
Анод – электрод, на котором происходит процесс окисления. Анод имеет положительныйзаряд(+).
Существуют две группы катионов:
1) Бескислородные ( ) При электролизе они окисляются с образованием простых веществ.
) При электролизе они окисляются с образованием простых веществ.
2) Кислородосодержащие. Из растворов на аноде они никогда не окисляются. Идет процесс окисления воды.
Анодные процессы, протекающие при электролизе второй группы катионов металлов:

 - окисление воды
- окисление воды
Легче всего на аноде окисляются частицы  которых наименьшее значение.
которых наименьшее значение.
Типы анодов:
1) Инертный (анод, материал которого не претерпевает окисления в ходе электролиза)
2) Активный (анод, материал которого может окисляться в ходе электролиза).
43. Электролиз рас-ов электро-та. Вода как активный реагент. Катодные процессы. Последов-ть разрядки ионов на катоде. Три группы катионов(примеры, ур-я р-й)
При электролизе р-ов, вода – активный реагент. 2Н2О-4е-4Н+ +О2 (А)
2Н2О+2е – 2ОН- +Н2 (К)
Меn+ +Аn- - Ме0 +Аn0
Рассматривая катодные процессы, протекающие при электролизе водных растворов, ограничимся важнейшим случаем — катодным восстановлением, приводящим к выделению элементов в свободном состоянии. Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода и имеет значение  В. Поэтому, если катионом электролита является металл, электродный потенциал значительно более отрицательный, чем —0,41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений — приблизительно до титана.
В. Поэтому, если катионом электролита является металл, электродный потенциал значительно более отрицательный, чем —0,41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений — приблизительно до титана.
Последовательность разрядки ионов на катоде: Легче всего из раствора восстановить частицы стандартных электронных потенциалов  , который имеет наибольшее значение.
, который имеет наибольшее значение.
Электролиз –вынужденный процесс. Электролиз – совокупность электрохим. ОВПроцессов, которые протекают на электродах при пропускании пост.-го э. тока через р-р эл-та. Катод – электрод, на котором происходит процесс восстановления. Катод имеет отрицательный заряд (-)
Три группы катионов:
1) Катионы  . Данные катионы всегда восстанавливаются из водных р-ров.
. Данные катионы всегда восстанавливаются из водных р-ров.
2) Металлы  . Восстанавливаются из водных растворов, но в некоторых случаях может идти процесс восстановления воды.
. Восстанавливаются из водных растворов, но в некоторых случаях может идти процесс восстановления воды.
3) Металлы  . Никогда не восстанавливаются из водных растворов. Всегда идет процесс восстановления воды. Данные металлы можно выделить только путем электролиза расплавов.
. Никогда не восстанавливаются из водных растворов. Всегда идет процесс восстановления воды. Данные металлы можно выделить только путем электролиза расплавов.

 - восстановление воды
- восстановление воды
44. Анодные процессы при электролизе растворов электролитов. Последов-ть разрядки ионов на аноде. Типы анодов. Особен-ть электродных процессов с испол-ем активного анода (привести примеры, составить ур-ия реакций)
Различают активные и инертные аноды. Активные аноды выполняют из различные металлов. Легче всего на аноде окисляются те частицы, которые имеют наименьший E0min.
 Анодные процессы. Различают активные и инертные аноды. Легче всего на аноде окисляются те частицы которые имеют найменьший стандартный электродный потенциал.
Анодные процессы. Различают активные и инертные аноды. Легче всего на аноде окисляются те частицы которые имеют найменьший стандартный электродный потенциал.
(А) Е0мин
а) Ео н2о(г) >EoAnn-
An - - ne→ An o
Окисление аниона
(Инертный анод)
б) Ео н2о(г) < EoAnn-
Ео н2о(г) = 1,23; EoAnn- = x
2H2O – 4e→4H++O2↑
Окисление воды

Активный
(Ме)
↓
Cu
EoMe/Men+ - min
Meo - ne→ Men+
(Cuo – 2e→ Cu2+)
45. Сущность электролизных процессов. Электролиз расплавов электролитов (привести примеры, составить уравнения реакций). Законы электролиза. Постоянная Фарадея
Электролиз расплавов электролитов - важный способ производства многих металлов. Так, например, алюминий-сырец получают электролизом криолит-глиноземного расплава (Na3AlF6 + Al2O3), очистку сырца осуществляют электролитическим рафинированием. При этом анодом служит расплав Аl, содержащий до 35% Сu (для утяжеления) и потому находящийся на дне ванны электролизера. Средний жидкий слой ванны содержит ВаСl2, AlF3 и NaF, a верхний - расплавленный рафинированный Аl и служит катодом.
Электролиз расплава хлорида магния или обезвоженного карналлита - наиболее распространенный способ получения Mg. В промышленном масштабе электролиз расплавов используют для получения щелочных и щелочно-земельных металлов, Be, Ti, W, Mo, Zr, U и др.
Электролиз расплавов электролитов.

Электролиз расплава соли с использованием инертных электродов показан на следующей схеме:
При высоких температурах расплав соли диссоциирует на ионы:
 .
.
Прохождение электрического тока через расплав обусловлено тремя одновременно протекающими процессами:
направленное движение катионов Мg2+ к катоду, а анионов Cl- - к аноду;
восстановление, происходящее на катоде:

окисление, происходящее на аноде:

Суммарное уравнение электролиза после уравнивания числа отдаваемых и присоединенных электронов принимает вид:

Схематически весь процесс можно представить следующим образом:

Катод (-) Анод (+)
Mg2+ 2Cl-
Mg2+ + 2e- = Mg 2Cl- - 2e- = Cl2

Законы Электролиза:
1 закон Фарадея: Масса вещества, выделяемого при электролизе прямо пропорциональна силе тока и времени электролиза, то есть кол-ву электричества: Q=I*t, пропущенного через раствор или расплав электролита и не зависит ни от каких других факторов.
2 закон Фарадея: Равное кол-во электричества выделяют при электролизе из различных хим-их соед-ий эквивалентные кол-ва веществ. Для выделения одного эквивалента любого вещества необходимо пропустить F=96500 Кл. F – постоянная Фарадея.
2 закона Фарадея объединены одним уравнением: m=(Эm/F)*Q = (Эm/F)*I*t,
где m – масса вещества, которая выделяется при электролизе
Эm – эквивалентная масса этого вещества
Эm/F – электрохимический эквивалент
Q – количество электричества

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!