Комплексные соединения – это соединения высшего порядка, которые сопровождаются возникновением новых ионов, достаточно устойчивых в водных соединениях.
Основные положения теории Вернера:
*Большая часть хим. элементов может выступать в качестве комплексообразователя, проявляя два типа валентности: основную (соотв. Степени окисления), побочную (координац. числу).
*Комплексообразователь стремится к насыщению и главной и побочной валентности.
Главная насыщается только ионами, а побочная анионами и нейтр. молекулами.
*КС характеризуются определенной геометрической формой
В КС обязательно присутствует донорно-окцепторная связь.
Донорно-окцепторная связь – это реакция
 :А + В → А: В
:А + В → А: В
донор акц. д/а связь
осуществляемая за счет неподельной пары электронов одной частицы и свободной орбитали другой частицы.
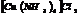
д/а связь ион. связь
Строение комплексных соединений: комплексообразователь, лиганды, координационное число и т.д. на конкретном примере.
Строение КС.

 -противоион (ион внешней сферы), 4-кол-во. Лиганд,
-противоион (ион внешней сферы), 4-кол-во. Лиганд,  -лиганды.
-лиганды.
 - компл. обр-ль.
- компл. обр-ль.
В центре молекулы КС находится центральный атом – комплексообразователь.Координационное число
: От заряда и радиуса компл-образ. Чем эти величины больше, тем больше леганд может разместится возле компл-образ. от заряда и радиуса лиганд и чем менше эти показатели тем больше лиганд может принять компл-образ. Компл-образ. и лиганды образуют комплексный ион устойчивый в водных растворах.
Ихомерия кс:
*1 тип-ионная изомерия.Она обусловлена способностью нек.ионов и нейтральных молекул входить во внутр.так и во внешнюю реду
*2тип-кординационная.Встречается в бикомплексных соед-ях.И катион и анион-компл.ионы.
*3тип-оптическая изомерия.Такие изомеры имеют один.состав и строение и явл.зеркальным изображением друг друга.
29. Комплексн. соед.(КС)-соед. высшего порядка, образ. кот-ых сопровожд-ся возникновен. новых ионов, достаточно устойчивых в КС. КС диссоциир. в 2 ступени. Первоночально при растворении в воде происход. его дисс. на комплексн ион и противоион. Дисс. протек. по типу сильн. эл-литов, т. е. это необратимый проц. На 2-ой ступени комплексн. ион дисс. по типу слаб. эл-литов, т.е. это обратимый проц. 1.Катион [Cu (NH3)4] Cl2→[Cu (NH3)4]2++2Cl-
2. [Cu (NH3)4]2+↔Cu2++4NH30
1.Анион K3[Fe(CN)6]→3K++[Fe(CN)6]3-
2. [Fe(CN)6]3-↔Fe3++6CN-
-3=Х+6(-1); Х=+3
Кх.р.=  =Kн -только для равновесн. сист-мы (↔)
=Kн -только для равновесн. сист-мы (↔)
Примеры наменклатуры КС: K3[Fe(CN  ]-гексоцианоферрат (II)калия; [Ag(NH3)2]Cl-хлорид диаминсеребра(I); [Cr(H2O)3F3]-трифторотриаквахром; [СO(NH3)3(NO2)2Cl]-хлородинитритотриамминкобальт.
]-гексоцианоферрат (II)калия; [Ag(NH3)2]Cl-хлорид диаминсеребра(I); [Cr(H2O)3F3]-трифторотриаквахром; [СO(NH3)3(NO2)2Cl]-хлородинитритотриамминкобальт.
Константа нестойкости комплексного иона (Кн)- мера стабильности комплексного иона (справочная величина). Чем больше Кн,тем менее устойчив компл. ион. в водн. р-ре.
30. ОВР -хим. р-ция, протек. с измен. степени окислен. одного или неск. эл-тов, входящ. в сост. реагир. в-в. Ок-ние -проц. отдачи эл-нов, сопровожд. повышением ст. ок. эл-та. В-ние -проц. присоединен. эл-нов, сопровожд. понижением ст. ок. эл-та. Степ. ок-ния -заряд, кот. преобрёл бы атом, если бы все эл-нные пары в хим. соед. сместились бы в стор. атомов более электроотриц. эл-тов. В-ль -в-во, в сост. кот. вход.окисляющийся эл-т, а в-во, содерж. востанавливающий эл-т- о-ль. Правила расчёта степ. ок-ния: 1.Степ. ок-ния эл-та в прост. в-ве =0. 2. Мол-ла хим. соед. электронейтральна. 3. Ряд эл-тов им. постоян. ст. ок.: Н+. Искл. гидриты Ме:Са+2Н2-,Na+H-. О2 -. Искл. О2+F2-, H2+O2-, пероксиды Ме. F-. У щелочн. Ме = +1. У щел-земельн. Ме =+2. 4. У Ме только положительн. ст. ок. Сумма степеней ок. всех атомов в мол-ле =0. Высшая ст. ок.=№ группы эл-та в периодич. сист. Искл. F, O2, He, Ne, Ar (у них меньше, чем № гр.), эл-ты подгр. меди(у них ст. ок. больше, чем № гр.)
31. О-ль содерж. в своем сост. эл-т, понижающий степ. своей окисл., а в-ль содерж. эл--т, ст. ок. кот. повышается в ходе р-ции. Сл., ок-лями могут быть прежде всего соед. высших, а в-лями — низших ст. ок., присущих данн. эл-ту. Ме проявл. в своих соед. только положительн. окисленность, и низшая их ст. ок.=0. Все свободные Ме способны проявл. только восстановительн. св-ва. На практике в кач-ве в-лей примен. Al,Mg,Na,K,Zn и некот. др. Ме. НеМе. проявл. как положит., так и отриц. окисл. К широко примен. в промышленн. в-лям относ. водород, углерод (в виде угля или кокса) и СО.К сильн. о-лям принадлеж. неМе верхней части VI и VII гр. периодич. системы. Сильнее всего окисл. св-ва выраж. у F, но в практ. чаще использ. в кач-ве о-лей О2, Сl2,Br2. В кач-ве о-лей примен. также к-ты. Наиб. практ. примен. им. солян, серная и азотная к-ты.
32. Классификация ОВР: 1. Межмолекулярное окисление-востановление. В этих р-циях о-ль и в-ль разные в-ва.
Zn0+H+CL→Zn2+CL2+H0↑
Zn0-2e-→Zn2+
2H++2e-→H20
2. Компропорционирование. В этих р-циях о-ль и в-ль разные в-ва, явл-яся производными одного и того же эл-та. 
S2—-2e-→s0 |2|
S4++4e-→S0 |4| 4 1+2=3
3. Диспропорционирование. В эт. Р-циях одно в-во явл. И о-лем и в-лем, оно явл. Производным эл-том в промежуточной степ. Ок-ния.
Cr2+O2-→Cr23+O32-+Cr0
Cr2++2e-→Cr0
Cr2+-e-→Cr3+
4. Внутримолекулярное о-ние-в-ние.
2K+N5+O2-3→2K+N3+O22-+020
N5++2e-→N3+
2O2—4e-→O02
33. Электрохимич. проц. -проц., кот. сопровождаются возникновением. эл. тока или сами вызываются им. Устройства, кот. примен. для непосредственн. преобразования энергии хим. р-ции в электрич. энергию наз. гальванич. эл-тами. В гальв. эл-те протек ок-вост. р-ция, кот. раздел. на 2 электронных проц: на аноде-ок-ние, на катоде-в-ние. На границе Ме-р-р возник. двойной электрич. слой и разность потенциалов, кот. наз. электродный потенциал.
Схема медно-цинкового гальв. эл-та:

Схема движения движен. ионов и электронов:

34. Станд. электродн. потенциал -потенц. данного электродного проц. при активностях всех участвующих в нём в-в, равных 1. Если из ряда станд. электродн. потенц. выделить только те электродн. проц., кот. отвечают общ. ур-нию: Мz++ze-=M (плюс Н), то получим ряд напряжений Ме. Ур-ние Нернста:ε=ε0+  *Ln [Men+], где ε0-станд. потенц.;n -кол-во эл-нов, кот. приним. участие в проц. ок-ния или в-ния;[ ]-концентрация соответств. ионов Ме в р-ре (моль/л). Максимал. Значение напряжения гальв. эл-та, соответствующее обратимому протеканию р-ции, наз. ЭДС данного эл-та(Е). Е=εкатода- εанода. Потенциал водородн. электрода воспроизводиться с очень высокой точностью, поэт. он и принят в кач-ве эталона при создании шкалы электродн. потенциалов.
*Ln [Men+], где ε0-станд. потенц.;n -кол-во эл-нов, кот. приним. участие в проц. ок-ния или в-ния;[ ]-концентрация соответств. ионов Ме в р-ре (моль/л). Максимал. Значение напряжения гальв. эл-та, соответствующее обратимому протеканию р-ции, наз. ЭДС данного эл-та(Е). Е=εкатода- εанода. Потенциал водородн. электрода воспроизводиться с очень высокой точностью, поэт. он и принят в кач-ве эталона при создании шкалы электродн. потенциалов.




 :А + В → А: В
:А + В → А: В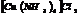

 -противоион (ион внешней сферы), 4-кол-во. Лиганд,
-противоион (ион внешней сферы), 4-кол-во. Лиганд,  -лиганды.
-лиганды. - компл. обр-ль.
- компл. обр-ль. =Kн -только для равновесн. сист-мы (↔)
=Kн -только для равновесн. сист-мы (↔) ]-гексоцианоферрат (II)калия; [Ag(NH3)2]Cl-хлорид диаминсеребра(I); [Cr(H2O)3F3]-трифторотриаквахром; [СO(NH3)3(NO2)2Cl]-хлородинитритотриамминкобальт.
]-гексоцианоферрат (II)калия; [Ag(NH3)2]Cl-хлорид диаминсеребра(I); [Cr(H2O)3F3]-трифторотриаквахром; [СO(NH3)3(NO2)2Cl]-хлородинитритотриамминкобальт.


 *Ln [Men+], где ε0-станд. потенц.;n -кол-во эл-нов, кот. приним. участие в проц. ок-ния или в-ния;[ ]-концентрация соответств. ионов Ме в р-ре (моль/л). Максимал. Значение напряжения гальв. эл-та, соответствующее обратимому протеканию р-ции, наз. ЭДС данного эл-та(Е). Е=εкатода- εанода. Потенциал водородн. электрода воспроизводиться с очень высокой точностью, поэт. он и принят в кач-ве эталона при создании шкалы электродн. потенциалов.
*Ln [Men+], где ε0-станд. потенц.;n -кол-во эл-нов, кот. приним. участие в проц. ок-ния или в-ния;[ ]-концентрация соответств. ионов Ме в р-ре (моль/л). Максимал. Значение напряжения гальв. эл-та, соответствующее обратимому протеканию р-ции, наз. ЭДС данного эл-та(Е). Е=εкатода- εанода. Потенциал водородн. электрода воспроизводиться с очень высокой точностью, поэт. он и принят в кач-ве эталона при создании шкалы электродн. потенциалов.



