Предмет и значение химии для совр-ого инженера-строителя. Роль химии в совр-ой пром-ти, науке, передовых технологиях. Химия и энергетика. Химия и продовольствие. Химия и медицина. Совр-ая хим-ая пром-ть
Химия- наука о веществах, их строении, свойствах и применении.
Вещество- одна из двух форм(2-я поле) существования материи. Это нечто имеющее конечную массу покоя и занимающее определённый объём в пространстве.
Значение химии. В современной жизни, особенно в производственной деятельности человека, химия играет исключительно важную роль. Нет почти ни одной отрасли производства, не связанной с применением химии. Природа даёт нам лишь сырьё- дерево, руду, нефть...Подвергая их химической переработке, получают разнообразные в-ва, необходимые для с/х, для изготовления промышленных изделий и для домашнего обихода- удобрений, металлы, пластические массы,, краски, лекарственные в-ва, мыло,соду…
Энергетика: химические источники тока(батарейка), переработка биомасс(получают биогаз, в основном метан, его используют как источник энергии, а остаток биомассы как удобрение); использование водорода в качестве топлива, материалы и горючее для ядерных реакторов…
Продовольствие: производство пищевых добавок и красителей; получение в-в для консервирования;
Медицина: на ряду с лекарственными препаратами создаются и полимерные материалы, совместимые с живыми тканями, которые пригодны для изготовления протезов органов(нитки для зашивания ран, зубные протезы, заменители кровеносных сосудов, заменители кожи, искусственные ткани, сердечные клапаны)
Современная химическая промышленность: Современная химическая промышленность развивается с 60-х в комплексе с нефтеперерабатывающими и нефтехимическими предприятиями. Интенсивному развитию в республике этой отрасли способствовал ряд благоприятных факторов: большая потребность нородного хозяйства в химической и нефтехимической продукции и высокая эффективность ее применения в промышленности и с/х; открытие богатых запасов калийных солей и нефтяных месторождений; разветвлённая сеть железных и автомобильных дорог; наличие магистральных газо-и нефтепроводов; достаточно мощные источники водоснабжения; свободные трудовые ресурсы и т.д.До 1990 в республике производилось более 50% общесоюзной выработки калийных удобрений, свыше 70% химических волокон и нитей. В 1997 на базе концернов «Белнефьепродукт» и «Белхимнефтепром» был создан гос-й концерн «Белнефтехим». Предприятия концерна производят: разведку и добычу нефти, ее транспартировку на нефтеперерабатывающие заводы РБ и её транзит в Европу, переработку нефти, углеводородного сырья и реализацию нефтепродуктов, минеральные удобрения, капролактам, химические волокна и нити, полиэтилен, стеклоткани. Стеклонити, шины, краски и лаки, пластмассы, трубы для подъёмных газораспределительных сетей и соединительные детали к ним, геолоразведачное оборудование.
2.Основные понятия хим-ой стехиометрии (моль, молярная масса, эквивалент, эквивалентная масса). Опред-ие эквив-тов и эквив-ных масс основных неорган-их соед-ий: оксидов, кислот, оснований, солей
Моль - это такой кол-во в-ва, которое содержит столько же структурных частиц(атомов,ионов,,электонов..),сколько содержится атомов в 12 гр нуклида углерода 12C.
Молярная масса - масса одного моля в-ва.
Эквивалент - это такое кол-во в-ва, которое соединяется с 1 моль атомов водорода или замещает то же кол-во атомов водорода в химических реакциях.
Эквив-ная масса - масса 1 эквивалента элемента.
1.Эквивалент элемента в соед-ии Э=1/В(эл), Мэ=Аr/B(эл)-для простых в-в
2. кислота: Э=1/m(число H), Мэ=Mr/m(число H)
3. гидроксиды: Э= сумма изменения внутренней энергии(∆U) и совершенной системой (или над нею) работы (A) равна сообщенной(или выделенной ею) теплоте(Q): Q=∆U+A
1/m(число ОН), Мэ=Mr/m(число ОН)
4. соли: Э=1/m(число мет)*B(мет), Мэ=Mr/m(число мет)*B(мет)
5.оксиды: Э=1/m(число О)*В(О), Мэ=Mr/ m(число О)*В(О),
Где В - валентность, Э-эквивалент, Мэ-эквивалентная масса, Mr-молярная масса.
Основные понятия хим-ой термодин-ки: термодин-ая система, параметры состояния и ф-ии термодин-ой системы. 1-й закон термодин-ки. Энтальпия. Экзо- и эндотермические реакции
Термодин-ая система - часть пространства имеющая реальные либо вымышленные границы с окружающей средой и в которой возможен тепло- и массообмен с окружающей средой.
Параметры состояния системы: V(объём), Т(температура), Р(давление),n(хим кол-во){PV=nRT}
Ф-ии состояния ( зависят от начального и конечного состояния системы и не зависит от способа перехода):U(внутренняя энергия), H(энтальпия), S(энтропия), G(энергия гипса),
1-й закон термодин-ки: Q=∆U+A, теплота Q, подведённая к системе, расходуется на увеличение внутренней энергии ∆U и на совершение системой работы А над внешней средой(сумма изменения внутренней энергии(∆U) и совершенной системой (или над нею) работы (A) равна сообщенной(или выделенной ею) теплоте(Q): Q=∆U+A)
Энтальпия (Н=U+pV, тепловая функция, теплосодержание)-термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Энтальпия - это термодинамическое свойство ве-ва, которое указывает уровень энергии, сохранённой в его молекулярной стру-ре.
Энтальпия -это кол-во энергии, которая доступна для преобразования в теплоту при определённой температуре и давлении. Единицы Энтальпии Дж/кг для удельной энергии. Все химические реакции сопровождаются выделением(экзотермические) или поглощением(эндотермические) тепла. Мерой теплоты реакции служит изменение энтальпии ∆Н, которая соотвецтвует теплообмену при постоянном давлении. В случае экзо-их реакций система теряет тело ∆Н<0. В случае эндо-их реакций система поглощает тепло и ∆Н>0.
Виды атмосферной коррозии
Атмосферную коррозию по степени увлажненности поверхности принято разделять на сухую, влажную и мокрую. Влажная и мокрая протекают по электрохимическому механизму, а сухая – химическому.
Металлические покрытия
1.1 Анодное покрытие (анодными наз. покрытия из металла, стандартный электродный потенциал которого меньше, чем электродный потенциал защищаемого металла)
Zn
 Fe
Fe
A 
K 

Анод (-) Zn (окисл) в Fe (+) катод (вост.)
кисл. cреде (рН<7) в нейтр. среде (рН=7)
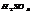

A (-)  A (-)
A (-) 
К (+) 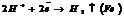 К (+)
К (+) 


1.2 Катодное покрытие (это покрытие из металла, стандартный электродный потенциал которого больше, чем у защищаемого металла) К<А
Sn A 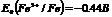
 Fe K
Fe K 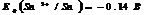
Анод (окисл) (-)Fe Sn(+) (востан)
В кислой среде (рН<7) в нейтральной среде (рН=7)


A (-) 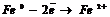 A (-)
A (-) 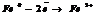
K (+)  K (+)
K (+) 
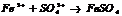

Способы получения металлических покрытий:
1) металлизация
2) термодиффузионный (порошковая металлургия)
3) химический (восстановление металлов методом электролиза)
2) Неметаллические (лакокрасочные) покрытия
Неметаллические защитные покрытия применяются для изоляции металлических изделий, их защиты от воздействия внешней среды (влаги), придания красивого вида.
Неметаллические защитные покрытия принято разделять на лакокрасочные, полимерные, покрытия резинами, смазками, силикатными эмалями, пастами.
IV.Электронная защита
а) электрохимия
Электрохимическая защита основана на торможении анодных или катодных реакций коррозионного процесса. Используется электрохимическая защита в основном для защиты от коррозии больших сооружений, эксплуатируемых в средах электролитов. Различают катодную и анодную электрохимическую защиту.
Катодная защита осуществляется путем присоединения защищаемого металла к отрицательному полюсу внешнего источника электрического тока (станции катодов защиты) или к металлу с большим электродным потенциалом (протекторный анод). Катодная защита является основным средством предотвращения морской коррозии. Катодную защиту стальной арматуры в железобетоне применяют для свай, фундаментов, дорожных сооружений и зданий. Для этого арматуру сваривают в единую электрическую схему, а аноды изготавливают из титана, кремнистого чугуна, графита, ниобия.
Анодная защита применяется в химической промышленности для защиты технологического оборудования. Накладывая на металл положительный потенциал добиваются образования на нем оксидной пленки. Таким образов защищают металлы работающие в среде серной кислоты, растворов аммиака, минеральных удобрений.
б) протекторная
Протекторная защита - отличается от катодной защиты тем, что для её осуществления используется специальный анод - протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции (алюминий, цинк). Протектор соединяют с защищаемой конструкцией проводником электрического тока. В процессе коррозии протектор служит анодом (положительно заряженный электрод) и разрушается, тем самым предохраняя от разрушения нашу охраняемую конструкцию.
Защита металлов от коррозии путём нанесения лакокрасочных покрытий (ЛКП). Требования к ЛКП. Факторы, влияющие на срок службы ЛКП. Совр-ые ЛКП. их св-ва и особен-ти
Лакокрасочные материалы (ЛКП) – многокомпонентная система, которая наносится в жидком или порошкообразном состоянии на предварительно подготовленную поверхность и после высыхания (затвердевания) образует прочную, хорошо сцепленную с основанием пленку. Получившуюся пленку называют лакокрасочным покрытием. ЛКП применяются для защиты металлических, а также других видов изделий от влияния внешних вредных факторов (влага, газы, воздух и т.д.), придания поверхности декоративных свойств.
47.
Металлургия – область промышленности, охватывающие процессы получения металлов из руд или других материалов.
Металлы и сплавы классифицируют следующим образом:
- Черные: железо и его сплавы (марганец, хром).
- Цветные: Основные тяжелые (Медь, свинец, цинк.); Малые тяжелые (висмут, мышьяк, ртуть.); Легкие (алюминий, магний, натрий, калий.); Благородные (золото, серебро, платина.).
· классификация металлов и сплавов по применению такова:
o антифрикционные (сплавы с низким коэффициентом трения и высоким уровнем износостойкости);
o коррозионно-стойкие (сплавы на основе железа, никеля, меди, алюминия, титана и других элементов, отличающиеся повышенной коррозионной стойкостью в различных агрессивных средах);
o криогенные (прецизионные сплавы на основе железа, никеля, алюминия, характеризующиеся комплексом тепловых, электрических, магнитных, механических свойств и предназначенные для работы при низких температурах (от -269 до +20°С);
o магнитные (сплавы, обладающие ферромагнетизмом);
o немагнитные (сплавы на основе меди, алюминия, железа, магнитная проницаемость которых близка к единице);
пружинные (сплавы на железной, медной, никелевой, кобальтовой и других основах с высоким пределом упругости и релаксационной стойкостью) и т.д.
48.
50.
Модель строения атома бора. Энергия электрона зависит от радиуса его орбиты. Минимальная энергия у электрона, который находится на ближайшей к ядру орбите. При поглощении кванта энергии электрон переходит на орбиту с более высокой энергией (возбужденное состояние). И наоборот, при переходе с высокого энергетического уровня на более низкий - электрон отдает (излучает) квант энергии.
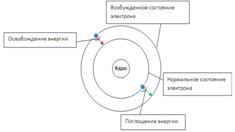
Квантово-механическая модель атома Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов. Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода 12C.
Принцип неопределенности Гейзенберга. Гейзенберг сформулировал принцип неопределенности, в соответствии с которым координаты и импульс не могут одновременно принимать точные значения. Для предсказания положения и скорости частицы важно иметь возможность точно измерять ее положение и скорость.
математическое выражение которого называется соотношением неопределенностей Гейзенберга:Δx х Δv > h/m
где Δx — неопределенность (погрешность измерения) пространственной координаты микрочастицы, Δv — неопределенность скорости частицы, m — масса частицы, а h — постоянная Планка, которая равняется примерно 6,626 x 10–34 Дж·с,
Понятие о волновой функции. Волнова́я фу́нкция, или пси-функция  — комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному):
— комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному): 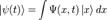
где - 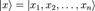 координатный базисный вектор, а
координатный базисный вектор, а  - волновая функция в координатном представлении.
- волновая функция в координатном представлении.
51.
Атомные Орбиталь – область пространства, где наиболее вероятно нахождение электрона.
Главное квантовое число (n) – характеризует энергетический уровень. Определяет энергию и размеры электронных орбиталей.
Орбитальное квантовое число (l) – определяет форму атомной орбитали. Характеризует энергетические подуровни в электронной оболочке атома. (s – 0; p – 1; d – 2; f – 3).
Магнитное квантовое число (m) – характеризует ориентацию орбитали в пространстве. (от –l до +l)
Спиновое квантовое число (s) – спин электрона. (+1/2 - ; -1/2 - ¯)
Строение многоэлектронных атомов.
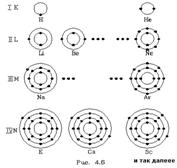
52.
Электронные оболочки обозначаются буквами K, L, M, N, O, P, Q или цифрами от 1 до 7. Подуровни оболочек обозначаются буквами s, p, d, f, g, h, i или цифрами от 0 до 6.
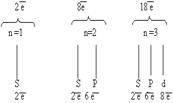
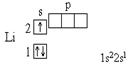
Принцип минимальной энергии. Электроны в основном состоянии заполняют орбитали в порядке повышения уровня энергии орбиталей.
Принцип запрета Паули. В атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел.
Правило Хунда. Заполнение орбитали одной подоболочки в основном состоянии атома начинается одиночными электронами с одинаковыми спинами.
Металлическая.
Водородная. Химическая связь образованная положительно поляризованным водородом молекулы A-H и отрицательным атомом B другой или той-же молекулы.
56.
Кальций (лат. calcium) широко распространен, в земной коре его содержится примерно 3% по массе. В природе встречается в связанном состоянии, важнейшие соединения - карбонат кальция CaCO3 (мел, известняк, мрамор), гипс CaSO4*2H2O, силикаты.
Кальций - это твердый металл белого цвета, проявляет степень окисления +2. Свободный кальций химически активен. При нагревании легко окисляется кислородом воздуха с образованием оксида:
2Ca + O2 = 2CaO
Кальций взаимодействует со всеми неметаллами. С галогенами реакция идет уже на холоде (с иодом только в присутствии влаги):
Ca+ Cl2 = CaCl2
При нагревании кальций реагирует с серой, фосфором, углеродом, азотом. Карбид кальция является ацетиленидом и при взаимодействии с водой разлагается с выделением ацетилена:
CaC2 + 2H2O = C2H2 + Ca (OH)2
Соединяется с водородом, образуя солеобразный гидрид CaH2. С холодной водой реагирует довольно медленно, быстрее при нагревании:
Ca + 2H2O = Ca (OH)2 + H2
Кальций бурно реагирует с разбавленными кислотами с образованием солей:
Ca + 2HCl = CaCl2 + H2
Получают кальций электролизом расплава хлорида кальция либо методом алюмотермии:
3CaO + 2Al = Al2O3 + 3Ca
Соединения кальция используются очень широко: в строительном деле, производстве удобрений, химической промышленности.
Оксид кальция CaO - белое тугоплавкое вещество, называется негашеной или жженой известью. Оксид кальция бурно реагирует с водой, образуя гидроксид кальция Ca (OH)2, также называемый гашеной известью. Гидроксид кальция - сильное основание, плохо растворимое в воде. Насыщенный водный раствор гидроксида кальция - известковая вода - жадно поглощает углекислый газ:
Ca (OH)2 + CO2 = CaCO3 + H2O
От содержания в воде ионов Ca2+ и Mg2+ зависит жесткость воды. Если концентрация этих ионов велика, вода называется жесткой, если мала - мягкой. Существует карбонатная (иначе временная), и некарбонатная (иначе постоянная) жесткость. Временная жесткость обусловлена присутствием в воде гидрокарбонатов, а постоянная - солей кальция и магния других кислот (хлоридов, сульфатов).
При кипячении воды гидрокарбонаты разлагаются, причем выпадает осадок карбоната кальция:
Ca (HCO3)2 = CaCO3Ї + CO2 + H2O
Добавление гидроксида кальция убирает карбонатную жесткость воды, при этом выпадает осадок карбоната:
Ca (HCO3)2 + Ca (ОН) 2 = 2СаСО3Ї + 2H2O
57
Химические свойства воды
- Активная реакция воды (pH)
- Окислительно- востановительный потенциал воды (Еh)
- Щёлочность воды
- Окисляемость воды
- Солёность воды
- Жёсткость воды (dH)
Активная реакция воды (pH) важнейшая характеристика.Если в ходе реакции одним из продуктов диссоциации оказывается водород, вода приобретает кислотные свойства, если гидроксильная- основные.Нейтральная вода имеет pH=7,0.При закисании воды в аквариуме рыбы становятся нервными, пугливыми, с них начиняет слезать чешуя.Варьируется для пресноводного аквариума от 4,5 до 9,0; в морском от 7,5 до 8,5.Измерить pH воды можно либо индикаторными бумажками (продаются в зоомагазинах), либо специальным прибором pH- метром.Для подкисления воды используют дигидросульфата калия или натрия, ортофосфорную кислоту.Подщелачивают раствором питьевой соды.
Окислительно- востановительный потенциал воды (Eh) Все окислительно-востановительные процессы, происходящие в воде, т.н. редокс-потенциал.Для его измерения применяют pH-метры с платиновым электродом иэлектродом сравнения. В качестве заменяющей характеристики нередко применяют электропроводимость воды, оптимальное значение 300-350 mS.
Щелочность воды обусловлена присутствием в ней карбонатов, бикарбонатов и гидроксидов.Пресноводный оптимум 1,8-2,0 ммоль/л.
Окисляемостьводы показывает сколько кислорода нужно для связывания растворённых в ней органических веществ.Оптимум 6-12мг/л.
Солёность воды выражают в промилле.С изменением солёности меняется давление, плотность воды.Оптимум пресноводный 1-3 промилли.Морской 1,024 промилли. Измеряется ариометром.
Жёсткость воды (dH) зависит от присутствия в воде растворённых солей магния и кальция и подразделяется на временную (карбонатную) от которой легко избавиться кипячением и постоянную. При высоких значениях pH осадок карбонатов может перейти обратно в раствор. Визуально определяют по пенности воды, жёсткая вода не пенится. простейший способ смягчения воды- кипячение и вымораживание. Повышение жесткости добавление 1 мл аптечного (10%) раствора хлоридакальция (1л. воды повышается
на 3°).
Умягчение воды - это процесс, приводящий к понижению ее жесткости (уменьшение концентрации ионов кальция Са+2 и магния Mg+2 в воде), приводящей к образованию на стенках теплообменников накипи. Умягчают воду специальные фильтры.
Методы умягчения воды
· Tермическое умягчение, основанное на нагревании воды, ее дистилляции или замораживании.
· Реагентное умягчение, при котором находящиеся в воде ионы Са+2 и Mg+2 связываются различными реагентами в практически нерастворимые соединения.
· Ионный обмен, основанный на фильтровании умягчаемой воды через специальные материалы, обменивающие входящие в их состав ионы Na+ и Н+ на ионы Са+2 или Mg+2, содержащиеся в воде.
· Комбинированный метод умягчения, представляющий собой различные сочетания перечисленных способов
58. Хим св-ва кремния
Si+O2→SiO2
Si+2F2→SiF4
Si+2CL2→SiCl4
3Si+2N→Si2N3
Важнейшие соед. Кремния
SiO2-Кварцовый песок
Кремниевые кислоты SiO2 и Н2О
Н2SiO3
Область применения
1.изготовление бумаги
2. обр. воды
3. в качестве осушитилей
SiO2 используется для наполнителей для бетона,раств. ЖБК керам изделий наполнителей для покрасочных материалов.
Вида
1)применение цемента с умеренным содерж-ем трех кальциевого силиката 3CaO*SiO2
2)выдерживание бетон-х изделий на воздухе, чтобы прошла карбонизация и на пов-ти образовался тонкий слой CaSO3.Введение в цементы активн.мин. добавок к/т связывают избыточный Ca(OH)2.
Вида
1)то же что и при борьбе с К.Б 2 вида
2)при слабокислотной кор-зии(PH=4-6)производят защиту кислотостойкими материалами
3)при сильной кислотной к-зии (рН<4)прим.спец.кислото-упорные цементы и бетоны с полимерными добавками или на основе полимерного связующего,а также исп-ют кислотоупорные замазки составы и покрытия
Вида
1)строгий контроль воды,цемента и функцион-х добавок для бетона на соответствие нормативн. док-там РБ.
2)определяют склонность бетонов к образованию высолов по стандарт.методикам
3) применение системы сонирующих штукатурок
4)гидрофобизация фундаментов
Классификация полимеров
1. ПО происхождению * искусственные *природные(целлюлоза,белки,крахмал,коллаген)*синтетические(получают в пром-ти путем синтеза из мономеров)
2.По составу осн.цепи макромолекулы: *макроцепные*гетероцепные(кремний,фосфор,азот,кислород)*ВМС системы сопряженных связей(к ним относят полиацетилен и разл.комплексные соед-я)
3.ПО строению макромолекулы различают:*линейные*развлетвленные*сетчатые плоскосные полимеры(лесничные и паркетные)*сетчатые-пространственные
4.В зависимости от поведения при нагревании:*термопластичные(новолаки)*термореактивные(резолы)
5.По способу получения:*полученные методом полимеризации*полученные мотодом поликонтденсации
Предмет и значение химии для совр-ого инженера-строителя. Роль химии в совр-ой пром-ти, науке, передовых технологиях. Химия и энергетика. Химия и продовольствие. Химия и медицина. Совр-ая хим-ая пром-ть
Химия- наука о веществах, их строении, свойствах и применении.
Вещество- одна из двух форм(2-я поле) существования материи. Это нечто имеющее конечную массу покоя и занимающее определённый объём в пространстве.
Значение химии. В современной жизни, особенно в производственной деятельности человека, химия играет исключительно важную роль. Нет почти ни одной отрасли производства, не связанной с применением химии. Природа даёт нам лишь сырьё- дерево, руду, нефть...Подвергая их химической переработке, получают разнообразные в-ва, необходимые для с/х, для изготовления промышленных изделий и для домашнего обихода- удобрений, металлы, пластические массы,, краски, лекарственные в-ва, мыло,соду…
Энергетика: химические источники тока(батарейка), переработка биомасс(получают биогаз, в основном метан, его используют как источник энергии, а остаток биомассы как удобрение); использование водорода в качестве топлива, материалы и горючее для ядерных реакторов…
Продовольствие: производство пищевых добавок и красителей; получение в-в для консервирования;
Медицина: на ряду с лекарственными препаратами создаются и полимерные материалы, совместимые с живыми тканями, которые пригодны для изготовления протезов органов(нитки для зашивания ран, зубные протезы, заменители кровеносных сосудов, заменители кожи, искусственные ткани, сердечные клапаны)
Современная химическая промышленность: Современная химическая промышленность развивается с 60-х в комплексе с нефтеперерабатывающими и нефтехимическими предприятиями. Интенсивному развитию в республике этой отрасли способствовал ряд благоприятных факторов: большая потребность нородного хозяйства в химической и нефтехимической продукции и высокая эффективность ее применения в промышленности и с/х; открытие богатых запасов калийных солей и нефтяных месторождений; разветвлённая сеть железных и автомобильных дорог; наличие магистральных газо-и нефтепроводов; достаточно мощные источники водоснабжения; свободные трудовые ресурсы и т.д.До 1990 в республике производилось более 50% общесоюзной выработки калийных удобрений, свыше 70% химических волокон и нитей. В 1997 на базе концернов «Белнефьепродукт» и «Белхимнефтепром» был создан гос-й концерн «Белнефтехим». Предприятия концерна производят: разведку и добычу нефти, ее транспартировку на нефтеперерабатывающие заводы РБ и её транзит в Европу, переработку нефти, углеводородного сырья и реализацию нефтепродуктов, минеральные удобрения, капролактам, химические волокна и нити, полиэтилен, стеклоткани. Стеклонити, шины, краски и лаки, пластмассы, трубы для подъёмных газораспределительных сетей и соединительные детали к ним, геолоразведачное оборудование.
2.Основные понятия хим-ой стехиометрии (моль, молярная масса, эквивалент, эквивалентная масса). Опред-ие эквив-тов и эквив-ных масс основных неорган-их соед-ий: оксидов, кислот, оснований, солей
Моль - это такой кол-во в-ва, которое содержит столько же структурных частиц(атомов,ионов,,электонов..),сколько содержится атомов в 12 гр нуклида углерода 12C.
Молярная масса - масса одного моля в-ва.
Эквивалент - это такое кол-во в-ва, которое соединяется с 1 моль атомов водорода или замещает то же кол-во атомов водорода в химических реакциях.
Эквив-ная масса - масса 1 эквивалента элемента.
1.Эквивалент элемента в соед-ии Э=1/В(эл), Мэ=Аr/B(эл)-для простых в-в
2. кислота: Э=1/m(число H), Мэ=Mr/m(число H)
3. гидроксиды: Э= сумма изменения внутренней энергии(∆U) и совершенной системой (или над нею) работы (A) равна сообщенной(или выделенной ею) теплоте(Q): Q=∆U+A
1/m(число ОН), Мэ=Mr/m(число ОН)
4. соли: Э=1/m(число мет)*B(мет), Мэ=Mr/m(число мет)*B(мет)
5.оксиды: Э=1/m(число О)*В(О), Мэ=Mr/ m(число О)*В(О),
Где В - валентность, Э-эквивалент, Мэ-эквивалентная масса, Mr-молярная масса.
Колич-ые законы химии. Закон эквив-тов
1. Закон сохр-ия массы и энергии: Суммарные массы и энергия в-ва, вступающих в реакцию, всегда равны суммарным массе и энергии продуктов реакции.
2. Закон постоянства состава: всякое чистое в-во молекулярного строения независимо от способа его получения имеет постоянный качественный и количественный состав.
3. Закон кратных соотношений: если два элемента образуют между собой несколько молекулярных соединений, то массы одного элемента, приходящиеся на одну и ту же массу другого элемента, относятся между собой как небольшие целые числа.
4. Закон эквив-тов: массы(объёмы) реагирующих друг с другом веществ пропорциональны их эквивалентным массам (объёмам).
Основные понятия хим-ой термодин-ки: термодин-ая система, параметры состояния и ф-ии термодин-ой системы. 1-й закон термодин-ки. Энтальпия. Экзо- и эндотермические реакции
Термодин-ая система - часть пространства имеющая реальные либо вымышленные границы с окружающей средой и в которой возможен тепло- и массообмен с окружающей средой.
Параметры состояния системы: V(объём), Т(температура), Р(давление),n(хим кол-во){PV=nRT}
Ф-ии состояния ( зависят от начального и конечного состояния системы и не зависит от способа перехода):U(внутренняя энергия), H(энтальпия), S(энтропия), G(энергия гипса),
1-й закон термодин-ки: Q=∆U+A, теплота Q, подведённая к системе, расходуется на увеличение внутренней энергии ∆U и на совершение системой работы А над внешней средой(сумма изменения внутренней энергии(∆U) и совершенной системой (или над нею) работы (A) равна сообщенной(или выделенной ею) теплоте(Q): Q=∆U+A)
Энтальпия (Н=U+pV, тепловая функция, теплосодержание)-термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Энтальпия - это термодинамическое свойство ве-ва, которое указывает уровень энергии, сохранённой в его молекулярной стру-ре.
Энтальпия -это кол-во энергии, которая доступна для преобразования в теплоту при определённой температуре и давлении. Единицы Энтальпии Дж/кг для удельной энергии. Все химические реакции сопровождаются выделением(экзотермические) или поглощением(эндотермические) тепла. Мерой теплоты реакции служит изменение энтальпии ∆Н, которая соотвецтвует теплообмену при постоянном давлении. В случае экзо-их реакций система теряет тело ∆Н<0. В случае эндо-их реакций система поглощает тепло и ∆Н>0.



 Fe
Fe



 A (-)
A (-) 
 К (+)
К (+) 


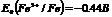
 Fe K
Fe K 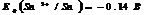


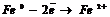 A (-)
A (-) 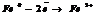
 K (+)
K (+) 
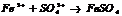


 — комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному):
— комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному): 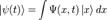
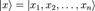 координатный базисный вектор, а
координатный базисный вектор, а  - волновая функция в координатном представлении.
- волновая функция в координатном представлении.





