КС соединениями наз-ся опр-ый вид хим-их соединений, образованных сочетанием отдельных компонентов, представляющих собой сложные ионы или молекулы, способные сущ-ть, как в растворенном, так и в кристаллическом состоянии. Образование КС объясняет координационная теория и теория кристаллического поля. Согласно этой теории 1 из атомов, обычно (+) заряженный, занимает в соединении гл. место и наз-ся комплексообразователь. Вокруг него координируются нейтральные молекулы или противоположено заряженные ионы, γ наз-ся лигандами. Комплексообразователь и лиганды обр-ют внутреннею сферу КС. Комплексообразователь и лиганды связаны м/у собой силами хим-го взаимодействия. Общее число δ связей, образованных м/у комплексообразователем и лигандами наз-ся координационным числом. По числу δ связей лиганды делятся на: моно-, ди-, поледентатные. За пределами внутренней сферы располаг. внешняя сфера. Если комплексный ион заряжен (+), то внешняя сфера заряжена (-) и наоборот. Если внутр. сфера не имеет заряда, то внешняя сфера отсутствует. В большенстве случаев КС обр-ся: - при взаимодействии в-в в растворах:


- непосредственном взаимодействии твердых и газообразных в-в.

Комплексообразователь, лиганды.
Согласно координационной теории 1 из атомов, обычно (+) заряженный, занимает в соединении гл. место и наз-ся комплексообразователь. Вокруг него координируются нейтральные молекулы или противоположено заряженные ионы, γ наз-ся лигандами. Комплексообразователь и лиганды обр-ют внутреннею сферу КС. Комплексообразователь и лиганды связаны м/у собой силами хим-го взаимодействия. Общее число δ связей, образованных м/у комплексообразователем и лигандами наз-ся координационным числом. По числу δ связей лиганды делятся на: моно-, ди-, поледентатные.
Внутренняя и внешняя сферы КС.
КС соединениями наз-ся опр-ый вид хим-их соединений, образованных сочетанием отдельных компонентов, представляющих собой сложные ионы или молекулы, способные сущ-ть, как в растворенном, так и в кристаллическом состоянии. Комплексообразователь и лиганды обр-ют внутреннею сферу КС. Комплексообразователь и лиганды связаны м/у собой силами хим-го взаимодействия. За пределами внутренней сферы располаг. внешняя сфера. Если комплексный ион заряжен (+), то внешняя сфера заряжена (-) и наоборот. Если внутр. сфера не имеет заряда, то внешняя сфера отсутствует.
Номенклатура КС.
1. КС неэлектролиты.
для наименования КС принята след. последовательность:
1.указать число и нименование нейтральных молекул: Н2О – аква, NH3 – амин, N2H3 – гидрозин.
2. указываются (-) заряженные лиганды: О-2 – оксо; ОН- - гидро; NO2- - нитро; SO3-2 – сульфито.
3. указывается название комплексообразователя, без указания его степени окисления.
акватрифторакобальт.

диамминтетрахлороплатина.

2. КС с комплексным катионом.
Сначала указ-ся комплексный катион, затем внешнюю сферу. Последовательность наимен-ния лигандов сохр-ся, к наименованию комплексообразователя добавляется степень окисления.
тетраамминдихлораплатина (3) хлорид.

тетраамминмедь(2) гидроксид.
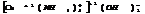
3. КС с комплексныи анионом.
В начале называют внешнюю сферу (катион), а потом внутреннюю (анион). Комплексообразователю придают окончание –АТ.
барий диамминтетрароданохромат (3)

калий тетраброминат (2)

4. КС с комплексными катионом и анионом.
гексаамминкобальтат(3) гексанитрокобальтат(3)

тетраамминкобальт(2) тетрахлораплатинат(2)

Равновесие в растворах КС.
Большинство КС растворимы в воде, при растворении они диссоциируют в основном с обр-ем комплексного иона. Т.к процесс р-ции обратимый, то равновесие м. нарушить удалив из системы 1 из продуктов р-ции.



10.7. Константы нестойкости КС.
Большинство КС растворимы в воде, при растворении они диссоциируют в основном с обр-ем комплексного иона.


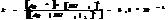
Константа диссоциации КС наз-ся константой нестойкости.
11.1. Положение Ме в ПС Менделеева.
Все элементы подразделяются на Ме и не Ме (не Ме – 22, Ме – 85). К Ме относятся все s, d, f – эл-ты p – как Ме, так и не Ме. Большинство Ме содер-т на последнем эл-ом уровне по 1 и 2 электрону. Эл-ты Ме обр-ют в-ва с тем же наз-ем. В обычных усл-х это кристал. в-ва (искл. Hg).
Металлическая связь.
Ме связь обр-ся за счёт свободного перемещения электронов последнего энергетического уровня по всему V Ме.
Пр.: Na 
NA=6,02*1023
NA-число Авагадро.
Ме связь хар-на для Ме в тв-ом и в жидком состояниях. В газообразном состоянии для Ме хар-на ковалентная связь.
Все физ-ие св-ва Ме объясняются Ме связью.
11.3. Типы кристаллических решеток.
Наиболее типичными я-я 3 кристаллические решетки:
1.объёмно – центрированная кубическая решётка, в такой струк-е каждый атом Ме попадает в центр куба, γ обр-ют 8 соседних атомов (Na, Cr) 2. гранецентрированная куб-ая решётка, она обр-на 14 атомами (8 на вершине куба, 6 н грагнях). Al, Ni
3. гексагональная плотно упакованная решётка (Mg, Co).
11.4. Физ-ие св-ва. 1. высокая пластичность. Атомная красталич. решётка
ионная решётка
2. для всех Ме хар-ен Ме блеск, обычно серый цвет и не прозрачность. Непрозрачность Ме обусловлена присутствием в кристал-й решётке свободных электронов. Свободные электроны гасят световые колебания, превращая их в теплоту или в некоторых случаях для фотоэлектрического эффекта. Ме блеск объясняется тем, что Ме отражают большую часть, падующего на них света. Интенсивность блеска опр-ся долей поглащаемого цвета, большинство Ме практически полностью отражают падающий на них свет, поэтому имеют белый или серый цвет. Наиболее ярко блестят Pl и Ag. Au, Cu, цезий поглощают в большей степени зелёный и голубой цвет, поэтому имеют жёлтый или красный цвет. Хорошая электропроводность Ме объясняется присутствием свободных электронов, γ под влиянием даже небольшой разности потенциалов, приобретают направленное движение. С повыш-ем темпер-ры усиливается колебательное движение атомов, что затрудняет направленное движение электронов, витая электропроводность умен-ся и наоборот. Наибольшей электропро-ю обл-ют Ag и Cu, затем Au, Al, Fe. У неМе с повешением toC электропров-ть возрастает, это объясняется тем, что число свободных электронов увелич-я за счёт разрыва ковалентных связей. При низких toC неМе не обладают электропров-ю из-за отсутствия свободных электронов. В этом состоит гл. различие Ме и неМе. Различна плотность (ρ) Ме, она тем меньше, чем меньше атомная масса и больше радиус эл-та. Наим-ей ρ обладает Li, его ρ=0,56 г/см3. Самый тяжёлый Ме Os ρ(Os)=22,6 г/см3. Различны toC плавления и кипения Ме. Самый легкоплавкий Hg toC плавления =38,9 С0, тугоплавкий вольфрам=3390 С0. Ме с toC плавления до 10000С наз-ся легкоплавкими. Сильное различия в toC плавления и кипения объясняется тем, что прочность хим. связи в Ме различна. В чистом виде Ме связь хар-на только для щелочных и щелочноземельных Ме. У остальных Ме (особенно d-Ме) наблюдается возникновение ковалент. связи, она намного прочнее Ме-ой, поэтому d-Ме обладают большей toC плавления и кипения. Ме отличаются по твердости. Самый твёрдый-Cr, лёгкий-K, Ru, Cs.
Хим-ие св-ва Ме.
Хим-ая активность Ме различна. Щелочные, щелочноземельные – самые активные, вступают в р-ции при обычных условиях. Самые устойчивые Au, Pt не взаим-ют даже с сильнейшими окислителями. Хим-ая активность многих Ме снижается из-за образования на их пов-ти тонких защитных плёнок, эти защитные плёнки препятствуют проникновению окислителей к пов-ти Ме.
Ме реагируют с:
1.с неМе, в рез-те образуются бинарные соединения.
2. с О2 образуя оксиды, γ м. проявлять основный, амфотерный и кисл. хар-р.
3. с МЕ, обр-ся интермет-ие соединения (MgZn, Cu5Zn8).
Некоторые интермет-ие соединения м.б. различного состава (AgZn, Ag2Zn, Ag5Zn8)
интермет-ий соединения по внешнему виду похожи на Ме. По св-ам они значительно отлич-ся от св-в исходных Ме. Mg toC плавления 651oC, взаимодейст. с оловом, toC плавления 232oC. В рез-те обр-ся Mg2Sn, toC плавления 748oC, электропроводность в 80 раз меньше, чем у олова, и в 220 раз меньше, чем у Mg.
4. с Н20. С Н20 м реагировать Ме, стоящие до Н2. Активные Ме реагируют активно в н.у.

Ме с меньшей Активностью

5. со щелочами. Ме, оксиды и гидроксиды, γ обладают амфотер. св-ми м. взаим-ть со щелочами

6. с кисл.
HCl на Ме, имеющие постоянную СО разбавленная и конц. кисл. дейт-т одинаково, обр-ся хлорид и газ 
Если Ме имеет переменную СО, то глубина его окисления зависит от концентрации кисл., чем больше концентрация, тем больше окисления у Ме


 разб. реагирует с Ме, стоящими до
разб. реагирует с Ме, стоящими до  , в пез-те обр-ся сульфат и
, в пез-те обр-ся сульфат и  .
.

Конц.  реагирует с Ме, стоящими до Ag включительно, в зависимости от активности Ме обр-ся различ. продукты
реагирует с Ме, стоящими до Ag включительно, в зависимости от активности Ме обр-ся различ. продукты  - SO2; S; H2S, также обр-ся сульфат и вода.
- SO2; S; H2S, также обр-ся сульфат и вода.


 реагирует со всеми Ме кроме благородных.
реагирует со всеми Ме кроме благородных.
 (к) не дейст. на Fe, Cr, Al, Au, Ir, Pt, Ta.
(к) не дейст. на Fe, Cr, Al, Au, Ir, Pt, Ta.
 (к)+тяжёлые Ме= NO2
(к)+тяжёлые Ме= NO2
 (к)+щелочные, щелочноземельные Ме=N2O
(к)+щелочные, щелочноземельные Ме=N2O
 (р)+тяж. Ме=NO
(р)+тяж. Ме=NO
 (р) щелочные, щелочноземельные Ме, Zn, Fe=NH3, NH4NO3
(р) щелочные, щелочноземельные Ме, Zn, Fe=NH3, NH4NO3

Металлы и их соединения.
1. Общая характеристика подгрупп. Физические свойства
IА - Li, Nа, К, PЬ, Сs, Fr IIА - Ве, Мg Са, Sr, Ва, Rа
Все элементы групп IА и IIА являются металлами. Металлы группы IА имеют серебристую окраску, но быстро тускнеют на воздухе. У них сравнительно слабая металлическая связь, т.к. имеется только один валентный электрон. Они во многом отличаются от других металлов, а именно: они мягкие и их можно резать ножом; у них низкие температура плавления и кипения; значения стандартных энтальпий плавления и испарения низкие; у них малые плотности (Li, Na, К - легче воды).
У металлов группы IIА два валентных электрона и более прочная металлическая связь, что отражается на их физических свойствах.
Металлы группы IА имеют объёмноцентрированную кубическую решетку, Ве, Mg - гексагональную плотно-упакованную структуру, Ва -объёмноцентрированную кубическую решетку, Са, Sr - гранецентрированную. Внешние электроны могут при возбуждении переходить на более высокие энергетические уровни. При обратном переходе на низкий уровень выделяется энергия в виде электромагнитных колебаний. Для этих металлов энергии переходов невелики, так что длина волны излучения соответствует видимой части спектра. Поэтому рассматриваемые элементы окрашивают пламя в:
Li — красный Ве - не окрашивает
Na—желтый Мg- ослепительно белый
К-лиловый Са- кирпич но-красный
Rb- красный Sr - малиновый
Сs - голубой Ва - яблочно-зеленый цвета.
Элементы имеют постоянную степень окисления +1 для группы IА и +2 для группы IIА. С увеличением порядкового номера, размеры атомов увеличиваются, энергия ионизации уменьшается. Металлы являются восстановителями:
Ме - пе =Меn+
2. Нахождение в природе
Металлы находятся в природе только в виде соединений. Наиболее распространены Na,K,Ca,Mg.
Основные природные соединения:
| LiАl[Si206] сподумент
|
| NaС1 каменная соль
|
| Na[А1308] натриевый полевой шпат(альбит)
|
| Nа2 SO4 • 10Н2Омирабилит(глауберова соль)
|
| КСl сильвин
|
| NаС1 • КС1сильвинит
|
| КС1 • МgС12 • 6Н20 карналит
|
| КС1 • MgS04 • ЗН20 каинит
|
| 3ВеО А1203 • 6SIO2=Ве3А12 [Si6018]берилли
|
| А12Ве04 хризоберилли
|
| Ве 2[SiO4] фенакит
|
| MgS04 • н2о кизерит
|
| СаСОз- MgCOз доломит
|
| MgCOз магнезит
|
| 3MgO • 2SiO2- 2Н20 азбест
|
| СаСОз кальцит, аргомит,мрамор,мел
|
|
|
| СаS04 • 2Н20 гипис
|
| СаS04 ангидрит
|
| Са3(Р04)2 - СаF2 • СаС12 апатит
|
| CrСО3 стронцианит
|
| CrSO4 целестин
|
| ВаS04 барит(тяжелый шлаг)
|
| ВаСОз витерит
|
13.Неметаллы и ихсоединения. При нормальных условиях водород, азот, кислород, фтор, хлор и благородные газы находятся в газообразном состоянии, бром — в жидком, а остальные — в твердом состоянии. Из газообразных только кислород имеет аллотропные модификации: кислород 02 и озон Оз. В твердом же состоянии неметаллов это явление распространено широко. Например, бор имеет а-, ^-ромбоэдрические и тетрагональную модификации аллотропные формы углерода: алмаз, графит, карбин, фуллерены; кремний, фосфор, сера и другие неметаллы широко представлены своими аллотропными модификациями, порой резко отличающимися по своим физическим свойствам. Из всего сказанного следует, что физические свойства неметаллов являются в значительной мере их индивидуальными свойствами, поэтому они рассматриваются в разделах по свойствам отдельных групп элементов.
Химические свойства неметаллов нередко сильно отличаются друг от друга, однако в их проявлениях есть и много общего. Большинство неметаллов, за исключением фтора и благородных газов, проявляют как отрицательные, так и положительные степени окисления. Поэтому они могут в химических реакциях быть и окислителями, и восстановителями, за исключением фтора (только окислитель) и благородных газов (Кr, Хе, Rn — только восстановители, остальные — инертны). Сверху вниз по подгруппе устойчивость положительных степеней окисления увеличивается, что можно объяснить увеличением радиусов атомов, увеличением значения главного квантового числа внешних электронов атомов, а следовательно, уменьшением энергии ионизации. По тем же причинам, из-за уменьшения сродства к электрону, устойчивость отрицательной степени окисления в данном направлении уменьшается.









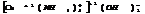









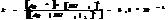







 разб. реагирует с Ме, стоящими до
разб. реагирует с Ме, стоящими до  , в пез-те обр-ся сульфат и
, в пез-те обр-ся сульфат и 
 реагирует с Ме, стоящими до Ag включительно, в зависимости от активности Ме обр-ся различ. продукты
реагирует с Ме, стоящими до Ag включительно, в зависимости от активности Ме обр-ся различ. продукты  - SO2; S; H2S, также обр-ся сульфат и вода.
- SO2; S; H2S, также обр-ся сульфат и вода.

 реагирует со всеми Ме кроме благородных.
реагирует со всеми Ме кроме благородных. (к) не дейст. на Fe, Cr, Al, Au, Ir, Pt, Ta.
(к) не дейст. на Fe, Cr, Al, Au, Ir, Pt, Ta. (к)+тяжёлые Ме= NO2
(к)+тяжёлые Ме= NO2 (р) щелочные, щелочноземельные Ме, Zn, Fe=NH3, NH4NO3
(р) щелочные, щелочноземельные Ме, Zn, Fe=NH3, NH4NO3


