

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Теория строения органических соединений. Гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
I. Основные положения теории химического строения А.М. Бутлерова
| 1) Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается структурной формулой (формулой строения). Органические вещества содержат в своей основе УГЛЕРОДНЫЕ ЦЕПИ, в которых углерод имеет валентность IV. Связи между атомами углерода в органических цепях бывают одинарные, двойные и тройные. Кроме углерода, в органических веществах чаще всего присутствуют: атомы Н (одновалентные), атомы О (двухвалентные), а также атомы азота, галогенов и ещё некоторые виды атомов. Вещества, сходные по строению, но отличающиеся по составу на одну или несколько групп СН2, называются гомологами. 2) Свойства веществ зависят не только от вида и числа атомов в молекуле, но и от их взаимного расположения – т.е. от строения молекулы. Это приводит к тому, что вещества одного и того же состава могут иметь разное строение, т.е. к появлению изомеров. Изомеры – это вещества, имеющие одинаковый состав, но разное строение молекул. 3) По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства. 4) Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга. Это отражается на химических и физических свойствах вещества. |
II. Типы связей в молекулах органических веществ.
|
|
Строение атома углерода.
Электронное строение атома углерода изображается следующим образом: 1s22s22p2 или графически

Такое состояние атома углерода называется основным или стационарным. За счет двух неспаренных электронов могут быть образованы 2 химические связи (валентность равна 2).
Одинарные и кратные связи.
| Одинарная (δ) | Двойная (δ + π) | Тройная (δ + π + π) |
| С-С, С-Н, С-О | С=O и С=С | С≡С и С≡N |
III. Гибридизация атомных орбиталей углерода.
Поскольку четыре электрона у атома углерода различны (2s- и 2p- электрона), то должны бы быть различны и связи, однако известно, что связи в молекуле метана равнозначны. Поэтому для объяснения пространственного строения органических молекул используют метод гибридизации.
1. Если в гибридизации участвуют все четыре орбитали возбужденного атома углерода (одна s- и три p- орбитали), то образуются четыре новых равноценных sp3- гибридных орбитали, имеющие форму вытянутой гантели. Вследствие взаимного отталкивания sp3 - гибридные орбитали направлены в пространстве к вершинам тетраэдра и углы между ними равны 109028' (наиболее выгодное расположение).
2. При sp2-гибридизации гибридизуются одна s- и две р-орбитали и образуются три гибридные орбитали, оси которых расположены в одной плоскости и направлены относительно друг друга под углом 120°.
3. При sp-гибридизации гибридизуются одна s- и одна р-орбитали и образуются две гибридные орбитали, оси которых расположены на одной прямой и направлены в разные стороны от ядра рассматриваемого атома углерода под углом 180°.
IV. Изомерия.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию
). Структурные изомеры отличаются друг от друга порядком связей между атомами в молекуле; стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.СТРУКТУРНАЯ ИЗОМЕРИЯ.
|
|
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Веществ с молекулярной формулой С4Н10 существует два:
| н-бутан (с линейным скелетом): | и изо-бутан, или 2-метилпропан: |
| СН3 – СН2 – СН2 – СН3 | СН3 – СН – СН3 │ СН3 |

2. Изомерия положения обусловлена различным положением функциональной группы (группа атомов, определяющая наиболее характерные свойства веществ данного класса) или заместителя при одинаковом углеродном скелете молекул. Так, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
СН3 – СН2 – СН2 – ОН и СН3 – СН – СН3
│
ОН
Изомерия непредельных соединений может быть вызвана различным положением кратной связи, как, например, в бутене-1 и бутене-2:
СН3-СН2-СН=СН2 и СН3-СН=СН-СН3
3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Пары межклассовых изомеров:
CnH2n - алкены и циклоалканы
CnH2n-2 - алкины и алкадиены (а также циклоалкены)
СnH2n+2O - спирты и простые эфиры.
CnH2nO - альдегиды и кетоны, а также: циклические спирты, циклические эфиры, непредельные спирты и эфиры.
CnH2nO2 - карбоновые кислоты и сложные эфиры.
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ.
Оптическая изомерия свойственна молекулам органических веществ, не имеющим плоскости симметрии (плоскости, разделяющей молекулу на две зеркально тождественные половины) и не совмещающимся со своим зеркальным отображением (т. е. с молекулой, соответствующей этому зеркальному отображению).
Такие асимметричные молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через кристалл, расплав или раствор вещества.
Чаще всего оптическая активность обусловлена наличием в молекуле асимметрического атома углерода, т. е. атома углерода, связанного с четырьмя различными заместителями.
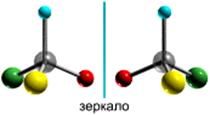
Примером может служить молочная кислота: CH3C*H(OH)COOH (асимметрический атом углерода отмечен звёздочкой). Согласно тетраэдрической модели атома углерода, заместители располагаются в углах правильного тетраэдра, в центре которого находится атом углерода:
|
|

Как видно из приведённых формул, молекула молочной кислоты ни при каком перемещении в пространстве не может совпасть со своим зеркальным отображением. Эти две формы кислоты относятся друг к другу, как правая рука к левой, и называются оптическими антиподами (энантиомерами).
Теория строения органических соединений. Гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
I. Основные положения теории химического строения А.М. Бутлерова
| 1) Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается структурной формулой (формулой строения). Органические вещества содержат в своей основе УГЛЕРОДНЫЕ ЦЕПИ, в которых углерод имеет валентность IV. Связи между атомами углерода в органических цепях бывают одинарные, двойные и тройные. Кроме углерода, в органических веществах чаще всего присутствуют: атомы Н (одновалентные), атомы О (двухвалентные), а также атомы азота, галогенов и ещё некоторые виды атомов. Вещества, сходные по строению, но отличающиеся по составу на одну или несколько групп СН2, называются гомологами. 2) Свойства веществ зависят не только от вида и числа атомов в молекуле, но и от их взаимного расположения – т.е. от строения молекулы. Это приводит к тому, что вещества одного и того же состава могут иметь разное строение, т.е. к появлению изомеров. Изомеры – это вещества, имеющие одинаковый состав, но разное строение молекул. 3) По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства. 4) Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга. Это отражается на химических и физических свойствах вещества. |
|
|
|

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!