Если в воду (или раствор электролита) погрузить пластинку какого-либо металла, то на его поверхности возникают процессы, приводящие к образованию так называемого двойного электрического слоя.
Ионы металла из его кристаллической решетки под влиянием полярных молекул воды отрываются и переходят в воду (или раствор). При этом поверхность металла заряжается отрицательно за счёт оставшихся в металле электронов, а слой воды заряжается положительно за счёт ионов, которые перешли в
раствор. В результате на границе Ме - раствор устанавливается равновесие Ме2+ (металл) 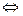 Ме2+(раствор), т.к. по мере увеличения заряда пластинки переход катионов в одноимённо заряженный раствор затрудняется. Если при установлении контакта металл-раствор скорость перехода катионов из металла в раствор была меньше, чем скорость их перехода в обратном
Ме2+(раствор), т.к. по мере увеличения заряда пластинки переход катионов в одноимённо заряженный раствор затрудняется. Если при установлении контакта металл-раствор скорость перехода катионов из металла в раствор была меньше, чем скорость их перехода в обратном
направлении, то между электроном и раствором также устанавливается равновесие; но в этом случае электрод заряжается положительно, а раствор - отрицательно. Таким образом, происходит образование двойного электрического слоя, который может иметь различные заряды. Рассмотрим подробнее, от чего это зависит и как количественно можно охарактеризовать двойной электрический слой.
Электродные потенциалы. Заряд иона относительно велик, а электрическая ёмкость на границе между металлом и раствором мала, поэтому уже при переходе очень малого количества ионов между металлом и раствором возникает значительная разность потенциалов. Например, при переходе ионов серебра в количестве одной стомиллионной доли грамма (10-8 г) из раствора в металл его потенциал становится положительнее на 0,5 В.
Таким образом, двойной электрический слой можно уподобить конденсатору, одна из обкладок которого представляет собой поверхность металла, а другая - слой ионов в растворе у поверхности металла. Между разноимённо заряженными обкладками и возникает разность, или скачок потенциала.
Различают три случая возникновения скачка потенциала на границе металл - раствор электролита.
I. Ионы металла, находящиеся на поверхности обладают избыточной энергией по сравнению с энергией частиц, находящихся внутри металла. Взаимодействие полярных молекул воды с поверхностью металла приводит к отрыву катионов металла в виде гидратированных ионов
Ме + mН2О 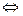 Меn+ (Н2О)m + n
Меn+ (Н2О)m + n 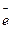
В этом случае поверхность металла заряжается отрицательно (-), а слой электролита, примыкающий к ней - положительно (+). Образуется двойной слой с определённой разностью потенциалов.

а б
Рис. 59. Двойной электрический слой (а) и падение потенциал в нём (б); l 1-адсорбционный слой; l 2-диффузионный слой
Катионы распределяются следующим образом: часть ионов плотно прилегает к поверхности металла (ионы находятся на расстояни радиуса иона), образуя так называемый адсорбционный слой (рис.59), а другая часть катионов под влиянием сил молекулярного движения распределяется на некотором расстоянии от поверхности металла, образуя диффузионный слой. Следовательно, изменение потенциала  в двойном электрическом слое слагается из падения потенциала в адсорбционном и диффузионном слое.
в двойном электрическом слое слагается из падения потенциала в адсорбционном и диффузионном слое.
 =
=  +
+  /
/
По мере увеличения концентрации катионов металла в растворе становится вероятным обратный процесс - восстановления ионов металла.
С течением времени скорость окисления металла становится равной скорости восстановления его ионов из раствора. На границе металл - раствор устанавливается равновесная разность потенциалов, которая называется равновесным электродным потенциалом (равновесный скачок потенциала).
Такая картина наблюдается для активных металлов. Это свидетельствует о том, что способность посылать ионы в раствор различных металлов выражена неодинаково. Она зависит от энергии ионизации атомов металла, от энергии гидратации ионов металла. Чем меньше энергия ионизации и больше энергия гидратации, тем выше способность металла окисляться и посылать свои ионы в раствор, при этом металл будет иметь и более отрицательный потенциал.
II. Малоактивные металлы (Cu, Ag) окисляются с трудом, выход ионов в раствор почти не происходит. Поэтому, например, в случае медного электрода, погруженного в раствор соли меди, преобладает адсорбция ионов металла на поверхности электрода. Схематично процесс можно изобразить следующим образом: [nCu] + x Cu2+ ∙ (H2O)m 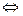 [nCu]ּ xּ Cu2+ + mH2O
[nCu]ּ xּ Cu2+ + mH2O
В этом случае поверхность металла заряжается положительно, а прилегающий к ней раствор - отрицательно за счёт избытка в нём анионов (рис.60).
а б
Рис. 60. Двойной электрический слой (а) и падение потенциала
в нём (б): l 1 - адсорбционный слой; l 2 - диффузионный слой.
III. Иной механизм возникновения потенциала на инертном электроде, который опущен в раствор, содержащий окисленную или восстановленную форму какого - либо соединения. Например, если в раствор FeCl3 опустить платиновый (инертный) электрод, то катион Fe3+ отнимает от поверхности платины электрон и превращается в ион Fe2+:
FeCl3 + ē → FeCl2 + Cl-
В результате платина получает положительный заряд, а раствор у поверхности её - отрицательный заряд за счёт образовавшегося избытка ионов Cl-. Равновесие в двойном электрическом слое выразится уравнением Fe3+ + e 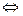 Fe2+. Таким образом, возникает положительный потенциал на платине, который будет тем выше, чем больше окислительная способность катиона. И, наоборот, чем сильнее восстановительная активность иона, тем вероятней отдача электрона им в кристаллическую решётку платины и возникновение отрицательного заряда на ней. Так появляется отрицательный потенциал на платине в растворе, содержащем ионы Cr2+. В двойном слое устанавливается равновесие Cr2+
Fe2+. Таким образом, возникает положительный потенциал на платине, который будет тем выше, чем больше окислительная способность катиона. И, наоборот, чем сильнее восстановительная активность иона, тем вероятней отдача электрона им в кристаллическую решётку платины и возникновение отрицательного заряда на ней. Так появляется отрицательный потенциал на платине в растворе, содержащем ионы Cr2+. В двойном слое устанавливается равновесие Cr2+ 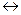 Cr3+ + e. Потенциал платины в разобранных двух примерах определяется соотношением активных концентраций окисленной и восстановленной формы ионов и характеризует окислительно-восстановительную способность каждой из систем Fe2+, Fe3+ / Pt и Cr2+,Cr3+ / Pt, потому этот потенциал называется окислительно - восстановительным.
Cr3+ + e. Потенциал платины в разобранных двух примерах определяется соотношением активных концентраций окисленной и восстановленной формы ионов и характеризует окислительно-восстановительную способность каждой из систем Fe2+, Fe3+ / Pt и Cr2+,Cr3+ / Pt, потому этот потенциал называется окислительно - восстановительным.
Во всех случаях возникающему электродному потенциалу присваивают тот знак, который имеет поверхность металла в двойном электрическом слое.
Разные металлы имеют различные потенциалы. Чем более активным является металл, тем отрицательнее его равновесный потенциал.
Потенциал электрода в растворе зависит не только от природы металла, но и от концентрации раствора и температуры. Зависимость равновесного потенциала электрода от концентрации выражается уравнением Нернста:
E 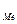 = E
= E  +
+  ln [Men+],
ln [Men+],
где [Men+] -концентрация ионов металла в растворе, г - моль/л;
R - универсальная газовая постоянная; 8,314 Дж/град. моль
n - валентность металла;
F - число Фарадея; 96 494 Кл/г-экв.
Т - температура раствора.
Подставив значение R и F при T = 2980, получим уравнение в приведенном виде:
EMe = E  +
+  lg [Men+],
lg [Men+],
где E  - стандартное значение электродного потенциала.
- стандартное значение электродного потенциала.
Потенциал называется стандартным (нормальным) в том случае, когда активность каждого из участников обратимой электродной реакции равна единице. Если окислитель или восстановитель в системе находится в газообразном состоянии (O2, Cl2, H2 и др.), то а = 1 при давлении газа 1 атм.
Так как до сих пор не существует методов измерения абсолютных величин потенциалов, то в качестве потенциала сравнения, условно принятого за нуль, выбран потенциал нормального водородного электрода (концентрация ионов [H+] в растворе H2SO4 равна 1 г – ион/л и p = 1 атм). По отношению к этому стандартному электроду измеряют потенциалы различных электродов. Значения стандартных электродных потенциалов сведены в таблицу. Ряд стандартных электродных потенциалов называют также рядом напряжений металлов. Каждый металл, стоящий в ряду напряжений левее, более активен,
чем следующий за ним, может вытеснять из растворов солей все металлы, которые следуют за ним; могут вытеснять водород из кислот, если стоят левее водорода.
Гальванические элементы
Гальваническими элементами называются устройства, в которых химическая энергия окислительно-восстановительной реакции превращается в электрическую. Гальванический элемент состоит из 2-х металлических электродов, помещённых в раствор электролитов, т.е. из 2-х полуэлементов.
Рассмотрим работу гальванического элемента, составленного из 2-х полуэлементов Zn2+ / Zn и Cu2+ / Cu, т.е. медная пластина погружена в раствор CuSO4, и цинковая пластина – в ZnSO4. (рис.61). Для предотвращения прямого воздействия и взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой. На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие Zn 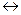 Zn2+ + 2ē. В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие Cu
Zn2+ + 2ē. В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие Cu 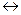 Cu2+ + 2 ē. В результате возникает электродный потенциал меди. Потенциал цинкового электрода отрицательнее потенциала медного электрода (E
Cu2+ + 2 ē. В результате возникает электродный потенциал меди. Потенциал цинкового электрода отрицательнее потенциала медного электрода (E  /
/  =-0,76В < Е
=-0,76В < Е  /
/  =+0,34В).
=+0,34В).
При замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, вследствие разности потенциалов часть электронов с цинковой пластинки перейдёт на медную.
Это нарушит равновесие в двойном электрическом слое у цинка. Обе системы стремятся снова к равновесию за счёт окисления цинка и восстановления катионов меди на медном электроде. Этими процессами сохраняется разность потенциалов пластинок, обеспечивающая постоянный переход электро-
Рис. 61. Схема гальванического элемента Якоби – Даниэля.
нов по проволоке от цинка к меди – электрический ток в цепи. Во внутреннем участке цепи анионы SО  перемещаются от медного электрода к цинковому, а катионы цинка Zn2+ и меди Сu2+ - в обратном направлении. Суммарный процесс выражается тем же уравнением реакции Zn + CuSO4 = ZnSO4 + Cu, что и при непосредственном взаимодействии окислительно - восстановительных систем Zn2+ / Zn и Cu2+ / Cu0.
перемещаются от медного электрода к цинковому, а катионы цинка Zn2+ и меди Сu2+ - в обратном направлении. Суммарный процесс выражается тем же уравнением реакции Zn + CuSO4 = ZnSO4 + Cu, что и при непосредственном взаимодействии окислительно - восстановительных систем Zn2+ / Zn и Cu2+ / Cu0.
Электрический ток в гальваническом элементе возникает за счёт окислительно - восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделёнными: на положительном электроде происходит процесс восстановления, на отрицательном - процесс окисления. Электрод, на котором происходит процесс восстановления, называется катодом (Cu), окисления - анодом (Zn).
Необходимое условие работы гальванического элемента - разность потенциалов электродов, которая называется электродвижущей силой гальванического элемента – ЭДС или ε.
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определённая услов-
ность в значении схемы элемента. Она заключается в том, что записанный слева электрод должен быть отрицательным. Например, элемент Даниэля - Якоби схематически изображается так:
(-) Zn |ZnSO4| |CuSO4| Cu (+)
Двойная черта указывает на то, что диффузионный потенциал между растворами ZnSO4 и CuSO4 устранён. Это достигается применением промежуточного насыщенного раствора KCl или KNO3 с одинаковой подвижностью катионов и анионов. ЭДС элемента определяется разностью электродных потенциалов меди и цинка, т.е. ЭДС = Е  /
/  - E
- E  /
/ 
ЭДС = Е Cu – Zn = 0,34 - (- 0,76) = 1,1 (В), если концентрация ионов цинка и меди равна 1 г – ион / л.
Если на электродах испытывает превращение один г – экв. вещества, то по закону Фарадея через систему протекает один фарадей электричества, при превращении одного моля вещества - n фарадеев электричества, равное числу грамм - эквивалентов в одном моле вещества. Таким образом, максимальная электрическая работа гальванического элемента при превращении одного моля вещества Aэр равна
Aэр = nFE,
где Е - Э.Д.С. гальванического элемента.
С другой стороны, максимальная полезная работа Амр, которую может совершить система при протекании реакции (p = const), равна энергии Гиббса реакции:
Aмp = - Δ G
Так как Aэp = Aэр, то получим
Е = - Δ G / nF
Для реакции, протекающей в элементе Даниэля – Якоби
Zn + CuSO4 = ZnSO4 + Cu
Изменение свободной энергии в стандартных условиях равно -51,85 ккал (-216946 Дж); подставляя эту величину получим:
Е = -  1,1 В.
1,1 В.
Эта величина совпадает с ЭДС, вычисленной по разности стандартных потенциала меди и цинка.
Таким образом, главный критерий возможности самопроизвольного течения реакции в данном направлении - положительное значение вычисленной ЭДС соответствующего элемента.
Прямым измерением разности потенциалов на клеммах гальванического элемента при помощи обычного вольтметра можно получить значение напряжения U, которое не равно ЭДС элемента: U < ЭДС, что обусловлено падением напряжения внутри элемента и другими эффектами. Поэтому измерение ЭДС обычно проводят компенсационным методом, при котором сила тока, протекающего через элемент, близка к нулю. Для этого к элементу подводят ЭДС с противоположным знаком от внешнего источника тока, значение которой можно регулировать тем или иным способом. В измерительную цепь включают также гальванометр для регистрации тока и вольтметр для измерения напряжения. В момент, когда выходное напряжение внешнего источника тока равно ЭДС гальванического элемента (момент компенсации ЭДС), сила тока в цепи равна нулю (стрелка гальванометра не отклоняется). Измеренное в этот момент напряжение на клеммах гальванического элемента равно его ЭДС. Менее точный метод измерения ЭДС может быть использован с помощью высокоомного вольтметра, при измерении которым мала сила тока, протекающего через элемент, поэтому невелика разница между ЭДС и напряжением элемента.



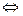 Ме2+(раствор), т.к. по мере увеличения заряда пластинки переход катионов в одноимённо заряженный раствор затрудняется. Если при установлении контакта металл-раствор скорость перехода катионов из металла в раствор была меньше, чем скорость их перехода в обратном
Ме2+(раствор), т.к. по мере увеличения заряда пластинки переход катионов в одноимённо заряженный раствор затрудняется. Если при установлении контакта металл-раствор скорость перехода катионов из металла в раствор была меньше, чем скорость их перехода в обратном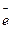


 в двойном электрическом слое слагается из падения потенциала в адсорбционном и диффузионном слое.
в двойном электрическом слое слагается из падения потенциала в адсорбционном и диффузионном слое. +
+ 
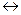 Cr3+ + e. Потенциал платины в разобранных двух примерах определяется соотношением активных концентраций окисленной и восстановленной формы ионов и характеризует окислительно-восстановительную способность каждой из систем Fe2+, Fe3+ / Pt и Cr2+,Cr3+ / Pt, потому этот потенциал называется окислительно - восстановительным.
Cr3+ + e. Потенциал платины в разобранных двух примерах определяется соотношением активных концентраций окисленной и восстановленной формы ионов и характеризует окислительно-восстановительную способность каждой из систем Fe2+, Fe3+ / Pt и Cr2+,Cr3+ / Pt, потому этот потенциал называется окислительно - восстановительным.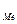 = E
= E  +
+  ln [Men+],
ln [Men+], lg [Men+],
lg [Men+], /
/  =-0,76В < Е
=-0,76В < Е  /
/  =+0,34В).
=+0,34В).
 перемещаются от медного электрода к цинковому, а катионы цинка Zn2+ и меди Сu2+ - в обратном направлении. Суммарный процесс выражается тем же уравнением реакции Zn + CuSO4 = ZnSO4 + Cu, что и при непосредственном взаимодействии окислительно - восстановительных систем Zn2+ / Zn и Cu2+ / Cu0.
перемещаются от медного электрода к цинковому, а катионы цинка Zn2+ и меди Сu2+ - в обратном направлении. Суммарный процесс выражается тем же уравнением реакции Zn + CuSO4 = ZnSO4 + Cu, что и при непосредственном взаимодействии окислительно - восстановительных систем Zn2+ / Zn и Cu2+ / Cu0. 1,1 В.
1,1 В.


