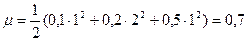Электролитами называют вещества, которые в полярных растворителях или в расплавленном виде распадаются на ионы и проводят электрический ток.
Распад вещества на ионы под влиянием полярных молекул растворителя называется электролитической диссоциацией. Разделение веществ на электролиты и не электролиты понятие условное.
Соли, кислоты, основания - электролиты в воде, а в бензоле - неэлектролиты. Это связано с диэлектрической постоянной растворителя  .
.
f = 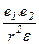 ,
,
где f - связь между ионами; r - расстояние между ионами; e1 и e2 - заряды ионов.
Например, 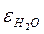 = 80, это значит, что связь в воде ослабляется в 80 раз.
= 80, это значит, что связь в воде ослабляется в 80 раз.
 = 2, следовательно, связь в бензоле ослабляется в 2 раза.
= 2, следовательно, связь в бензоле ослабляется в 2 раза.
Электролитической диссоциации подвергаются вещества с ионной связью или сильно полярной.
Перенос тока в растворах и расплавах осуществляется ионами, поэтому их в отличие от электронных проводников называют ионными проводниками или проводниками второго рода. Положительно заряженные ионы называют катионами.
Отрицательно заряженные анионами. Ионы в растворе находятся в состоянии неупорядоченного теплового движения. Растворы электронейтральны Σ + = Σ –
Особенности растворов электролитов. Растворы электролитов не подчиняются законам Рауля и Вант - Гоффа.
Опытные величины  ,
,  ,
,  превышают расчетные в одно и тоже число раз.
превышают расчетные в одно и тоже число раз.
Объясняется это тем, что в растворах электролитов содержится больше ионов, чем в растворах не электролитов.
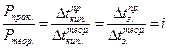
Например, в NaCl n = 2 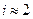 , а в MgCl2 n = 3
, а в MgCl2 n = 3 
Вант - Гофф ввел поправочный коэффициент i, который называется изотоническим коэффициентом. Подстановка этого коэффициента позволяет использовать эти формулы для всех растворов. Физический смысл этого коэффициента был выяснен, когда был установлен механизм электролитической диссоциации.
Как известно теорию электролитической диссоциации предложил шведский химик Аррениус, который, однако, рассматривал растворы как механическую смесь молекул и ионов растворенного вещества с молекулами растворителя. Таким образом, отрицая взаимодействие между ними, теория Аррениуса имела лишь физический смысл. Менделеев развил теорию растворов и предложил свою сольватную теорию растворения (гидратную). И. А. Каблуков объединил эти две теории и развил свою физико-химическую теорию растворения.
По Аррениусу диссоциация уксусной кислоты:
CH3COOH  CH3COO- + H+
CH3COO- + H+
По Менделееву:
CH3COOH + (n+m) H2O  CH3COO- ∙ nH2O + H+∙ mH2O
CH3COO- ∙ nH2O + H+∙ mH2O
Особенностью сольватов как химических соединений является то, что коэффициенты n и m меняются с изменением концентрации, температуры и других параметров раствора.
Слабые и сильные электролиты. В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации  – отношение числа молекул, диссоциированных на ионы, к общему числу молекул:
– отношение числа молекул, диссоциированных на ионы, к общему числу молекул: 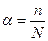 ,
,
 выражается в долях единицы или в %. Если
выражается в долях единицы или в %. Если  =20 %, значит из 100 растворенных молекул 20 диссоциирует на ионы.
=20 %, значит из 100 растворенных молекул 20 диссоциирует на ионы.
 зависит от: 1) природы электролита;
зависит от: 1) природы электролита;
2) концентрации раствора;
3) температуры раствора;
4) природы растворителя.
Примеры:
1) Для солей  изменяется от 35 до 90 %.
изменяется от 35 до 90 %.
Для кислот HF  = 8 % - слабая
= 8 % - слабая
H2SO4  = 60 % - сильная
= 60 % - сильная
HNO3 , HCl  = 90 - 95 %
= 90 - 95 %
CH3COOH  = 1,4 %
= 1,4 %
H2CO3  = 0,17 % первая ступень практически не диссоциирует.
= 0,17 % первая ступень практически не диссоциирует.
HCN  = 0,01 %
= 0,01 %
H2O  = 1,8∙ 10-9 %
= 1,8∙ 10-9 %
Вообще говоря, принято, если  > 30 % - это сильные электролиты;
> 30 % - это сильные электролиты;  от 3 до 30 - средней силы и менее 3 % - слабые электролиты.
от 3 до 30 - средней силы и менее 3 % - слабые электролиты.
2) От концентрации.
HCl 1 H раствор  = 78 %
= 78 %
0,1 H раствор  = 91 %
= 91 %
CH3COOH 0,1 H раствор  = 1,4 %
= 1,4 %
0,01 H раствор  = 4,2 %
= 4,2 %
0,001 H раствор  = 12,4 %
= 12,4 %
3) Увеличение  с ростом температуры обусловлено увеличением колебательного движения молекул и ионов ослабляется связь;
с ростом температуры обусловлено увеличением колебательного движения молекул и ионов ослабляется связь;
4) От природы растворителя.
Чем больше 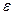 - диэлектрическая постоянная, тем больше
- диэлектрическая постоянная, тем больше  .
.
Слабые электролиты. В растворах слабых электролитов процесс диссоциации протекает обратимо, и, следовательно, к нему может быть применен закон действия масс. Так, для процесса диссоциации CH3COOH константа равновесия равна
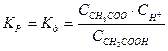
Константу равновесия для процесса диссоциации называют константой диссоциации  , которая зависит от природы диссоциирующего вещества, природы растворителя, температуры, и не зависит от концентрации раствора.
, которая зависит от природы диссоциирующего вещества, природы растворителя, температуры, и не зависит от концентрации раствора.
 указывает на прочность молекул в данном растворе.
указывает на прочность молекул в данном растворе.
Чем меньше  , тем слабее диссоциирует электролит и тем устойчивее его молекула. Учитывая, что
, тем слабее диссоциирует электролит и тем устойчивее его молекула. Учитывая, что  в отличие от
в отличие от  изменяется с концентрацией раствора необходимо выяснить взаимосвязь между этими величинами на примере диссоциации CH3COOH. Если исходную концентрацию раствора принять равной С, а степень диссоциации -
изменяется с концентрацией раствора необходимо выяснить взаимосвязь между этими величинами на примере диссоциации CH3COOH. Если исходную концентрацию раствора принять равной С, а степень диссоциации -  , то
, то  С - число продиссоциированных молекул, так как при диссоциации каждая молекула распадается на один анион CH3COO- и один катион H+ , то равновесная концентрация этих ионов будет совпадать между собой и равна
С - число продиссоциированных молекул, так как при диссоциации каждая молекула распадается на один анион CH3COO- и один катион H+ , то равновесная концентрация этих ионов будет совпадать между собой и равна  С.
С.
Равновесная концентрация нераспавшихся молекул будет равна С -  С или (1-
С или (1-  ) С, тогда
) С, тогда
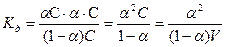 ,
,
где V=1/С - разведение раствора.
Это уравнение называют законом разведения Оствальда.
Для растворов слабых электролитов, у которых степень диссоциации меньше единицы это уравнение можно упростить, считая, что разность (1-  ) примерно равна единице.
) примерно равна единице.
Тогда 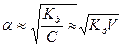
Электролиты сильные. Сильные электролиты это вещества, которые в растворах практически полностью диссоциируют на ионы 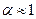 или 100 %.
или 100 %.
В растворах сильных электролитов вследствие полной их диссоциации концентрация ионов велика. Поэтому свойства таких растворов будут существенно зависеть от степени взаи-
модействия входящих в их состав ионов как друг с другом, так и с полярными молекулами растворителя. Взаимодействие ионов в растворах сильных электролитов будет приводить к тому, что катионы и анионы будут испытывать взаимное притяжение, анионы одного знака будут отталкиваться друг от друга. Каждый ион будет окружен противоположно заряженными ионами, которые будет располагаться в виде сферы, которая называется ионной атмосферой. Суммарный заряд ионной атмосферы равен по величине заряду центрального атома и противоположен ему по знаку; все ионы в растворе равноправны, поэтому каждый из них является центральным атомом и одновременно входит в состав ионной атмосферы. С увеличением концентрации раствора электролита уменьшается среднее расстояние между противоположно заряженными ионами. В этом случае начинают играть роль близкодействующие силы химической связи.
Поскольку в растворах сильных электролитов существуют сложные взаимодействия ионов и молекул, то для количественного описания свойств растворов электролитов было признано целесообразно сохранить все общие закономерности,
применимые к идеальным растворам, но вместо входящей в них концентрации компонентов ввести новую величину - активную концентрацию или активность, формально заменяющую концентрацию. Активность связана с концентрацией следующим соотношением
а = fc,
где f - коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе. f определяют экспериментально. Для этого измеряют, например, электропроводность (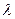 ) и определяют f как частное от деления экспериментально полученной величины на теоретически рассчитанную по законам идеальных растворов:
) и определяют f как частное от деления экспериментально полученной величины на теоретически рассчитанную по законам идеальных растворов:

Т.к. f - безразмерная величина, то активность имеет ту же размерность, что и его концентрация. Коэффициент системной зависимости от природы.
f - меняется в широких пределах, в области разбавленных растворов он стремится к единице, а в высококонцентрированных растворах может достигать единицу и даже сотен.
В области разбавленных растворов (ниже 0,1 моль/л) коэффициенты активности зависят главным образом от концентрации и заряда ионов присутствующих в растворе, и мало зависят от природы растворенных веществ. Эта закономерность известна под названием «правила ионной силы». Ионной силой раствора называется полусумма произведений концентраций всех ионов, присутствующих в растворе на квадрат их заряда:
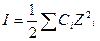 или
или 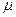
Правило ионной силы позволяет рассчитать коэффициенты активности отдельных ионов в разбавленных растворах. f уменьшаются с увеличением 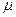 раствора.
раствора.
Так, например, ионная сила раствора, содержащего 0,1 моль HCl и 0,2 моль CaCl2 в 1 л, равна
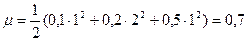
Здесь 0,1 – концентрация Н+; 0,2 – концентрация Ca+2 и 0,5 – концентрация Cl-.
Для НCl в 0,001 м растворе f = 0,965 (~1), т.е. а = с
в 3,0 м растворе f = 1,316, т.е. а = 1,316∙ 3=3,948.



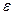 .
.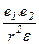 ,
,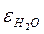 = 80, это значит, что связь в воде ослабляется в 80 раз.
= 80, это значит, что связь в воде ослабляется в 80 раз. = 2, следовательно, связь в бензоле ослабляется в 2 раза.
= 2, следовательно, связь в бензоле ослабляется в 2 раза. ,
,  ,
,  превышают расчетные в одно и тоже число раз.
превышают расчетные в одно и тоже число раз.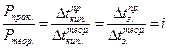
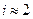 , а в MgCl2 n = 3
, а в MgCl2 n = 3 
 CH3COO- + H+
CH3COO- + H+ CH3COO- ∙ nH2O + H+∙ mH2O
CH3COO- ∙ nH2O + H+∙ mH2O – отношение числа молекул, диссоциированных на ионы, к общему числу молекул:
– отношение числа молекул, диссоциированных на ионы, к общему числу молекул: 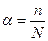 ,
,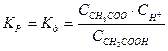
 , которая зависит от природы диссоциирующего вещества, природы растворителя, температуры, и не зависит от концентрации раствора.
, которая зависит от природы диссоциирующего вещества, природы растворителя, температуры, и не зависит от концентрации раствора.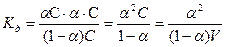 ,
,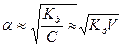
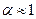 или 100 %.
или 100 %.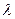 ) и определяют f как частное от деления экспериментально полученной величины на теоретически рассчитанную по законам идеальных растворов:
) и определяют f как частное от деления экспериментально полученной величины на теоретически рассчитанную по законам идеальных растворов:
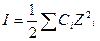 или
или