В создании современной физико-химической теории растворов большую роль сыграли работы русских ученых Д. И. Менделеева, И. А. Каблукова, Д. П. Коновалова, Н. А. Измайлова.
До конца XIX века растворы считались физическими смесями двух или нескольких веществ, в которых отсутствуют какие - либо взаимодействия между растворенным веществом и растворителем.
Химические явления в процессе растворения впервые были отмечены Д. И. Менделеевым. Он высказал предположение о существовании в растворах определенных химических соединений растворенного вещества с водой. Эта идея явилась основой физико-химической теории растворения. Менделеев опирался на следующие экспериментальные факты:
1) процесс растворения сопровождается тепловым эффектом;
2) при растворении изменяется объем; например, при растворении спирта в воде объем раствора уменьшается на 3,5 % по сравнению с общим объемом взятых веществ за счет образования сольватов;
3) при растворении иногда происходит изменение окраски; например, CuSO4 - белый порошок, при растворении в воде образует раствор синего цвета за счет образования аквокомплексов [Cu (H2O)6] 2+.
Все эти факты говорят о том, что жидкие растворы надо рассматривать как химические соединения. Однако химические соединения, образующиеся в растворах не имеют постоянный состав. Это сближает их c механическими смесями. Таким образом, жидкие растворы занимают промежуточное положение между химическими соединениями постоянного состава и механическими смесями. Процесс растворения есть физико-химический процесс.
Химическое взаимодействие молекул растворителя с частицами растворенного вещества называется сольватацией, а получающиеся при этом соединения сольватами. Частный случай взаимодействия частиц растворенного вещества с растворителем - водой был назван гидратацией, а продукты взаимодействия (например, H2SO4∙H2O) - гидратами. В соответствии с гидратной теорией растворов механизм растворения веществ в воде можно представить следующим образом. Молекула воды есть диполь (M = 1,84 D); поэтому вода - сильно полярная жидкость. Молекулы H2O взаимодействуют своими полюсами с растворенным веществом, например, ионами (положительно заряженными катионами Na+) вещества.
Образуются ассоциаты или гидратные комплексы, т.е. каждый ион окружен гидратной оболочкой (или сальватной).
Распад вещества на сальватированные ионы под действием молекул растворителя называется электролитической диссоциацией.
Возможность и степень распада на ионы определяется природой растворенного вещества и растворителя.
При растворении веществ с ионной структурой молекулы растворителя удерживаются около иона силами электростатического притяжения. Диссоциация ионных соединений протекает тем легче, чем полярнее молекулы растворителя.
При растворении веществ в молекулярной структуре сольваты образуются вследствие диполь-дипольного взаимодействия. Полярный растворитель наводит диполь в молекуле растворенного вещества. Кроме того, при растворении может иметь место донорно - акцепторное взаимодействие. Ионы растворенного вещества выступают в качестве акцепторов, а молекулы растворителя - в качестве донора электронных пар.
Следовательно, химизм процесса растворения проявляется в образовании сольватов, состав которых непостоянен, зависит от условий растворения.
Многие вещества, выделенные из водных растворов, содержат кристаллизационную воду - это кристаллогидраты, например, CuSO4 ∙ 5 H2O, Na2SO4 ∙ 10 H2O.
Существование кристаллогидратов подтверждает химизм процесса растворения. Процесс растворения одновременно и физический процесс. Образовавшиеся сольваты диффундируют по всему объему растворителя. Сущность растворения в других растворителях та же. При этом важную роль играет природа растворителя и диэлектрическая постоянная растворителя 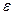 . Чем больше
. Чем больше 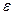 , тем лучше растворитель.
, тем лучше растворитель.
Растворимость газа в жидкости увеличивается с повышением давления и уменьшается с повышением температуры. Зависимость растворимости газа от давления выражается правилом Генри: растворимость газа прямопропорциональна давлению. При постоянной температуре x = кp - уравнение изотермы растворимости, где x - концентрация насыщенного раствора, обычно выражаемая в см3 газа, растворенного в 1 см3 жидкого растворителя; к - коэффициент, характеризующий природу компонентов, составляющих раствор, p - давление.
Зависимость растворимости газа от температуры при постоянном давлении выражается уравнением lg x =  - уравнение изобары растворимости, где Т - абсолютная температура; A и B - коэффициенты, характеризующие раствор.
- уравнение изобары растворимости, где Т - абсолютная температура; A и B - коэффициенты, характеризующие раствор.
Растворимость жидкости в жидкости обычно увеличивается с повышением температуры и почти не зависит от давления.
В системах жидкость - жидкость, когда имеет место ограниченная растворимость первой жидкости во второй и второй жидкости в первой, наблюдается расслаивание.
Так как с повышением температуры растворимости обычно возрастают, то при некоторой температуре происходит полное взаимное растворение. Эта температура называется критической температурой растворения.
Растворимость твердого тела в жидкости при постоянном давлении увеличивается с повышением температуры, следуя в первом приближении к уравнению:
lg x = 
Растворимость твердого тела в некоторых случаях уменьшается с повышением температуры. Для таких случаев в уравнении коэффициент B имеет отрицательное значение. Давление влияет на растворимость твердого тела в жидкости лишь незначительно.
Растворимость третьего компонента в двух несмешивающихся жидкостях можно проследить на примере системы, состоящей из двух фаз - жидких. В эту систему следует ввести третье вещество, которое химически не взаимодействует с каждой из жидкостей, но растворяется в них. При этом вещество растворится как в первой, так и во второй жидкости, и теперь будут граничить между собой два раствора: в первом концентрация С1 и во втором С2
При данных условиях равновесное распределение третьего компонента между двумя несмешивающимися жидкостями обычно отвечает постоянству отношений концентраций  = K
= K
Это отношение представляет собой математическое выражение закона распределения (Бертло); К - называется коэффициентом распределения и является постоянной величиной.



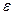 . Чем больше
. Чем больше  - уравнение изобары растворимости, где Т - абсолютная температура; A и B - коэффициенты, характеризующие раствор.
- уравнение изобары растворимости, где Т - абсолютная температура; A и B - коэффициенты, характеризующие раствор. = K
= K

