Химических реакций
Если равенство энтальпийного и энтропийного факторов процесса, протекающего в изобарно – изотермических условиях, свидетельствует о равновесном состоянии системы (при p = const и T = const), то разность между ними
∆ H - T ∆ S = ∆ G
является критерием направления и предела самопроизвольного протекания изобарно – изотермического процесса. Термодинамическая функция состояния системы G = H - T S называется энергией Гиббса, а ∆ G – изменением энергий Гиббса химической реакции.
Энергия Гиббса химической реакции является изменением термодинамической функции состояния системы, не зависит от пути перехода, а определяется начальным и конечным состоянием системы:
∆ G = G2 – G1,
где G1 и G2 – энергия Гиббса системы в состоянии 1 и 2 соответственно.
При расчете энергии Гиббса химической реакции следует иметь в виду, что
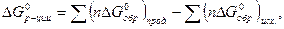
где  - стандартная энергия Гиббса химической реакции,
- стандартная энергия Гиббса химической реакции,  и
и  - стандартные энергии Гиббса образования продуктов реакции и исходных веществ.
- стандартные энергии Гиббса образования продуктов реакции и исходных веществ.
Стандартной энергией Гиббса образования химического соединения  называют энергию Гиббса реакции образования одного моля этого соединения, находящегося в стандартном состоянии, из соответствующих простых веществ, также находящихся в стандартных состояниях и термодинамики устойчивых при данной температуре, фазах и модификациях.
называют энергию Гиббса реакции образования одного моля этого соединения, находящегося в стандартном состоянии, из соответствующих простых веществ, также находящихся в стандартных состояниях и термодинамики устойчивых при данной температуре, фазах и модификациях.
Стандартные энергии Гиббса образования простых веществ принимают равными нулю, если их агрегатные состояния и модификации устойчивы при стандартных условиях.
В изобарно – изотермических условиях реакция протекает самопроизвольно в том направлении, которому отвечает убыль энергии Гиббса системы (G2 < G1). Поэтому условием самопроизвольного течения реакции при заданных p и T является неравенство ∆ Gp, T < 0.
Увеличение изобарного потенциала ∆ G > 0 свидетельствует о невозможности осуществления процесса в данных условиях. Если же ∆ G = 0, то система находится в состоянии равновесия.
Пример. Определить, возможен ли процесс при стандартных условиях
CuO (т.) + CO (г.) = Cu (т.) + CO (г.)
 = -127 кДж/моль;
= -127 кДж/моль;  = -137, 14 кДж/моль;
= -137, 14 кДж/моль;
 = -394, 38 кДж/моль;
= -394, 38 кДж/моль;

 - (
- ( +
+  )
)
 -394, 38 – (- 127 – 137, 14) = -130, 24 кДж
-394, 38 – (- 127 – 137, 14) = -130, 24 кДж
 < 0, следовательно, данная реакция протекает самопро-
< 0, следовательно, данная реакция протекает самопро-
извольно и необратимо в стандартных условиях.
Факторы, определяющие возможность процесса. Величина стандартной энергии Гиббса химической реакции ∆ G0 не может быть критерием направления или предела самопроизвольного протекания процесса в условиях, отличных от стандартных. Это затрудняет использование энергии Гиббса для оценки процессов, протекающих в реальных условиях. И только для получения сугубо ориентированных данных можно считать, что 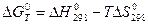
Направление химических реакций зависит от их характера. Так, для экзотермических реакций (∆ H < 0), у которых в процессе их протекания возрастает число газообразных веществ (∆ S > 0) ∆ G < 0 при любых температурах. Такие реакции протекают самопроизвольно и являются необратимыми. Примером является реакция разложения перекиси водорода:
2H2O2 (г.) → 2H2O (г.) + O2 (г.)
∆H = -211 кДж, ∆S = 129,6 Дж/К; ∆G = - 250 кДж.
Эндотермические реакции (∆ H > 0), в результате которых уменьшается число молей газообразных веществ (∆ S < 0), самопроизвольно в прямом направлении протекать не могут, поскольку для таких реакций ∆ G > 0 при любых температурах. Примером такой реакции является окисление азота.
N2 (г) + 2O2 (г) = 2NO2 (n)
 67,7 кДж;
67,7 кДж;  - 120 Дж/К;
- 120 Дж/К;  = 103,7 кДж.
= 103,7 кДж.
Направление химических реакций зависит не только от энтальпийного и энтропийного факторов, но и от температуры. Если в результате экзотермической реакции (∆ H < 0) уменьшается число молей газообразных веществ (∆ S < 0), то самопроизвольно они могут протекать при низких температурах. Примером такой реакции является синтез аммиака:
3H2 (г) + N2 (г.) = 2NH3 (г.)
 - 92 кДж;
- 92 кДж;  - 198 Дж/К;
- 198 Дж/К;  = - 33,4 кДж.
= - 33,4 кДж.
В стандартных условиях (T = 298 К) эта реакция возможна, однако при T > 298 К реакция в прямом направлении становится невозможной. (∆ G > 0).
Для определения температуры, ниже которой ∆ G < 0, необходимо определить температуру равновесного состояния Tp ., когда ∆ G = ∆ H - ∆ S∙ Tp.= 0, откуда Tp =  .
.
Если в результате эндотермической реакции (∆ H > 0) увеличивается число молей газообразных веществ (∆ S > 0), то при невысоких температурах, когда │∆ H│ > │T ∆ S│, самопроизвольно прямая реакция протекать не может (∆ G > 0). В прямом направлении реакции будет протекать при условии, если T > Tp, когда │∆ H│ < │T ∆ S│ и ∆ G < 0. Например, эта реакция получения водорода при взаимодействии метана и водяного пара:
CH4 (г) + 2H2O (г) = CO2 (г) + 4H2 (г)
 164,9 кДж;
164,9 кДж;  172,41 Дж/моль∙К;
172,41 Дж/моль∙К;
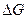 = 110,3 кДж.
= 110,3 кДж.
Как видно в стандартных условиях эта реакция самопроизвольно в прямом направлении идти не может (∆ G > 0). Однако при температуре выше T p = 962 К реакция становится возможной, поскольку ∆ G < 0.
Глава 6. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Как было показано ранее, химическая термодинамика позволяет установить принципиальную возможность или невозможность самопроизвольного течения химических реакций, а
также рассчитать равновесные концентрации реагирующих веществ. Однако, знание рассмотренных закономерностей еще недостаточно, чтобы предсказать реальную возможность протекания химической реакции, определить скорость реакции и ее механизм, а также управлять процессом. Быстрота реакции зачастую не связана со значением ее энергии Гиббса. Например, термодинамическая вероятность реакции окисления водорода до воды
Н2 + 1/2 O2 = Н2O (ж), ∆ G  = - 237,2 кДж/моль
= - 237,2 кДж/моль
значительно выше, чем вероятность реакции нейтрализации с образованием воды
H+ + ОН- = Н2O (ж), ∆ G  = - 79,9 кДж/моль.
= - 79,9 кДж/моль.
В то же время первая реакция в обычных условиях без катализатора практически не идет, а вторая реакция протекает практически мгновенно. Скорость и механизм химических реакций изучает химическая кинетика.
Общие понятия. Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. В зависимости от типа химической реакции (гомогенная пи гетерогенная) меняется характер реакционного пространства.
Гомогенной реакцией называется реакция, протекающая в однородной среде (в одной фазе). Гетерогенные реакции протекают на границе раздела фаз, например твердой и жидкой, твердой и газообразной.
Реакционным пространством гомогенных реакций является объем, заполненный реагентами. Так как отношение количества вещества к единице объема называется концентрацией с, то скорость гомогенной реакции равна изменению концентрации исходных веществ или продуктов реакции во времени. Различают среднюю и мгновенную скорости реакции. Средняя скорость реакции равна:
v = (c2 - c1) / (t2 - tl) = -∆ c / ∆ t,
где c2 и c1 - концентрации исходного вещества в момент времени t2 и t1 .
Знак минус означает, что концентрация исходного вещества уменьшается. В ходе реакции изменяются концентрации реагирующих веществ и соответственно скорость реакции. Скорость реакции в данный момент времени или, мгновенная (истинная) скорость реакции v, равна:
v = ± dc / dt.
Скорость реакции принимается всегда положительной, поэтому, производная исходных концентраций берется со знаком минус, а продуктов реакции - со знаком плюс.
Из определения скорости реакции и анализа уравнения следует, что скорость реакции в СИ имеет единицу измерения [моль∙м-3∙с-1], однако также используются и другие единицы измерения [моль∙л-1∙с-1], [моль∙см-3∙с-1], [моль∙см-3∙мин-1].
В ходе реакции изменяются концентрации всех исходных веществ и продуктов реакции. Если у всех реагентов одинаковые стехиометрические коэффициенты, то изменения их концентраций (по модулю) во времени также одинаковы. Например, для реакции
СО + Н2O (г) = CO2 + Н2

Для реакций с различными стехиометрическими коэффициентами скорости изменения концентраций реагентов будут разными. Для реакции
bВ + dD—> lL + mМ

Например, для реакции
CH4 + 2Н2O (г) = СO2 + 4Н2

Как видно, концентрация H2O изменяется в 2 раза, а концентрация Н2 - в 4 раза быстрее, чем концентрации СН4 и СO2. Это и понятно, так как в ходе реакции на 1 моль СН4 расходуются 2 моль Н2O и образуются 1 моль СO2 и 4 моль Н2. Поэтому в уравнении скорости реакции указывают конкретный реагент (продукт реакции или исходное вещество).
Скорость реакции зависит от природы реагирующих веществ. Некоторые реакции, например взрывы, протекают мгновенно, другие могут идти годами. На скорость реакции влияют многие факторы: концентрация реагентов, температура, катализаторы, внешние воздействия, например излучения, пластическая деформация.



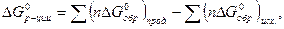
 - стандартная энергия Гиббса химической реакции,
- стандартная энергия Гиббса химической реакции,  и
и  - стандартные энергии Гиббса образования продуктов реакции и исходных веществ.
- стандартные энергии Гиббса образования продуктов реакции и исходных веществ. называют энергию Гиббса реакции образования одного моля этого соединения, находящегося в стандартном состоянии, из соответствующих простых веществ, также находящихся в стандартных состояниях и термодинамики устойчивых при данной температуре, фазах и модификациях.
называют энергию Гиббса реакции образования одного моля этого соединения, находящегося в стандартном состоянии, из соответствующих простых веществ, также находящихся в стандартных состояниях и термодинамики устойчивых при данной температуре, фазах и модификациях. = -127 кДж/моль;
= -127 кДж/моль;  = -137, 14 кДж/моль;
= -137, 14 кДж/моль; = -394, 38 кДж/моль;
= -394, 38 кДж/моль;
 < 0, следовательно, данная реакция протекает самопро-
< 0, следовательно, данная реакция протекает самопро-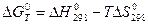
 67,7 кДж;
67,7 кДж;  - 120 Дж/К;
- 120 Дж/К;  = 103,7 кДж.
= 103,7 кДж. - 92 кДж;
- 92 кДж;  - 198 Дж/К;
- 198 Дж/К;  .
. = 110,3 кДж.
= 110,3 кДж. = - 237,2 кДж/моль
= - 237,2 кДж/моль





