Основные понятия и величины. Термодинамика изучает законы, которые описывают обмен энергией между изучаемой системой и внешней средой.
Химическая термодинамика – наука, изучающая переходы энергии из одной формы в другую при химических реакциях и устанавливающая направление и пределы их самопроизвольного протекания при заданных условиях.
Химическая термодинамика позволяет нам предсказывать устойчивость веществ и их способность реагировать в том или ином направлении, она дает способы расчета тепловых эффектов и глубины протекания реакции по заданному начальному состоянию.
Объектом изучения в термодинамике является система. Системой называется совокупность находящихся во взаимодействии веществ, мысленно обособленная (или фактически) от окружающей среды. Таким образом, вселенная разделяется на две части: систему, которая подвергается теоретическому и экспериментальному изучению и внешнюю среду, в которую входит остальная часть вселенной.
Различают гомогенные и гетерогенные системы. Гомогенной называется такая система, внутри которой нет поверхности раздела, отделяющих друг от друга части системы, различающиеся по свойствам. Системы же, внутри которых такие поверхности раздела имеются, называются гетерогенными. От этих понятий следует отличать понятия однородной и неоднородной систем. Гомогенные системы состоят из одной фазы, гетерогенные - из двух или несколько фаз. Фаза - это часть системы, однородная во всех точках по составу и свойствам и отдельная от других частей системы поверхностью раздела. Иными словами фаза есть гомогенная часть гетерогенной системы.
Примером гомогенной системы может служить водный раствор хлорида натрия. Но если этот раствор насыщен и на дне сосуда есть кристаллы NaCl, то рассматриваемая система гетерогенна. Другим примером гомогенной системы может служить вода, но вода с плавающим в ней льдом – система гетерогенная.
Одна и та же система может находиться в различных состояниях. Каждое состояние системы характеризуется определенным набором значений термодинамических параметров – иначе параметров состояния. В термодинамике чаще всего используются следующие параметры состояния: давление, температура, объем, состав системы.
Различают два типа параметров состояния: экстенсивные и интенсивные параметры. Экстенсивные параметры пропорциональны количеству вещества системы (например, объем, масса). Интенсивные параметры не зависят от количества вещества (температура, давление, вязкость). Изменение величины хотя бы одного только термодинамического параметра приводит к изменению состояния системы в целом - начинается процесс. Если процесс заключается в последовательном изменении параметров, приводящем в конечном итоге в исходное состояние, то такой процесс называется циклом. Термодинамическое состояние системы называют равновесным, если оно характеризуется постоянством термодинамических параметров во всех точках системы и не изменяются самопроизвольно (без затраты работы).
В химической термодинамике свойства системы рассматриваются в ее равновесных состояниях, например, некоторая система переходит из равновесного состояния 1, характеризующегося температурой T1 и давлением p1, в равновесное состояние 2, характеризующееся температурой T2 и давлением p2. Химическая термодинамика изучает систему в двух равновесных состояниях (конечном и начальном) и на этом основании определяет возможность (или невозможность) самопроизвольного течения процесса при заданных условиях в указанном направлении, характеризует энергетические изменения, происходящие в результате перехода, устанавливает значения температуры, давления, концентраций веществ в системе, при которых достигается максимальный выход процесса.
В зависимости от условий перехода системы из одного состояния в другое, в термодинамике различают изотермические, изобарические, изохорические и адиабатические процессы. Процессы, происходящие при постоянной температуре (T = const) называются изотермическими или, иначе изотермными; происходящие при постоянном давлении – изобарными (p = const), а происходящие при постоянном объеме (V = const) – изохорными. Адиабатными называют процессы, при которых система не принимает и не отдает теплоты q = 0, хотя может быть связана с окружающей средой работой, получаемой от нее и совершаемой над ней.
Химические реакции часто протекают при атмосферном давлении (p = const) и при комнатной температуре (T = const), т.е. в изобарно-изотермических условиях. Такие условия соблюдаются, когда взаимодействия между веществами осуществляются в открытых сосудах без нагревания или при более высокой, но постоянной температуре. Для химических реакций характерны и изохорно-изотермические условия (V = const, T = const), в которых взаимодействия протекают в автоклавах.
Теплота и работа. Система может обмениваться с внешней средой веществом или энергией в форме теплоты Q и работы A. Если такого обмена нет, то систему называют изолированной. Если в системе возможен энергообмен с окружающей средой, но не возможен обмен веществом – то это замкнутая система. Обмен энергией между системой и внешней средой может проявляться в различных формах: механическая, тепловая, электрическая и энергия излучения могут прямо или косвенно превращаться друг в друга.
В 1849 г. Джоуль осуществил первую количественную проверку эквивалентности тепловой энергии, или теплоты и механической работы.
В системе МКСА единицей количества работы является джоуль (1 дж = 107 эрг). Для измерения тепловой энергии используется калория – количество тепловой энергии, необходимое для повышения температуры 1 г воды с 14,5 до 15,5 0 С.
1 кал = 4,18 дж.
Теплота является мерой энергии, переданной от одного тела к другому, за счет разницы температуры этих тел. Эта форма передачи энергии связана с хаотическими столкновениями молекул менее нагретого тела. Переноса вещества при этом не происходит.
Работа является мерой энергии, переданной от одного тела к другому за счет перемещения масс под действием каких либо сил.
В химической термодинамике считают положительными теплоту, подводимую к системе, и работу, которую система совершает против внешних сил. Работа и теплота не являются свойствами системы и имеют значение только в процессе перехода системы из одного состояния в другое. Количество поглощенной (или выделенной) в процессе теплоты и совершенной работы зависят от способа проведения процесса, т.е. теплота и работа – функции пути.
Внутренняя энергия системы. В химической термодинамике одну из важнейших величин представляет внутренняя энергия рассматриваемой системы.
Физически термином – внутренняя энергия – обозначается величина, которая характеризует общий запас энергии системы, включая сюда энергию поступательного и вращательного движения молекул, энергию внутримолекулярного колебательного движения атомов и атомных групп, электронов в атомах, энергию, заключающуюся в ядрах атомов и другие виды энергии. Она не включает потенциальную энергию положения системы в пространстве и кинетическую энергию движения системы как целого. Абсолютная величина внутренней энергии системы не может быть определена, однако можно измерить ее изменение при переходе из одного состояния в другое (D U). Величина D U считается положительной D U > 0, если в каком-либо процессе внутренняя энергия системы возрастает.
Внутренняя энергия является термодинамической функцией состояния системы. Это значит, что когда система оказывается в данном состоянии, ее внутренняя энергия принимает определенное присущее этому состоянию значение. Таким образом, изменение внутренней энергии не зависит от пути и способа перехода системы из одного состояния в другое и определяется разностью величин внутренней энергии системы в этих двух состояниях:
D U = U2 - U1,
где U2 и U1 – внутренняя энергия системы в конечном и начальном состояниях соответственно.
Первый закон термодинамики
В любом процессе соблюдается закон сохранения энергии, выражаемый равенством:
Q = ∆ U + A,
которое означает, что сумма изменений внутренней энергии и совершенной (если над нею) работы равна сообщенной ей (или выделенной ею) теплоте.
Приведенное уравнение - математическое выражение первого закона термодинамики.
Первое начало термодинамики(первый закон) может быть сформулировано иначе следующим образом:
Изменение внутренней энергии ∆ U системы, переходящей из состояния 1 в состояние 2, - алгебраическая сумма всех энергий обменивающихся с внешней средой
Поскольку величины Q и A поддаются непосредственному измерению, при помощи уравнения всегда можно рассчитать значение ∆ U.
В первом законе термодинамики под работой A подразумевают сумму всех видов работы против сил, действующих на систему со стороны внешней среды. В эту сумму могут входить и работа против сил внешнего электрического поля, и работа против сил гравитационного поля, и работа расширения против сил внешнего давления, и другие виды работ.
Можно, например, всю энергию израсходовать на работу электромотора, который будет совершать механическую работу (подъем груза, сжатие газа и т.д.). В этом случае Q = 0,
∆ U = A. Можно разрядить батарею, соединяя ее с электронагревательными приборами, расходуя всю выделяющуюся энергию для получения теплоты. В этом случае A = 0; ∆ U = Q. Можно часть энергии израсходовать на получение работы, а другую часть на получение теплоты. Однако сумма полученной теплоты и произведенной работы будет одинаковой, если в разных случаях как начальные, так и конечные состояния были одинаковы. Эта сумма равна убыли внутренней энергии системы и не зависит от пути ее перехода.
Чаще всего в химии процессы протекают при постоянном объеме, либо при постоянном давлении.
Энтальпия системы. При постоянном объеме работа расширения не совершается A = 0. Если, кроме этого, никаких других работ не совершается, вся теплота, подведенная к системе, расходуется только на увеличение а внутренней энергии
QV = ∆ U
При постоянном давлении подведенная энергия в виде Qp идет на увеличение внутренней энергии и совершение работы расширения:
Qp = ∆ U + p (V2 – V1),
или
Qp = (U2 – U1) + (pV2 – pV1) = (U2 + pV2) - (U1 – pV1)
Из этого уравнения следует, что энергия, подводимая к системе в виде теплоты при постоянном давлении, расходуется на приращение некоторой функции состояния:
Н = U + pV
Эта функция называется энтальпией или теплосодержанием и обозначается буквой H. После подстановки в уравнении получим
Qp = H2 - H1 = ∆Н,
т.е. теплота, подведенная к системе при постоянном давлении, расходуется на приращении энтальпии системы. Абсолютное значение энтальпии системы определить экспериментально невозможно, но, можно измерив величину Qp, найти изменение энтальпии ∆ Н при переходе системы из одного состояния в другое. Величину ∆ Н считают положительной (∆ H > 0), если энтальпия системы возрастает. Поскольку значение ∆ Н определяется разностью H2 - H1 и не зависит от пути и способа проведения процесса, энтальпию, как и внутреннюю энергию, относят к термодинамическим функциям состояния системы.
В изотермическом процессе (T = const) ∆ U = 0, т.к. в этом случае запас внутренней энергии зависит только от тем-
пературы. Все тепло, получаемое системой, переходит в работу QT = A.
Тепловые эффекты химических реакций. Закон Гесса. Тепловым эффектом химической реакции называют алгебраическую сумму поглощенной при реакции теплоты и совершенной работы за вычетом работы против сил внешнего давления (p ∆ V). Если теплота измерена при постоянном объеме и температуре, то она равна убыли внутренней энергии:
Q V, T = - ∆ U V,T.
Если теплота реакции измерена при постоянном давлении и температуре, то она равна убыли энтальпии:
Q P, T = - ∆ H P,T.
Q P, T называют тепловым эффектом реакции при постоянных давлении и температуре.
Исследуя тепловые эффекты химических реакций Ломоносов, а позднее Лавуазье и Лаплас установили, что если при образовании какого - либо химического соединения наблюдается положительный тепловой эффект, то при разложении этого соединения на исходные вещества поглощается такое же количество теплоты.
Независимость теплоты химической реакции от пути процесса при постоянном давлении и температуры была установлена Г. И. Гессом (1840 г.), который сформулировал закон: тепловой эффект химической реакции не зависит от пути ее протекания, а зависит лишь от природы и физического состояния исходных веществ и продуктов реакции.
Закон Гесса справедлив для процессов, протекающих при p = const или V = const, т.е. в изобарно-изотермических или изохорно - изотермических условиях, когда тепловой эффект реакции равен ∆ H или ∆ U.
Этот закон можно интерпретировать на следующем примере. Допустим, что процесс превращения исходных веществ A1, A2, A3 приводит к образованию продуктов B1, B2, B3.
Превращение может быть осуществлено различными путями: Δ Hр – ции = Δ H1; Δ Hр – ции = Δ H2 + Δ H3; Δ Hр – ции = Δ H4 + Δ H5 + Δ H6
Закон Гесса утверждает, что
∆ Hр-ции = ∆ H1 = ∆ H2 + ∆ H3 = ∆ H4 +∆ H5 + ∆ H6,
т.е. тепловой эффект не зависит от пути, по которому проходит процесс, а определяется только начальным и конечным состоянием системы.
Раздел химической термодинамики, изучающей тепловые эффекты химических реакций, называется термохимией. Закон Гесса - основной закон термохимии. В термохимии используется упрощенное представление о тепловом эффекте химической реакции, отвечающее условиям его независимости от пути процесса; это теплота QT, подведенная к системе в процессе реакции (или выделившаяся в результате реакции) при постоянной температуре. Если теплота подводится к системе (QT > 0), реакцию называют эндотермической, если же теплота выделяется в окружающую среду (QT < 0), реакцию называют экзотермической.
Термохимия изучает, прежде всего, изобарно - изотермические реакции, в результате которых совершается только работа расширения p ∆ V. Тепловой эффект таких реакций Qp,T равен изменению энтальпии системы ∆ H.
В термохимии используют две формы записи термохимических уравнений реакций, когда тепловой эффект обозначается буквой Qp,T или ∆ H. В настоящее время более принято указывать величину теплового эффекта в виде изменения энтальпии ∆ H. При этом реакции, в которых энтальпия системы уменьшается (∆ H < 0) - экзотермические.
В эндотермических реакциях энтальпия увеличивается
(∆ H > 0).
Уравнения химических реакций, в которых указаны их тепловые эффекты, называются термохимическими уравнениями. Поскольку от агрегатных состояний веществ зависит состояние системы в целом, в термохимических уравнениях при помощи буквенных индексов (т.), (ж.) или (г) обозначаются агрегатные состояния веществ (твердое, жидкое, газообразное). Также указывается аллотропная модификация вещества, если существуют несколько таких модификаций.
Например, при атмосферном давлении и комнатной температуре водород и кислород газообразны - это очевидно и буквенными индексами обозначать не обязательно, а образующаяся вода в результате реакции может быть в двух агрегатных состояниях - жидком и газообразном. Поэтому в термохимических уравнениях реакций должно быть указано агрегатное состояние воды, т.к. тепловой эффект будет различным:
H2+1/2 O2 = H2O (ж)+285, 84 кДж или
H2+1/2 O2=H2O (г)+241, 84 кДж
Тепловой эффект реакции выражается в ккал или кДж.
5.3. Энтальпия образования химических соединений
Для расчетов тепловых эффектов используют величину, называемую энтальпией.
Энтальпией (теплотой) образования химического соединения ∆ HT называется изменение энтальпии в процессе получения 1 моля этого соединения из простых веществ (элементов) при постоянном давлении.
Так, например, энтальпией образования этилового спирта C2H5OH называется изменение энтальпии при реакции углерода, кислорода и водорода при постоянном давлении
2C + 3H2 + 1/2 O2→ CH3 - CH2 - OH
И наоборот, реакции
CH2 = CH2+H2O→CH3 - CH2 - OH
CH3 - CHO+H2→CH3 - CH2 – OH
не являются реакциями ”образования” спирта, хотя и приводят к синтезу этилового спирта.
Важным термодинамическим представлением является понятие о стандартном состоянии вещества, под которым понимается его реальное состояние при 298 К и атмосферном давлении (или p = 101 кПа).
Стандартной энтальпией (теплотой) образования химического соединения  называется изменение энтальпии в процессе образования 1 моля этого соединения, находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартных состояниях и термодинамически устойчивых при данной температуре фазах и модификациях.
называется изменение энтальпии в процессе образования 1 моля этого соединения, находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартных состояниях и термодинамически устойчивых при данной температуре фазах и модификациях.
Стандартные энтальпии образования простых веществ принимают равными нулю, если их агрегатные состояния и модификации устойчивы при стандартных условиях.
Стандартная энтальпия образования соединения – мера его термодинамической устойчивости, прочности, количественное выражение энергетических свойств соединения. Если стандартная энтальпия образования отрицательна, то соединение более устойчиво, чем элементы, из которых оно состоит, или наоборот, если она положительна, то соединение менее устойчиво. Из различных молекул более устойчивы те, энтальпии, образования которых меньше.
Например, этан (∆ H298 = - 24,82 ккал/моль) более устойчив, чем этилен 
Термохимические расчеты. Значения энтальпий образования позволяет определить изменения энтальпии, сопровождающие реакции, не прибегая к прямым измерениям.
В основе большинства термохимических расчетов лежит следствие из закона Гесса:
Тепловой эффект химической реакции равен сумме теплот (энтальпий) образования продуктов реакции за вычетом суммы теплот (энтальпий) образования исходных веществ.
Так, для уравнения вида
aA + bB +…= dD + eE +…
Тепловой эффект ∆ H определяется равенством
 =
=

При этом следует иметь в виду, что при алгебраическом суммировании следует учитывать стехиометрические коэффициенты в уравнении реакции (а, в, d, e).
Приведенное уравнение позволяет определять как тепловой эффект реакции по известным энтальпиям образования веществ, участвующих в реакции, так и одну из энтальпий образования, если известны тепловой эффект реакции и все остальные энтальпии образования.
В настоящее время энтальпии образования известны примерно для четырех тысяч веществ, и это позволяет расчётным путем установить тепловые эффекты самых разнообразных реакций.
Пример 1. Расчет теплового эффекта реакции по стандартным энтальпиям образования веществ.
Al2O3 (к) +3SO3 (г) = Al2(SO4)3 (к)
 =-1675 кДж/моль;
=-1675 кДж/моль;  =-395, 2 кДж/моль
=-395, 2 кДж/моль
 =-3434 кДж/моль
=-3434 кДж/моль
Тепловой эффект реакции  определяется по уравнению:
определяется по уравнению:

После подстановки значений стандартных энтальпий
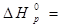 -3434-(-1675-3.395, 2)=-599 кДж/моль
-3434-(-1675-3.395, 2)=-599 кДж/моль
Видно, что  < 0, т.е. это реакция экзотермическая.
< 0, т.е. это реакция экзотермическая.
Пример 2. Расчет энтальпии образования химического соединения по известному тепловому эффекту реакции.
Определить 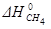 в реакции:
в реакции:
CH4 (г) + 2 H2O (г) = CO2 (г) + 4 H2 (г)
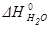 =-241,82 кДж/моль;
=-241,82 кДж/моль;  =-393,51 кДж/моль;
=-393,51 кДж/моль;  = +164,98 кДж
= +164,98 кДж
Стандартный тепловой эффект реакции равен:
 , откуда
, откуда

После подстановки стандартных энтальпий образования веществ:
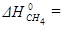 (-1 моль∙ 393,51 кДж/моль + 2 моль ∙ - 241,82 кДж/моль – 164,98 кДж) / 1 моль = - 74,85 кДж/моль
(-1 моль∙ 393,51 кДж/моль + 2 моль ∙ - 241,82 кДж/моль – 164,98 кДж) / 1 моль = - 74,85 кДж/моль
Видно, что реакция образования метана является экзотермической.
Пример 3. Расчет теплового эффекта реакции, который экспериментально определить невозможно.
Реакция 1) C + O2 = CO2,  = -396 кДж/моль
= -396 кДж/моль
может быть также осуществлена в две стадии
2) C + 1/2 O2 = CO,  = -110, 5 кДж/моль
= -110, 5 кДж/моль
3) CO + 1/2 O2 = CO2
Тепловой эффект реакции 2) можно провести экспериментально и определить  = -110, 5 кДж/моль.
= -110, 5 кДж/моль.
А вот тепловой эффект реакции 3) экспериментально осуществить и определить невозможно, поэтому  реакции 3) получают расчетным путем, используя закон Гесса
реакции 3) получают расчетным путем, используя закон Гесса
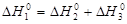

 - 396 - (-110, 5) = - 285,5 кДж/моль
- 396 - (-110, 5) = - 285,5 кДж/моль
С помощью термохимических расчетов можно определить энергию химических связей, энергии кристаллических решеток, теплоты растворения и гидратации, тепловые эффекты фазовых превращений и т.д.
Энтальпия есть возрастающая функция температуры, непрерывная во всей области изменения последней, когда существует данная фаза. Для расчета теплового эффекта при температурах, более высоких, чем стандартные, используют уравнение Кирхгофа:

где  - стандартный тепловой эффект реакции при T = 298 К;
- стандартный тепловой эффект реакции при T = 298 К;
 - стандартный тепловой эффект реакции при T.
- стандартный тепловой эффект реакции при T.
 разность молярных изобарных теплоемкостей всех продуктов реакции и молярных изобарных теплоемкостей всех исходных веществ, т.е.
разность молярных изобарных теплоемкостей всех продуктов реакции и молярных изобарных теплоемкостей всех исходных веществ, т.е.

Расчеты по уравнению Кирхгофа показывают, что в том интервале температур, который может иметь практическое значение, изменение величины теплового эффекта реакции невелико.
Так, например, тепловой эффект процесса 1/2 N2 + 1/2 O2 = NO (г) при повышении температуры от 298 до 4000 К изменяется всего лишь на 2,0 кДж/моль. Еще меньше влияние давления на тепловой эффект реакции. Так, для реакции синтеза аммиака из азота и водорода различие между величинами  при p = 101 кПа и p = 50 МПа не превышает 5 %.
при p = 101 кПа и p = 50 МПа не превышает 5 %.



 называется изменение энтальпии в процессе образования 1 моля этого соединения, находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартных состояниях и термодинамически устойчивых при данной температуре фазах и модификациях.
называется изменение энтальпии в процессе образования 1 моля этого соединения, находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартных состояниях и термодинамически устойчивых при данной температуре фазах и модификациях.
 =
=
 =-1675 кДж/моль;
=-1675 кДж/моль;  =-395, 2 кДж/моль
=-395, 2 кДж/моль =-3434 кДж/моль
=-3434 кДж/моль определяется по уравнению:
определяется по уравнению:
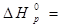 -3434-(-1675-3.395, 2)=-599 кДж/моль
-3434-(-1675-3.395, 2)=-599 кДж/моль < 0, т.е. это реакция экзотермическая.
< 0, т.е. это реакция экзотермическая.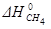 в реакции:
в реакции: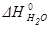 =-241,82 кДж/моль;
=-241,82 кДж/моль;  =-393,51 кДж/моль;
=-393,51 кДж/моль;  = +164,98 кДж
= +164,98 кДж , откуда
, откуда
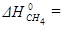 (-1 моль∙ 393,51 кДж/моль + 2 моль ∙ - 241,82 кДж/моль – 164,98 кДж) / 1 моль = - 74,85 кДж/моль
(-1 моль∙ 393,51 кДж/моль + 2 моль ∙ - 241,82 кДж/моль – 164,98 кДж) / 1 моль = - 74,85 кДж/моль = -110, 5 кДж/моль
= -110, 5 кДж/моль реакции 3) получают расчетным путем, используя закон Гесса
реакции 3) получают расчетным путем, используя закон Гесса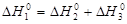

 - 396 - (-110, 5) = - 285,5 кДж/моль
- 396 - (-110, 5) = - 285,5 кДж/моль
 - стандартный тепловой эффект реакции при T = 298 К;
- стандартный тепловой эффект реакции при T = 298 К; - стандартный тепловой эффект реакции при T.
- стандартный тепловой эффект реакции при T. разность молярных изобарных теплоемкостей всех продуктов реакции и молярных изобарных теплоемкостей всех исходных веществ, т.е.
разность молярных изобарных теплоемкостей всех продуктов реакции и молярных изобарных теплоемкостей всех исходных веществ, т.е.
 при p = 101 кПа и p = 50 МПа не превышает 5 %.
при p = 101 кПа и p = 50 МПа не превышает 5 %.

