

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
Топ:
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Применительно к биологии и медицине наибольшее значение при изучении осмотического давления ВМВимеет вклад полисахаридов, нуклеиновых кислот и в особенности белков в осмотическое давление цитоплазмы и плазмы крови. Как упоминалось в курсе физической химии, этот вклад называется онкотическим давлением. Бóльшая часть его, примерно 4/5, обусловлена альбуминами. Хотя доля онкотического давления в общем осмотическом давлении, обусловленном всеми компонентами жидких сред организма, относительно невелика (около 0,5 %), всё же она заметна и должна учитываться при биохимическом и фармакологическом изучении. Так как осмотическое давление раствора определяется числом содержащихся в нём кинетических единиц – молекул, ионов, коллоидных частиц, то в растворах полимеров в силу их особенностей (малая молярная концентрация даже при значительной массовой) оно обычно невелико по сравнению с растворами низкомолекулярных веществ. Другой особенностью осмотического давления растворов ВМВ является неподчинение его закону Вант-Гоффа, а именно, его экспериментальное значение, как правило, бывает больше рассчитанного по уравнению Вант-Гоффа. Это связано с гибкостью длинных макромолекулярных цепей и их способностью непрерывно изменять свои конформации в растворе. При этом каждый сегмент макромолекулы, перемещающийся в пространстве независимо от других сегментов, удалённых от него на значительное расстояние, т. е. участвующий в самостоятельном микроброуновском движении, является как бы отдельной кинетической единицей, вносящей свой вклад в осмотическое давление. Поэтому для вычисления осмотического давления растворов ВМВ были предложены другие уравнения, содержащие поправки для согласования теоретических и экспериментальных величин.
|
|
Из этих уравнений наиболее употребительным является уравнение Галлера:
 ,
,
где p - осмотическое давление раствора полимера; С - массо-объёмная концентрация ВМВ или, иначе, масса полимера, содержащаяся в единице объёма раствора; М – молярная масса ВМВ; R – универсальная газовая постоянная; Т – температура; b - т. н. вириальный коэффициент, учитывающий в суммарном виде гибкость макромолекул и их взаимодействие с растворителем и с другими макромолекулами.
Уравнение Галлера может быть преобразовано в уравнение прямой, не проходящей через начало координат:
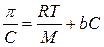 .
.
В такой форме оно является основой осмометрического метода определения молярной массы высокомолекулярных веществ. Наряду с вискозиметрическим этот метод является одним из немногих основных методов, достаточно чувствительных и дающих небольшую ошибку при экспериментальном определении молярной массы ВМВ. Откладывая на графике экспериментально найденную зависимость p / С от С (рис. 10.4), можно экстраполяцией на ось ординат определить величину RT / М, из которой легко рассчитать молярную массу полимера.
 |
Рис. 10. 4. Зависимость осмотического давления растворов
высокомолекулярных веществ от концентрации
Так можно определять, главным образом, молярные массы неполярных полимеров в органических растворителях. В случае же измерений осмотического давления водных растворов белков, полипептидов, полисахаридов и
т. п., следует помнить, что результаты могут быть искажены присутствием низкомолекулярных примесей, в особенности электролитов. Причём эти искажения могут быть связаны не только с наличием собственного осмотического давления примесных электролитов, но и с участием их в особого рода распределении по обе стороны полупроницаемой мембраны, - мембранном равновесии Ф. Дж. Доннана.
Мембранное равновесие
|
|
Если полупроницаемая мембрана разделяет два раствора, в одном из которых присутствуют молекулы или ионы, которые из-за своих размеров не могут диффундировать сквозь неё, это приводит к особому распределению ионов, способных к диффузии через мембрану. Такими мембранами могут быть мембраны осмометров, а также мембраны животных и растительных клеток, стенки кровеносных сосудов, кишечника и другие плёнки, имеющиеся в организме. Наиболее важным случаем является мембранное равновесие в присутствии растворимых белков. Как уже говорилось, белки в водном растворе присутствуют в виде цвиттер-ионов. Эти ионы неспособны проходить через клеточные мембраны, и с этой точки зрения могут быть названы недиализуемыми ионами. Ионы электролитов могут подвергаться диализу, т. е. свободно проходить через поры полупроницаемых мембран. Поэтому они называются диализуемыми ионами.
Рассмотрим мембранное равновесие на примере животной клетки, отделённой собственной оболочкой (мембраной) от межклеточной жидкости – раствора, содержащего низкомолекулярные электролиты. Допустим для простоты, что в межклеточной жидкости присутствует только один электролит, например, NaCl, а внутри клетки – только один белок. Так как в большинстве случаев белки являются в большей степени кислотами, чем основаниями, то недиализуемые макроионы, возникающие при их диссоциации, являются анионами (обозначим их Pr-, от protein – белок). Отщепляющиеся при диссоциации от макромолекул белка диализуемые ионы являются катионами. Природа этих катионов может быть различной, но для простоты примем, что это ионы Na+. Таким образом, внутри клетки до начала перераспределения имеются анионы белка и катионы натрия, а снаружи – ионы натрия и хлорид-ионы. Концентрации этих ионов до перераспределения будут равны:
внутри клетки С Pr- = С Na+ = С 1; снаружи клетки С Na+ = С Cl-= С 2.
В первую очередь через мембрану будут проникать анионы Cl-. Их первоочередное участие в перераспределении обусловлено большей разностью химических потенциалов по обе стороны мембраны. Для соблюдения электронейтральности вслед за анионами будут диффундировать катионы – ионы Na+. Ионы белка не могут проходить через мембрану и удержат эквивалентное число ионов Na+. Диффузия ионов будет продолжаться до установления равновесия.
|
|
Доннан показал, что главным условием такого равновесия является равенство произведений концентраций катионов и анионов, находящихся по обе стороны мембраны:
(С кат)вн(С ан)вн = (С кат)нар(С ан)нар, (10.1)
(индекс «вн» относится к ионам внутри клетки, индекс «нар» - к ионам снаружи неё).
Допустим, что снаружи в клетку проникло х моль хлорид-ионов и, соответственно эквивалентное количество х ионов Na+, что в сумме составляет х моль NaCl. Тогда равновесные концентрации из указанного выше условия равновесия (10.1) можно обозначить так:
(С кат)вн = (С Na+)вн = С Pr-+ x; (С ан)вн = (С Cl-)вн = x;
(С кат)нар = (С Na+)нар = С NaCl – x; (С ан)нар = (С Cl-)нар = С NaCl – x.
Помня, что в общем случае внутри клетки может быть не один белок, а несколько, а снаружи её – тоже несколько различных электролитов, введём обозначения:
С Pr- = С 1; С NaCl = С 2.
Тогда
(С кат)вн = (С Na+)вн = С 1+ x; (С ан)вн = (С Cl-)вн = x;
(С кат)нар = (С Na+)нар = С 2 – x; (С ан)нар = (С Cl-)нар = С 2 – x.
Подставляем эти значения концентраций в уравнение (10.1):
(С 1 + x) x = (С 2 - x) (С 2 - x)
откуда получим уравнение Доннана:
 .
.
Это уравнение показывает, что количество низкомолекулярного электролита, самопроизвольно прошедшего через клеточную мембрану внутрь клетки, находится в сложной зависимости от концентрации самого электролита снаружи клетки и от концентрации белка внутри клетки. (Следует помнить, что уравнение Доннана справедливо не только для одной изолированной клетки, но и для любого подобного случая распределения). В указанном виде уравнение применяется тогда, когда концентрации С 1 и С 2 соизмеримы друг с другом.
Уравнение Доннана является самосогласующимся, т. е. может изменяться в зависимости от соотношения концентраций С 1 и С 2. Так, при отсутствии в системе ионов белка или других недиализуемых ионов, т. е. когда
С 1 = 0, уравнение принимает вид
 ,
,
т. е. в пределе низкомолекулярный электролит может равномерно распределиться по обе стороны мембраны. Это же соотношение получается и тогда, когда С 1 << С 2, и величиной С 1 в знаменателе можно пренебречь.
Если же концентрация электролита намного меньше, чем концентрация белка, т. е., то значение х будет очень малó, намного меньше единицы. Это означает, что при очень малых концентрациях низкомолекулярные электролиты практически не будут проникать через мембраны в сторону раствора, содержащего недиализуемые ионы.
|
|
Равновесие Доннана имеет особое значение для биологии, медицины и фармации. В частности им объясняется существование гемато-энцефалического барьера, препятствующего проникновению в головной и спинной мозг, а также в цереброспинальную жидкость ряда посторонних веществ, попавших в кровь, например, с пищей. Оно является причиной различного осмотического давления в кровеносных капиллярах и в крупных сосудах, что обеспечивает более интенсивный обмен между капиллярами и прилегающими тканями. Извлечение продуктов обмена веществ из крови почечными канальцами тоже связано с распределением Доннана, как и многие другие процессы в живом организме. Наконец, его следует учитывать при фармакологических исследованиях, так как концентрация в тканях и в клетках способных к диссоциации лекарственных веществ в соответствии с описанными выше уравнениями может значительно отличаться от их концентрации в плазме крови.
Оптические свойства
Длинныемакромолекулы линейных и разветвлённых полимеров в растворе обычно не вытянуты в длину, а свёрнуты в более или менее плотные клубки, называемые глобулами. Из-за непрерывного броуновского и микроброуновского движения глобулы могут изменять свои размеры и общую конфигурацию, но обычно эти изменения незначительны. Размеры глобул полиэлектролитов и белков в водных растворах в значительной степени зависят от рН среды. Но при каждом данном рН они колеблются около какой-то средней величины. При прохождении через раствор ВМВ света глобулы, будучи по размерам меньше, чем длины световых волн видимого диапазона, как и мицеллы коллоидных растворов, обусловливают светорассеяние. Оно проявляется в голубоватом свечении растворов, например, раствора крахмала, исчезающем при затенении. Светорассеяние растворов ВМВ, в общем, подчиняется тем же законам, что и светорассеяние коллоидных растворов и может быть использовано для нефелометрическогоопределения концентрации или размеров глобул.
Вместе с тем, разбавленные растворы ВМВ, в которых светорассеяние проявляется в очень незначительной степени, подобно растворам низкомолекулярных веществ могут анализироваться обычными колориметрическими и спектрофотометрическими методами.
|
|
|

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!