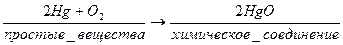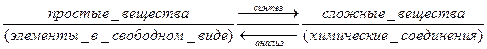Среди чистых веществ принято различать простые и сложные вещества. Простые вещества состоят из атомов одного вида элемента, то есть они одноэлементные. Сложные вещества состоят из атомов разных элементов, то есть они многоэлементные.
К простым веществам относят молекулярные азот N2, водород Н2, хлор Cl2, натрий Na состоят из элементов одного вида – соответственно азота N, водорода Н, хлора Cl, натрия Na. Сложные вещества, например, аммиак NH3 включает элементы азот N и водород H, хлорид натрия NaCl – элементы натрий Na и хлор Cl.
Простые вещества следует отличать от понятий «атом» и «химический элемент». Простые вещества представляют собой формы существования элементов в свободном виде; каждому элементу соответствует, как правило, несколько простых веществ (аллотропых форм), которые могут различаться по составу, например, атомный кислород О, кислород О2, озон О3, или по кристаллической решетке, например, алмаз и графит для элемента углерод С. Очевидно, что простые вещества могут быть одно- и многоатомными.
Сложные вещества иначе называются химическими соединениями. Этот термин означает, что вещества могут быть получены с помощью химических реакций соединения из простых веществ – химического синтеза или разделены на элементы в свободном виде (простые вещества) с помощью химических реакций разложения – химического анализа.
Примеры:
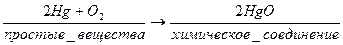

Простые вещества представляют собой конечные формы химического разложения сложных веществ. Сложные вещества, образующиеся из простых веществ, не сохраняют химические свойства составляющих веществ.
Пример:
Хлорид натрия NaCl обладает набором собственных свойств и не реагирует интенсивно с водой, как простое вещество натрий Na и не является ядовитым, как простое вещество Cl2.
Различия между смесями веществ и сложными веществами указаны в таблице 3.
Таблица 3.
Различия между смесями веществ и сложными веществами
| Смесь
| Сложное вещество
|
| Образуется с помощью физического процесса (смешивание чистых веществ)
| Образуется с помощью химической реакции (синтез из простых веществ)
|
| Свойства чистых веществ (простых и сложных), из которых составлена смесь, остаются неизменными.
| Свойства простых веществ, из которых получено сложное вещество, в последнем не сохраняются
|
| Чистые вещества (простые и сложные) могут находится в смеси в любом массовом отношении
| Элементы, входящие в состав сложного вещества, всегда находятся в определенном массовом соотношении
|
| Может быть разделена на составные части (чистые вещества) с помощью физических методов
| Может быть разложено на составные части (элементы в виде простых веществ) только с помощью химической реакции (анализ)
|
Суммируя вышесказанное, можно записать: 
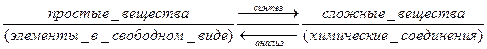
Таким образом, если простые вещества участвуют в химической реакции как реагенты, то они всегда будут переведены в сложные вещества. При этом масса образующегося химического соединения всегда больше, чем масса исходного элемента в свободном виде, так как в последней добавляется как минимум масса другого элемента.
Пример:


Если во второй реакции взять 63,55 г меди Cu, то масса продукта – сульфида меди (II) CuS окажется равной 95,55 г, поскольку к 63,55 г Cu добавляется 32,00 г второго реагента – серы S.
В настоящее время понятия «синтез» и «анализ» химических веществ используются в более широком смысле. К синтезу относят любой химический процесс, который приводит к получению необходимого вещества и при этом существует возможность его выделения из реакционной смеси. Анализом считается любой химический процесс, позволяющий определить качественный и количественный состав вещества или смеси веществ, то есть установить, из каких элементов оставлено данное вещество и каково содержание каждого элемента в этом веществе. Соответственно, различают качественный и количественный анализ – две составные части одной из химических наук – аналитической химии.
Контрольные вопросы:
1. Из приведенных ниже смесей веществ выберите гомогенные: а) растворы солей в воде; б) раствор диоксида углерода в воде; в) частицы глины в воде; г) частицы пыли в воздухе.
2. Группой веществ, содержащей только простые вещества является: а) CO2, O2, N2, NH4Cl; б) O2, C, NaCl, CO; в) Fe, N2, O2, O3; г) O3, O2, CO, CO2.
3. Приведите примеры аллотропных форм углерода, кислорода.
4. Укажите отличие сложного вещества от смеси веществ.
5. Из приведенных веществ выберите сложные: Cl2, Na, Br2, NaBr, Na[Al(OH)4], H2O/
6. Сложное вещество образуется: а) при смешении железных опилок с серой; б) при добавлении в расплав железа серы