

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
Топ:
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Весовой и молярный состав
В технике состав выражают обычно в весовых долях (или весовых процентах), т. е. в виде отношения массы компонента в данной фазе к массе всей фазы. Если масса фазы  , а масса содержащихся в ней компонентов А, В, С,... составляют соответственно
, а масса содержащихся в ней компонентов А, В, С,... составляют соответственно  ,
,  ,
,  ,..., то весовые доли компонентов будут:
,..., то весовые доли компонентов будут:
 ;
; 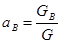 ;
;  ... (1-1)
... (1-1)
причем 
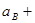
 ...
...  1.
1.
Во многих случаях состав выражают в молярных долях, т. е в виде отношения числа киломолей компонента в данной фазе к общему числу киломолей в этой фазе. Если всего в фазе  кмоль, а число киломолей компонентов А, В, С,... составляет
кмоль, а число киломолей компонентов А, В, С,... составляет 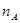 ,
,  ,
,  ..., то молярные доли компонентов будут:
..., то молярные доли компонентов будут:
 ;
;  ;
;  ... (1-2)
... (1-2)
причем 

 .
.
Пересчет весового состава в молярный, или обратный пере-счет, производится следующим образом. Пусть весовой состав смеси  ,
,  ,
,  ,..., а молекулярные массы компонентов
,..., а молекулярные массы компонентов  ,
, 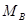 ,
, 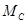 ,.... Тогда в 1 кг смеси содержатся следующие количества кмоль компонентов:
,.... Тогда в 1 кг смеси содержатся следующие количества кмоль компонентов:
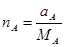 ;
; 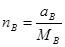 ;
;  ... (1-3)
... (1-3)
а общее число кмоль составляет:





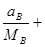
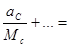

по формуле (16-2) находим молярный состав смеси:
 ;
;  ;
;  (1-4)
(1-4)
или в общем виде для  -го компонента
-го компонента

|
Если задан молярный состав смеси  ,
,  ,
,  ,..., то для пересчета его в весовой состав надо найти массы компонентов в 1 кмоль смеси:
,..., то для пересчета его в весовой состав надо найти массы компонентов в 1 кмоль смеси:
 ;
;  ;
; 
и общую ее массу:




По формуле (16-1) находим весовой состав смеси:
 ;
;  ;
; 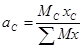 ...
...
или в общем виде для  -го компонента:
-го компонента:

|
Знаменатель этой формулы, представляющий собой массу 1 кмоль смеси, называется средней молекулярной массой смеси:



 (1-5)
(1-5)
Состав смеси двух компонентов (двойные смеси) полностью характеризуется содержанием в ней лишь одного из компонентов. Пусть весовая и молярная доли этого компонента  и
и  . Тогда весовая и молярная доли другого компонента (1— а) и (1—
. Тогда весовая и молярная доли другого компонента (1— а) и (1—  ). Формулы (1-3) и (1-4) примут в этом случае следующий вид:
). Формулы (1-3) и (1-4) примут в этом случае следующий вид:
|
|
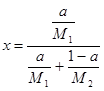 (1-6)
(1-6)
 (1-7)
(1-7)
где  и
и  — молекулярные массы компонентов.
— молекулярные массы компонентов.
Пример 1-1. Определить молярный состав и среднюю молекулярную массу смеси бензола и толуола, содержащей 30 вес. % бензола.
Р е ш е н и е. Молекулярные массы компонентов:  (бензол) и
(бензол) и  (толуол). По формуле (1-6) находим молярную долю бензола в смеси (при а = 0,3)
(толуол). По формуле (1-6) находим молярную долю бензола в смеси (при а = 0,3)

Молярная доля толуола (1— х) = 0,664. Эту же величину можно найти и по формуле (1-6), подставляя в нее весовую долю толуола а — 0,7, при этом М\ = 92 и М2 = 78.
Средняя молекулярная масса смеси по формуле (1-5):
Мср. = 78 • 0,336 + 92 • 0,664 = 87,2
Пример 1-2. Определить весовой состав смеси, содержащей 20 мол % этана, 35 мол % пропана, 15 мол. % бутана и 30 мол % изобутана.
Решение. Весовой состав определяем по формуле (1-4) и сводим результаты расчета в табл. 22.
Таблица 22
Результаты расчета весового состава смеси
| Компоненты | Молекулярная Масса (Mk) | Молярная Доля (Xk) | мкхк | Весовая доля
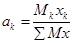
|
| Этан | 0,20 | 6,0 | 0,126 | |
| Пропан | 0,35 | 15,4 | 0,325 | |
| Бутан | 0,15 | 8,7 | 0,183 | |
| Изобутан | 0,30 | 17,4 | 0,366 |
Объемная концентрация
Состав выражают также через массу компонента, содержащегося в 1 м 3 смеси (объемная концентрация). Объемная концентрация С имеет размерность кг/м3.
Сумма объемных концентрации всех компанентов ΣС равна массе 1 м3 смеси, т. е. плотности ρ. Таки образом, весовая доля k-го компанента смеси:
ak=Ck/ρ (1-8)
Парциальное давление компанентов газовых смесей
Содержание компонентов газообразной смеси часто выражают через парциальное давление. Под парциальным давлением компанента понимают давление, под которым находился бы данный компанент, если в отсутствие других компанентов он занимал весь объем смеси при ее температуре.
Согласно закону Дальтона, полное давление Р газовой смеси равно сумме парциальных давлений компанентов pА, рВ, рс, …:
Р= pА + рВ, + рс +…
Как не трудно убедиться, отношение парциального давления компонента к полном давлению равно объемной доле компонента в смеси. В самом деле, если парциальное давление k-го компонента pk, а объем газовой смеси V, то объем Vk, занимаемый этим компонентом при давлении P, определиться из соотношения pkV=PVk, откуда Vk=рkV/Р, а объемная доля компонента в смеси
|
|
ϑk=Vk/V=pk/P
Так как 1 кмоль любых компонента занимает при одинаковой температуре один и тот же объем, то объемная доля ϑk равна молярной доле уk компонента в газовой смеси.
Таким образом
уk= pk/P или pk=Р уk (1-9)
Напишем уравнение состояния для 1 кг каждого компонента газовой смеси:
pkV=RT/Mk
где pk – парциальное давление k-го компонента, н/м2;
R - газовая постоянная (8314 Дж/кмоль · град);
Mk - молекулярная масса компонента.
Отсюда определяем объем V смеси, в котором находится 1 кг k-го компонента:
V=RT/ Mkpk
Объемная концентрация компонента Сk=1/V, или
Сk= Mk pk/RT (1-10)
Уравнение (1-9) устанавливает связь между парциальным давлением и молярной долей, уравнение (1-10) – между парциальным давлением и объемной концентрацией.
Пример 1-3. Смесь двуокиси углерода с воздухом содержит 15 объемн. % СО2. Определить содержание СО2 в смеси в вес. %, парциальное давление СО2 в смеси и объемную концентрацию СО2 при 25°С и общем (абсолютном) далении Р=19,6 бар (20 ат).
Решение. Для газовых смесей объемная доля компонента равна его молярной; следовательно, молярная доля двуокиси углерода у=0,15. Молекулярные массы составляют: М1=44 (для СО2), М2=29 (для воздуха).
Весовую долю СО2 находим по формуле (1-7).
a=44 · 0,15/ 44 · 0,15 + 29 (1-0,15)=0,212, или 21,2 вес. %
Парциальное давление СО2 определяем по уравнению (1-9)
Р = 19,6 · 0,15 = 2,94 бар (3 ат)
Объемная концентрация СО2 по уравнению (1-10) составит,
С=44 · 2,94 · 105/8314(273+25)=5,23 кг/м3
Относительный весовой состав
Состав двойной смеси можно выразить в виде отношения массы распределяемого компонента к массе носителя. Это отношение называется относительным весовым составом. Связь между относительным весовым составом Х и весовой долей а выражается следующим соотношением:
Х=а/1-а, или а=Х/1+Х (1-11)
При расчете состава газовой смеси, выраженный через парциальное давление компонента р, часто приходиться пересчитывать в относительно весовой состав. Это может быть сделано следующим образом. Если общее давление смеси Р, то парциальное давление носителя (Р - р); тогда уравнение состояние для компонента будет иметь вид
pV=Gk(R/M)T
и для носителя
(P - p)V=GH(R/MH)T
где V – объем смеси, м3;
GK и GH – количества компонента и носителя в объеме V, кг;
|
|
МK и МH – молекулярные массы компонента и носителя.
Деля первое уравнение на второе, получим:
p/P – p=GK/GH · MH/MK
Отсюда находим относительный весовой состав:
Y= GK/GH= MK/MH · p/P – p (1-12)
Пример 1-4. Найти относительный весовой состав смеси, рассмотренной в примере 1-3.
Решение. По формуле (1-11) находим
Y=0,212/ (1-0,212)=0,27 кг CO2 на 1 кг воздуха
Если весовая доля не рассчитывалась, можно использовать формулу (1-12):
Y=44/29 · 2,94/(19,6-2,94)=0,27 кг СО2 на 1 кг воздуха
Равновесие между фазами
Подобно тому как передача тепла протекает лишь при отклонении от состояния равновесия, т. е. при наличии разности температур между теплоносителями, так и переход вещества из одной фазы в другую происходит при отсутствии равновесия между фазами.
Пусть имеются две фазы  и
и  , причем распределяемое вещество вначале находится только в первой фазе
, причем распределяемое вещество вначале находится только в первой фазе  и имеет концентрацию
и имеет концентрацию  . Если привести фазы в соприкосновение, то распределяемое вещество начнет переходить в фазу
. Если привести фазы в соприкосновение, то распределяемое вещество начнет переходить в фазу  . С момента появления распределяемого вещества в фазе
. С момента появления распределяемого вещества в фазе  начнется и обратный переход его в фазу
начнется и обратный переход его в фазу  .
.
Скорость обратного перехода будет увеличиваться по мере повышения концентрации распределяемого вещества в фазе  . В некоторый момент скорости перехода вещества из фазы
. В некоторый момент скорости перехода вещества из фазы  в фазу
в фазу  и обратно станут одинаковыми. При этом установится состояние равновесия между фазами, при котором явного перехода вещества из одной фазы в другую происходить не будет.
и обратно станут одинаковыми. При этом установится состояние равновесия между фазами, при котором явного перехода вещества из одной фазы в другую происходить не будет.
 В состоянии равновесия существует определенная зависимость между концентрациями распределяемого вещества в обеих фазах — любой концентрации
В состоянии равновесия существует определенная зависимость между концентрациями распределяемого вещества в обеих фазах — любой концентрации  этого вещества в фазе
этого вещества в фазе  соответствует равновесная концентрация его
соответствует равновесная концентрация его 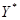 в фазе
в фазе  :
:
 (1-13)
(1-13)
 Условие равновесия, выраженное уравнением (1-13), позволяет определить направление процесса. Если рабочая концентрация
Условие равновесия, выраженное уравнением (1-13), позволяет определить направление процесса. Если рабочая концентрация  распределяемого вещества в фазе
распределяемого вещества в фазе  больше равновесной (
больше равновесной ( >
> 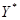 ), вещество будет переходить из фазы
), вещество будет переходить из фазы  в фазу
в фазу  . Если же
. Если же  <
< 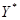 вещество переходит из фазы
вещество переходит из фазы  в фазу
в фазу  .
.
Равновесие между фазами можно представить графически на  —
—  -диаграмме (рис. 1-1). На этой диаграмме по оси абсцисс откладывается концентрация
-диаграмме (рис. 1-1). На этой диаграмме по оси абсцисс откладывается концентрация  распределяемого вещества в фазе
распределяемого вещества в фазе  , а по оси ординат — его концентрация
, а по оси ординат — его концентрация  в фазе
в фазе  . Кривая ОС, изображающая зависимость равновесной концентрации
. Кривая ОС, изображающая зависимость равновесной концентрации 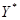 от
от  , называется линией равновесия.
, называется линией равновесия.
|
|
Конкретные уравнения условий равновесия будут рассмотрены при описании отдельных процессов.
|
|
|

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!