Лекция 1. Введение в курс физиологии. Возбудимые ткани.
Биопотенциалы.
Литература:
1. Физиология человека: в 3-х томах. Под редакцией Р.Шмидта и Г.Тевса. М: Мир, 1996.
2. Физиология человека: в 2-х томах. Под редакцией Покровского и Коротько. М: Медицина, 1997.
3. Нормальна фізіологія. За ред. Філімонова. К: Здоров’я, 1996.
4. В.Ганонг. Фізіологія людини. Львів, 2002.
5. ihtic.lib.ru (медицина)
6. pubmed.com
I. Предмет и задачи физиологии
Физиология (от греч. физис – природа и логос – учение) – наука о природе, о существе жизненных процессов. Физиология человека изучает жизнедеятельность организма и отдельных его частей: клеток, тканей, органов, систем.
Предметом изучения физиологии являются функции живого организма, их связь между собой, регуляция и приспособление к внешней среде, происхождение и становление в процессе эволюции и индивидуального развития особи.
Физиологическая функция – проявления жизнедеятельности организма и его частей, имеющие приспособительное значение и направленные на достижение полезного результата. В основе функции лежит обмен веществ, энергии и информации.
Нормальной физиология – учебная дисциплина в системе высшего медицинского образования. Ее задачи:
1. Обучение будущих врачей пониманию механизма функционирования каждого органа. Познание будущими врачами функции органов является непременным условием, основой понимания патогенеза нарушений и путей их коррекции. Вылечить – это, в конечном счете, восстановить нарушенную функцию.
2. Методическая подготовка будущего врача – т.е. знание принципов получения достоверной информации о деятельности органов и систем и грамотной ее интерпретации.
3. Оценка здоровья и путей его адаптации как к меняющейся экологической ситуации, так и к характеру деятельности.
II. Методы физиологических исследований
Выделяют следующие основные методы физиологии:
1. Наблюдение. Метод наиболее ранний, его использовали еще во времена античности (Гиппократ – теория темперамента), но недостаточно точный. Однако этот метод, начиная с работ XIX века, дополнен различными видами регистрации.
2. Эксперимент острый (Клавдий Гален, Уильям Гарвей) и хронический (И.П.Павлов).
3. Моделирование.
Эти методы лежат в основе конкретных методик:
1. Экстирпация.
2. Трансплантация.
3. Денервация.
4. Регистрация биопотенциалов.
5. Электростимуляция.
6. Визуализация (ЯМР-томография и ПЭТ).
III. Основные этапы развития физиологии
Официальной датой возникновения физиологии человека и животных как науки принят 1628 г. – год выхода в свет трактата В. Гарвея «Анатомическое исследование о движении сердца и крови у животных». Это произведение послужило стимулом к изучению деятельности организма в экспериментах на животных как основного объективного источника знаний.
Д.С.Воронцов,– основатель отечественной электрофизиологии. П.Г.Костюк – директор ИФ. Крымская школа физиологии берет начало от этих ученых и их учеников (Б.М.Волынский).
IV. Возбудимость
Основным свойством живых клеток является раздражимость, т. е. их способность реагировать изменением обмена веществ в ответ на действие раздражителей. Возбудимость – свойство клеток отвечать на раздражение возбуждением. К возбудимым относят нервные, мышечные и некоторые секреторные клетки. Возбуждение – ответ ткани на ее раздражение, проявляющийся в специфической для нее функции (проведение возбуждения нервной тканью, сокращение мышцы, секреция железы) и неспецифических реакциях (метаболические изменения).
Одним из важных свойств живых клеток является их электрическая возбудимость, т.е. способность возбуждаться в ответ на действие электрического тока. Высокая чувствительность возбудимых тканей к действию слабого электрического тока впервые была продемонстрирована Гальвани в опытах на нервно-мышечном препарате задних лапок лягушки.
В конце XIX века стало очевидно, что электрические явления, которые возникают в возбудимых тканях, обусловлены электрическими свойствами клеточных мембран. Согласно современным представлениям, биологические мембраны образуют наружную оболочку всех животных клеток и формируют многочисленные внутриклеточные органеллы. Наиболее характерным структурным признаком является то, что мембраны всегда образуют замкнутые пространства, и такая микроструктурная организация мембран позволяет им выполнять важнейшие функции:
1. Барьерная функция выражается в том, что мембрана при помощи соответствующих механизмов участвует в создании концентрационных градиентов, препятствуя свободной диффузии.
2. Регуляторная функция клеточной мембраны заключается в регуляции внутриклеточных реакций за счет рецепции внеклеточных биологически активных веществ, что приводит к изменению активности ферментных систем мембраны и запуску механизмов вторичных «месенджеров» («посредников»).
3. Преобразование внешних стимулов неэлектрической природы в электрические сигналы (в рецепторах).
4. Высвобождение нейромедиаторов в синаптических окончаниях.
Современными методами электронной микроскопии была определена толщина клеточных мембран (6–12 нм). Химический анализ показал, что мембраны в основном состоят из липидов и белков, количество которых неодинаково у разных типов клеток. В настоящее время можно говорить о нескольких видах моделей клеточной мембраны, среди которых наибольшее распространение получила жидкостно-мозаичная модель.
Согласно этой модели, мембрана представлена бислоем фосфолипидных молекул, ориентированных таким образом, что гидрофобные концы молекул находятся внутри бислоя, а гидрофильные направлены в водную фазу. Такая структура идеально подходит для образования раздела двух фаз: вне- и внутриклеточной.В фосфолипидном бислое интегрированы глобулярные белки, полярные участки которых образуют гидрофильную поверхность в водной фазе. Эти интегрированные белки выполняют различные функции, в том числе рецепторную, ферментативную, образуют ионные каналы, являются мембранными насосами и переносчиками ионов и молекул.
Строение и функции ионных каналов. Ионы Na+, К+, Са2+, Сl- проникают внутрь клетки и выходят наружу через специальные, заполненные жидкостью каналы. Размер каналов довольно мал (диаметр 0,5–0,7 нм). Одни из них весьма специфичны, вторые, кроме основного иона, могут пропускать и другие ионы. Расчеты показывают, что суммарная площадь каналов занимает незначительную часть поверхности клеточной мембраны.
Функцию ионных каналов изучают различными способами. Наиболее распространенным является метод фиксации напряжения. Совместное использование метода фиксации потенциала и специфических блокаторов ионных каналов привело к открытию различных типов ионных каналов в клеточной мембране. Изучение функции отдельных каналов возможно методом локальной фиксации потенциала «раth-сlаmр». Стеклянный микроэлектрод (микропипетка) заполняют солевым раствором, прижимают к поверхности мембраны и создают небольшое разрежение. При этом часть мембраны подсасывается к микроэлектроду. Если в зоне присасывания оказывается ионный канал, то регистрируют активность одиночного канала. Система раздражения и регистрации активности канала мало отличается от системы фиксации напряжения.
Именно ионные каналы обеспечивают два важных свойства мембраны: селективность и проводимость. Селективность, или избирательность, канала обеспечивается его особой белковой структурой. Большинство каналов являются электроуправляемыми, т. е. их способность проводить ионы зависит от величины мембранного потенциала. Канал неоднороден по своим функциональным характеристикам, особенно это касается белковых структур, находящихся у входа в канал и у его выхода (так называемые воротные механизмы).
Рассмотрим принцип работы ионных каналов на примере натриевого канала. Полагают, что в состоянии покоя натриевый канал закрыт. При деполяризации клеточной мембраны до определенного уровня происходит открытие m-активационных ворот (активация) и усиление поступления ионов Na+ внутрь клетки. Через несколько миллисекунд после открытия т-ворот происходит закрытие h-ворот, расположенных у выхода натриевых каналов (инактивация). Инактивация развивается в клеточной мембране очень быстро и степень инактивации зависит от величины и времени действия деполяризующего стимула. Работа натриевых каналов определяется величиной мембранного потенциала в соответствии с определенными законами вероятности.
Кроме натриевых, в клеточных мембранах установлены другие виды каналов, избирательно проницаемых для отдельных ионов: К+, Са2+, причем существуют разновидности каналов для этих ионов. Для калиевых каналов процесс инактивации, как для нариевых каналов, не существует. Имеются особые калиевые каналы, активирующиеся при повышении внутриклеточной концентрации кальция и деполяризации клеточной мембраны. Активация калий-кальцийзависимых каналов ускоряет реполяризацию, тем самым восстанавливая исходное значение потенциала покоя.
Особый интерес представляют кальциевые каналы. Входящий кальциевый ток, как правило, недостаточно велик, чтобы нормально деполяризовать клеточную мембрану. Чаще всего поступающий в клетку кальций выступает в роли «мессенджера», или вторичного посредника. Активация кальциевых каналов обеспечивается деполяризацией клеточной мембраны, например входящим натриевым током.
V. Мембранный потенциал покоя.
Электрические явления, которые возникают в возбудимых тканях, обусловлены электрическими свойствами клеточных мембран. Их изучают с помощью микроэлектродов. Детальный анализ процессов, протекающих в мембранах возбудимых клеток, был проведен Ходжкиным, Хаксли и Катцем в опытах на гигантском аксоне кальмара и привел к созданию современной теории происхождения потенциала покоя и потенциала действия.
Исследуемый биообъект (клетка, кусочек ткани) помещен в камеру, содержащую солевой раствор и электрод сравнения. Если измерительный электрод также находится в растворе, то разность потенциалов между ним и электродом сравнения стремится к нулю. В момент проникновения микроэлектрода внутрь клетки регистрируют отрицательный потенциал относительно внешней среды. Эта постоянная разность потенциалов называется мембранным потенциалом покоя (МПП). При этом потенциал внеклеточной среды принимается равным нулю. Величина потенциала покоя неодинакова у различных типов клеток и колеблется обычно от –70 до –95 мВ.
Согласно концепции Ходжкина и Хаксли, величина потенциала покоя зависит от ряда факторов, в частности от селективной (избирательной) проницаемости клеточной мембраны для различных ионов; различной концентрации ионов цитоплазмы клетки и ионов окружающей среды (ионной асимметрии); работы механизмов активного транспорта ионов.
Известно, что в невозбужденном состоянии клеточная мембрана высокопроницаема для ионов калия и малопроницаема для ионов натрия, непроницаема для отрицательно заряженных ионов белка (т.е. полупроницаема). Установлено, что имеется разность концентраций ионов калия вне и внутри клетки, причем внутри клетки ионов калия примерно в 20–50 раз больше, чем вне клетки. Разность концентраций ионов калия вне и внутри клетки и высокая проницаемость клеточной мембраны для ионов калия обеспечивают диффузионный ток этих ионов из клетки наружу. Диффузионный ток ионов калия существует до тех пор, пока стремление их двигаться по концентрационному градиенту не уравновесится разностью потенциалов на мембране. Эта разность потенциалов называется калиевым равновесным потенциалом.
Трансмембранная диффузионная разность потенциалов рассчитывается по формуле Нернста:
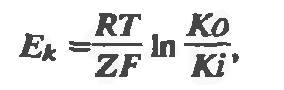
где Ек – равновесный потенциал, R – газовая постоянная, Т – абсолютная температура, Z – валентность нона, F – постоянная Фарадея, Ко и Кi – концентрации ионов К+ вне и внутри клетки соответственно.
Для аксона кальмара расчетная величина МПП исходя из реальных значений концентрации ионов К+ вне- и внутри клетки (примерно1:40) при температуре +20 °С должна составит примерно –75 мВ (поскольку концентрация ионов К- вне клетки меньше, чем внутри, Ек будет отрицательным). Но на практике эта величина только –60 мВ, т.к. некоторую роль в поддержании мембранного потенциала играют и другие ионы.
Поскольку мембраны живых клеток в той или иной степени проницаемы для всех ионов, совершенно очевидно, что без специальных механизмов невозможно поддерживать постоянную разность концентрации ионов (ионную асимметрию). В клеточных мембранах существуют специальные системы активного транспорта, работающие с затратой энергии и перемещающие ионы против градиента концентраций. Экспериментальным доказательством существования механизмов активного транспорта служат результаты опытов, в которых активность АТФазы подавляли различными способами, например сердечным гликозидами (оуабаин, дигиталис, препараты горицвета и т.д.). При этом происходило выравнивание концентраций ионов К- вне и внутри клетки и мембранный потенциал уменьшался до нуля. Важнейшим механизмом, поддерживающим низкую внутриклеточную концентрацию ионов Nа+ и высокую концентрацию ионов К+, является натрий-калиевый насос. Известно, что в клеточной мембране имеется система переносчиков, каждый из которых связывается с 3 находящимися внутри клетки ионами Nа+ и выводит их наружу. С наружной стороны переносчик связывается с 2 находящимися вне клетки ионами К+, которые переносятся в цитоплазму. Энергообеспечение работы систем переносчиков обеспечивается АТФ. Таким образом мембранный потенциал обеспечивается двумя явлениями: ассиметричным распределением ионов за счет полупроницаемости мембраны и активным транспортом ионов.
Основное значение МПП – накопление потенциальной энергии в клетке.
VI. Потенциал действия.
Энергия МПП может освобождаться в виде специфических электрических сигналов – потенциалов действия (ПД), характерных для возбудимых тканей: нервной, мышечной, некоторых рецепторных и секреторных клеток. Под потенциалом действия понимают быстрое колебание потенциала покоя, сопровождающееся, как правило, перезарядкой мембраны.
Для правильного понимания процессов, происходящих при генерации потенциала действия, используем следующую схему опыта. Если через стимулирующий внутриклеточный электрод подавать короткие толчки гиперполяризующего тока, то можно зарегистрировать увеличение мембранного потенциала, пропорциональное амплитуде подаваемого тока. Ситуация будет изменяться, если через стимулирующий электрод подавать короткие толчки деполяризующего тока. При небольшой (подпороговой) величине деполяризующего тока мембрана ответит пассивной деполяризацией. Подпороговое пассивное поведение клеточной мембраны называется электротоническим, или электротоном. Увеличение деполяризующего тока приведет к появлению активной реакции клеточной мембраны в форме повышения натриевой проводимости. При этом проводимость клеточной мембраны не будет подчиняться закону Ома, а будет больше ожидаемой. Активные подпороговые изменения мембранного потенциала называются локальным ответом. Смещение мембранного потенциала до критического уровня деполяризации приводит к генерации потенциала действия. При этом во время генерации потенциала действия мембранный потенциал уменьшается не просто до нуля, но изменяет свой знак на противоположный.
Анализ ионной природы потенциала действия, проведенный Ходжкиным, Хаксли и Катцем, позволил установить, что фронт нарастания потенциала действия и перезарядка мембраны (овершут) обусловлены движением ионов натрия внутрь клетки. Натриевые каналы оказались электроуправляемыми. Деполяризующий толчок тока приводит к активации натриевых каналов и увеличению натриевого тока. Это обеспечивает локальный ответ. Смещение мембранного потенциала до критического уровня приводит к стремительной деполяризации клеточной мембраны и обеспечивает фронт нарастания потенциала действия. На высоте овершута потенциал действия приближается к равновесному натриевому потенциалу, поэтому происходит изменение знака заряда на мембране.
Экспериментально было показано, что амплитуда потенциала действия практически не зависит от силы стимула, если он превышает пороговую величину. Поэтому принято говорить, что потенциал действия подчиняется закону "все или ничего".
Если удалить ионы Na+ из внешней среды, то потенциал действия не возникает. Аналогичный эффект удавалось получить при добавлении в перфузи-онный раствор ТТХ (тетродотоксин) – специфического блокатора натриевых каналов, который используется как наиболее мощное анестезирующее средство.
На пике потенциала действия проводимость мембраны для ионов натрия начинает быстро снижаться. Этот процесс называется инактивацией. После достижения пика потенциала действия происходит реполяризациа, т. е. мембранный потенциал возвращается к контрольному значению в покое. Развитие потенциала действия и перезарядка мембраны приводят к тому, что внутриклеточный потенциал становится еще более положительным, чем равновесный калиевый потенциал, и, следовательно, электрические силы, перемещающие ионы калия через мембрану, увеличиваются. Максимума эти силы достигают во время пика потенциала действия. Был обнаружен задержанный выходящий ток, который переносился ионами К. Этот ток достигает максимума спустя 5–8 мс от начала генерации потенциала действия. Введение тетраэтиламмония (ТЭА) – блокатора калиевых каналов – замедляет процесс реполяризации. В обычных условиях задержанный выходящий калиевый ток существует некоторое время после генерации потенциала действия и это обеспечивает гиперполяризацию клеточной мембраны, т. е. положительный следовой потенциал.
Инактивация натриевой системы в процессе генерации потенциала действия приводит к тому, что клетка в этот период не может быть повторно возбуждена, т. е. наблюдается состояние абсолютной рефрактерности. Постепенное восстановление потенциала покоя в процессе реполяризации дает возможность вызвать повторный потенциал действия, но для этого требуется сверхпороговый стимул, так как клетка находится в состоянии относительной рефрактерности.
Исследование возбудимости клетки во время локального ответа или во время отрицательного следового потенциала показало, что генерация потенциала действия возможна при действии стимула ниже порогового значения. Это состояние супернормальности, или экзальтации.
Продолжительность периода абсолютной рефрактерности ограничивает максимальную частоту генерации потенциалов действия данным типом клеток. Например, при продолжительности периода абсолютной рефрактерности 4 мс максимальная частота равна 250 Гц. Н. Е. Введенский ввел понятие лабильности, или функциональной подвижности, возбудимых тканей. Мерой лабильности является количество потенциалов действия, которое способна генерировать возбудимая ткань в единицу времени. Очевидно, что лабильность возбудимой ткани в первую очередь определяется продолжительностью периода рефрактерности. Наиболее лабильными являются волокна слухового нерва, в которых частота генерации потенциалов действия достигает 1000 Гц.
Таким образом, генерация потенциала действия в возбудимых мембранах возникает под влиянием различных факторов и сопровождается повышением проводимости клеточной мембраны для ионов натрия, входом их внутрь клетки, что приводит к деполяризации клеточной мембраны и появлению локального ответа. Этот процесс может достигнуть критического уровня деполяризации, после чего проводимость мембраны для натрия увеличивается до максимума, мембранный потенциал при этом приближается к натриевому равновесному потенциалу. Через несколько миллисекунд происходит инактивация натриевых каналов, активация калиевых каналов, увеличение выходящего калиевого тока, что приводит к реполяризации и восстановлению исходного потенциала покоя.
СИСТЕМА ВЫДЕЛЕНИЯ
II. Клубочковая фильтрация. Образование первичной мочи
Образование мочи является результатом трех последовательных процессов.
1. Клубочковая фильтрация жидкости из плазмы крови в капсулу почечного клубочка, в результате чего образуется первичная моча.
2. Канальцевая реабсорбция – процесс обратного всасывания профильтровавшихся веществ и воды.
3. Секреция. Клетки некоторых отделов канальца переносят в просвет канальца ряд веществ из внеклеточной жидкости либо выделяют вещества, синтезированные в клетке канальца.
Клубочковая фильтрация. Через клубочковый фильтр происходит ультрафильтрация воды и низкомолекулярных компонентов из плазмы крови. Этот фильтр почти непроницаем для высокомолекулярных веществ. Процесс ультрафильтрации обусловлен разностью между гидростатическим давлением крови, гидростатическим давлением в капсуле клубочка и онкотическим давлением белков плазмы крови. Общая поверхность капилляров клубочка больше общей поверхности тела человека. Фильтрующая мембрана состоит из трех слоев: эндотелиальных клеток капилляров, базальной мембраны и эпителиальных клеток висцерального (внутреннего) листка капсулы – подоцитов.
Наиболее важны мембраны подоцитов. Они ограничивают фильтрацию веществ, диаметр молекул которых больше 6 нм. Поэтому в просвет нефрона свободно проникает инулин (полимер фруктозы), но только 3 % гемоглобина и меньше 1 % сывороточного альбумина. Ультрафильтрат (первичная моча) подобен плазме по общей концентрации осмотически активных веществ, глюкозы, мочевины и др. В нем – лишь следы белка.
Инулин использую для измерения скорости фильтрации. В норме у мужчин в обеих почках она составляет около 125 мл/мин, у женщин – приблизительно 110 мл /мин. Измеренная с помощью инулина величина фильтрации, называемая также коэффициентом очищения от инулина (или инулиновым клиренсом), показывает, какой объем плазмы крови освобожден от инулина за это время. Для измерения очищения от инулина, необходимо непрерывно вливать в вену его раствор. Очевидно, что это весьма сложно и в клинике не всегда осуществимо, поэтому чаще используют креатинин – естественный компонент плазмы, хотя с его помощью скорость клубочковой фильтрации измеряется менее точно.
У здорового человека вода попадает в просвет нефрона в результате фильтрации в клубочках, реабсорбируется в канальцах, и вследствие этого концентрация инулина растет. Концентрационный показатель инулина (концентрация инулина в моче/концентрация инулина в плазме) указывает, во сколько раз уменьшается объем фильтрата при его прохождении по канальцам. На основе ее можно определить, подвергается ли вещество Х реабсорбции или секретируется клетками канальцев. Если концентрационный показатель данного вещества X меньше, чем показатель для инулина, то это указывает на реабсорбцию вещества X в канальцах, если больше – то это указывает на его секрецию.
IV. Канальцевая секреция. Образование вторичной мочи.
Многие продукты обмена и чужеродные вещества секретируются из крови в просвет канальца против концентрационного и электрохимического градиентов. Рассмотрим процесс секреции органических кислот на примере выделения почкой парааминогиппуровой к-ты (ПАГ). Принцип секреторного процесса при транспорте органических соединений состоит в том, что в мембране клетки проксимального канальца, обращенной к интерстициальной жидкости, имеется переносчик, обладающий высоким сродством к ПАГ. Переносчик обеспечивает поступление ПАГ внутрь клетки. Поступившая в клетку ПАГ движется по цитоплазме к апикальной мембране и выделяется в просвет канальца.
Транспорт в нефроне К+ характеризуется тем, что К+ не только подвергается обратному всасыванию, но и секретируется клетками эпителия конечных отделов нефрона и собирательных трубок. При секреции К+ поступает в клетку в обмен на Na+ с помощью натрий-калиевого насоса. При избытке К+ в организме система регуляции стимулирует его секрецию клетками канальцев. При дефиците К+ в организме клетки конечных отделов нефрона и собирательных трубок прекращают секрецию К+ и только реабсорбируют его из канальцевой жидкости.
В почках также образуются некоторые вещества, выделяемые в мочу (например, гиппуровая кислота, аммиак) или поступающие в кровь (ренин, простагландины, синтезируемая в почке глюкоза и др.).
Почки теплокровных животных обладают способностью к образованию мочи с большей осмотической концентрацией, чем осмотическая концентрация крови за счет деятельности поворотно-противоточной множительной системы.
Механизм работы такой системы рассмотрим на примере кровеносных сосудов в конечностях арктических животных. Во избежание потерь тепла кровь в параллельно расположенных артериях и венах конечностей течет таким образом, что теплая артериальная кровь согревает охлажденную венозную кровь, движущуюся к сердцу. Здесь такая система функционирует только как противоточный обменник; в почке же она обладает множительным эффектом, т. е. увеличением эффекта, достигаемого в каждом из отдельных сегментов системы.
Шпилькообразная форма петли Генле с движением жидкости в противоположных направлениях по лежащим рядом нисходящему и восходящему коленам создает основу концентрирования здесь мочи по принципу противоточного умножения (рис. 2). NаС1 перекачивается из восходящего колена петли Генле в нисходящее, поэтому концентрация канальцевой жидкости в последнем все более повышается. Мембрана между двумя коленами водонепроницаема, поэтому происходит разведение раствора в восходящем колене и его концентрирование в нисходящем. Поступающий в нисходящее колено изотонический раствор по мере продвижения к вершине петли Генле становится все более гипертоничным.

Рис. 2. Схема нефрона, иллюстрирующая противоточный механизм в петле Генле. Сплошными стрелками показан транспорт NаС1 из восходящего колена в нисходящее, а штриховыми – выход воды из собирательной трубочки
На каждом уровне между двумя коленами существует лишь небольшая горизонтальная разность концентраций, и в восходящем колене натриевый насос может работать поэтапно с относительно небольшой затратой энергии. Однако за счет противотока эти отдельные эффект, умножаются, создавая очень большую вертикальную разность концентраций между основанием и вершиной петли Генле. Такой градиент важен для окончательного концентрирования мочи, и вот почему. Из восходящего колена в дистальный извитой каналец поступает гипотонический раствор; здесь он за счет осмоса теряет воду, и становится изотоническим, причем объем жидкости наполовину уменьшается. При прохождении раствора по собирательной трубочке к вершине сосочка вода продолжает удаляться, поскольку окружающая среда становится все более гипертоничной по отношению к раствору. Здесь, как и в дистальном извитом канальце, водопроницамость стенки регулируется антидиуретическим гормоном (АДГ). Его количество определяет концентрацию и объем мочи, покидающей почку в вершине сосочка. Таким образом, в корковом слое каналы нефрона содержат гипотонический раствор, в мозговом – гипертонический.
Столь простая модель годится лишь для описания основных принципов концентрирования мочи, а реальные механизмы, действующие в мозговом веществе почки, намного сложнее. Рассмотрим схему на рис. 3. Вслед за NaСl, выкачиваемым из толстого сегмента восходящего колена петли Генле, в межклеточное пространство из нисходящего колена петли Генле и соседних собирательных трубочек устремляется вода (этот процесс регулируется АДГ). Из нисходящей части петли Генле вода выходит и за счет гидростатического давления (участок сужен и возникает перепад давления). Трубочки относительно непроницаемы для мочевины, поэтому ее концентрация в канальцевой жидкости, достигающей внутренней зоны мозгового вещества, сильно повышается. Здесь проницаемость для мочевины возрастает, и она диффундирует в межклеточное пространство, что обеспечивает осмотическую потерю воды из нисходящего колена. Последнее непроницаемо для NaСl, и концентрация этой соли постепенно повышается к вершине сосочка. В тонком сегменте восходящего колена жидкость попадает в противоположные по проницаемости условия: здесь проницаемость низка для воды и высока для NaСl и мочевины. По градиенту концентрации NaСl диффундирует из петли Генле, а мочевина поступает в нее. У толстого сегмента восходящего колена низкая проницаемость для мочевины, как и у дистального извитого канальца и верхнего сегмента собирательной трубочки, в которых под влиянием АДГ реабсорбируется вода. Таким образом, концентрация мочевины в растворе непрерывно повышается, и последняя замещает NaСl, интенсивно реабсорбируемый дистальной частью нефрона, особенно в присутствии альдостерона. Следовательно, некоторое количество мочевины челночно перемещается в дистальном отделе нефрона, перенося энергию для концентрирования мочи из толстого сегмента петли во внутреннюю зону мозгового вещества.
Накоплению мочевины в мозговом веществе способствуют прямые сосуды; в них опять-таки по принципу противоточной диффузии ее концентрация повышается к вершине петли Генле. За счет этого эффекта, в свою очередь, поддерживается на низком уровне градиент концентрации между кровью и жидкостью в собирательной трубочке. Итак, концентрирование мочи, выделяемой почками, осуществляется осмотическим путем за счет транспорта NaСl, но сам NaСl замещается мочевиной, этот конечный продукт обмена выводится растворенным в минимальном объеме воды.

Рис. 3. Процесс противоточного концентрирования мочи в мозговом веществе почек. Из нисходящей части петли Генле вода выходит за счет гидростатического давления (участок сужен и возникает перепад давления). Прямой сосуд с высокой проницаемостью для NaСl, мочевины и воды образует единую жидкостную систему с межклеточным пространством. Сюда из толстого сегмента восходящего колена петли Генле выводится NaСl и концентрация мочевины постепенно растет к вершине сосочка. Структуры, проницаемые для мочевины, обозначены штриховой линией. Белые стрелки активный транспорт NaСl; сплошные стрелки перенос мочевины; штриховые стрелки перенос воды
Таким образом, деятельность петли нефрона, конечных частей дистального сегмента и собирательных трубок обеспечивает способность почек вырабатывать большие объемы разведенной (гипотонической) мочи – до 900 мл/ч, а при дефиците воды экскретировать всего 10–12 мл/ч мочи, в 4,5 раза более осмотически концентрированной, чем кровь. Способность почки осмотически концентрировать мочу исключительно развита у некоторых пустынных грызунов, что позволяет им длительное время обходиться без воды.
Количество мочи, выделяемое человеком за определенное время называют диурезом. Эта величина у здорового человека колеблется в широких пределах в зависимости от состояния водного обмена. При обычном водном режиме за сутки выделяется 1–1,5 л мочи. После потребления значительного количества воды скорость мочеотделения достигает 15–20 мл/мин. В условиях высокой температуры окружающей среды вследствие возрастания потоотделения количество выделяемой мочи уменьшается. Ночью во время сна диурез меньше, чем днем. Уменьшение мочеотделения под влиянием АДГ при дефиците воды в организме называют антидиурезом.
С мочой могут выделяться большинство веществ, имеющихся в плазме крови, а также некоторые соединения, синтезируемые в почке. Суточная экскреция натрия составляет 170–260 ммоль, калия – 50–80, хлора – 170–260, кальция – 5 ммоль.
Почки служат главным органом экскреции конечных продуктов азотистого обмена. Мочевина, составляющая до 90 % азота мочи образуется при распаде белков; ее суточная экскреция достигает 25 – 35 г. Белки в нормальной моче выявляются в очень небольшом количестве (суточная экскреция не превышает 125 мг). Небольшая протеинурия наблюдается у здоровых людей после тяжелой физической нагрузки и исчезает после отдыха.
Глюкоза в моче в обычных условиях не выявляется. При избыточном потреблении сахара, когда концентрация глюкозы в плазме крови превышает 10 ммоль/л, при гипергликемии иного происхождения наблюдается глюкозурия – выделение глюкозы с мочой.
Цвет мочи зависит от величины диуреза и уровня экскреции пигментов. Цвет меняется от светло-желтого до оранжевого. Пигменты образуются из билирубина желчи в кишечнике, где билирубин превращается в уробилин и урохром, которые частично всасываются в кишечнике и затем выделяются почками. Часть пигментов мочи представляет собой окисленные в почке продукты распада гемоглобина.
С мочой выделяются различные биологически активные вещества и продукты их превращения, по которым в известной степени можно судить о функции некоторых желез внутренней секреции. В моче обнаружены производные гормонов коркового вещества надпочечников, эстрогены, АДГ, витамины. При патологии в моче обнаруживаются вещества, обычно в ней не выявляемые, – ацетон, желчные кислоты, гемоглобин и др.
Лекция 1. Введение в курс физиологии. Возбудимые ткани.
Биопотенциалы.
Литература:
1. Физиология человека: в 3-х томах. Под редакцией Р.Шмидта и Г.Тевса. М: Мир, 1996.
2. Физиология человека: в 2-х томах. Под редакцией Покровского и Коротько. М: Медицина, 1997.
3. Нормальна фізіологія. За ред. Філімонова. К: Здоров’я, 1996.
4. В.Ганонг. Фізіологія людини. Львів, 2002.
5. ihtic.lib.ru (медицина)
6. pubmed.com