| №
| Формула
кислоты
| Название
кислоты
| Название
солеи
| №
| Формула
кислоты
| Название
кислоты
| Название
солеи
|
|
| Н2ZnО2
| Цинковая
| Цинкаты
|
| НРО3
| (Мета-)фосфорная
| (Мета-) фосфаты
|
|
| Н3АlО3
| Алюминиевая
| Алюминаты
|
| Н3АsО4
| Мышьяковая
| Арсенаты
|
|
| НАlО2
| Метаалюминиевая
| метаалюминаты
|
| Н3АsО3
| Мышьяковистая
| Арсениты
|
|
| Н3ВО3
| (Орто)- борная
| (Орто-)бораты
|
| H2SO3
| Сернистая
| Сульфиты
|
|
| Н2В4О7
| Тетраборная
| Тетрабораты
|
| H2SO4
| Серная
| Сульфаты
|
|
| Н2СО3
| Угольная
| Карбонаты
|
| H2S
| Сероводород
| Сульфиды
|
|
| НСООН
| Муравьиная
| Формиаты
|
| H2СrO4
| Хромовая
| Хроматы
|
|
| Н2С2О4
| Щавелевая
| Оксалаты
|
| H2Сr2O7
| Двухромовая
| Дихроматы
|
|
| СН3СООН
| Уксусная
| Ацетаты
|
| HMnO4
| Марганцовая
| Перманганаты
|
|
| HCN
| Циановодород
| Цианиды
|
| H2МnO4
| Марганцовистая
| Манганаты
|
|
| HCNS
| Родановодород
| Роданиды
|
| НСl
| Хлороводород
| Хлориды
|
|
| H2SiO3
| Кремниевая
| Силикаты
|
| НСlO
| Хлорноватистая
| Гипохлориты
|
|
| HNO2
| Азотистая
| Нитриты
|
| HCIO2
| Хлористая
| Хлориты
|
|
| HNO3
| Азотная
| Нитраты
|
| НСlO3
| Хлорноватая
| Хлораты
|
|
| Н3РО4
| (Орто-)фосфорная
| (Орто-) фосфаты
|
| НС1O4
| Хлорная
| Перхлораты
|
| | | | | | | | | | |
1.8. Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (гидроксид-аниона) (OH-). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Хорошо растворимые в воде основания называются щелочами. Основные типы реакций гидроксидов – нейтрализации.
1.9. Со́ли — класс химических соединений, состоящих из катионов и анионов. В роли катионов в солях могут выступать катионы металлов, ониевые катионы (катионов аммония  , фосфония
, фосфония 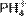 , гидроксония
, гидроксония  и их органические производные), комплексные катионы и т.д., в качестве анионов — анионы кислотного остатка различных кислот, включая комплексные анионы и т.п. Основные типы реакций солей - ионообменные, разложения, замещения.
и их органические производные), комплексные катионы и т.д., в качестве анионов — анионы кислотного остатка различных кислот, включая комплексные анионы и т.п. Основные типы реакций солей - ионообменные, разложения, замещения.
1.10. Комплексное соединение К.С.— химическое вещество, в состав которого входят комплексные частицы. Комплексная частица — сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. [(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II) (катионное К.С.), K2[BeF4] — тетрафторобериллат(II) калия (анионное К.С.), Li[AlH4] — тетрагидридоалюминат(III) лития (анионное К.С.), [Ni(CO)4] — тетракарбонилникель, [Pt(NH3)2Cl2] — дихлородиамминплатина(II) (нейтральное К.С.).
Типы химических реакций
1. Хими́ческая реа́кция. Типы реакций: - окислительно-восстановительные реакции ОВР и не ОВР;реакции присоединения (ассоциации, агрегации), разложения (отщепления), обмена и замещения, перегруппировки; - нейтрализации, необратимые; обратимые;, эндотермические; реакции. комплексообразования; простые, сложные; - гомогенные, гетерогенные.
2. Окислителыные, восстановительные реакции. реакции диспропорционирования, Вещества окислители и восстановители.
3. Реакции нейтрализации. Ионнообменная реакция. В каких случаях идёт ионообменная реакция. Электрохимическая реакция. Электроды. Анод. Катод.
4. Основные закономерности электрохимического процесса.
5. ЕДС гальванического элемента.
2.1. Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется изотопный состав химических элементов, при этом происходит перераспределение электронов и образуются новые химические вещества.
Типы реакций:
- реакции присоединения (ассоциации, агрегации) АВ + С → АВС, разложения (отщепления) АВС → АВ + С, обмена и замещения (число частиц в правой и левой части одинаково) В + С → АС + В, перегруппировки АВС → АСВ;
- нейтрализации, необратимые – реакции, протекающие только в одном направлении до полного израсходования одного из реагирующих веществ; обратимые – процессы, в которых одновременно протекают две взаимно противоположные реакции – прямая и обратная; экзотермические – проходящие с выделением тепла, эндотермические – с поглощением тепла;
- реакции комплексообразования (переноса электронных пар):
Fe+3€€€€€€ + 6: СN- ® [ Fe (СN)6]
кислота (по-Льюису)
акцептор основание (по-Льюису)
комплексообразователь донор (лиганд)
- простые – реакции протекающие в одну стадию, сложные – реакции протекающие в несколько стадий, каждая из которых является простой. Скорость сложной реакции определяется скоростью наиболее медленной лимитирующей стадии;
- гомогенные – реакции характеризующиеся отсутствием поверхности разделе между реагентами, поэтому их взаимодействие протекает по всему объёму, гетерогенные – реакции, характеризующиеся наличием поверхности раздела, где и протекает взаимодействие и другие типы.
2.2. Окислительно-восстановительные реакции ОВР, в которых атомы одного элемента (окислителя) восстанавливаются, то есть понижают свою степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления.
Окислитель + е ® восстановитель (окислитель принимает электроны, реакция восстановление): КМn+7O4→ Mn+4O2 ( степень окисления понижается, здесь реакция восстановления марганца до четырёхвалентного).
Восстановитель – е ® окислитель (восстановитель отдаёт электроны, реакция окисление); Na2S2- → S0 (степень окисления повышается, здесь реакция окисления серы со С.О. -2 до простого вещества)
Частным случаем окислительно-восстановительных реакций являются реакции диспропорционирования, в которых окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в разных степенях окисления. Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрат-аниона, а восстановителем — азот (-3) катиона аммония: NH4NO3 = N2O + 2H2O (до 250 °C).
2.3. Реакции нейтрализации – взаимодействие между веществами кислого и основного характера, с образованием нейтральных веществ (соли, воды): ZnO + 2NaOH → Na2ZnO2 + H2O.
Ионнообменная реакция - обмен ионами между веществами, с образованием осадка (смотреть таблицу растворимости), газа, или слабого электролита (например, воды): Молекулярное уравнение Zn(OH)2 + Na2S → NaOH + Zn S↓ Полное ионное уравнение Zn+2 + 2OH- + Na+ + S-2 → Na+ + OH- + Zn S↓ Краткое ионное уравнение Zn+2 + S-2 → Zn S↓
Электрохимическая реакция – ОВР в электрическом поле, создаваемом электродами с выделением на электродах веществ. Электроды — проводники, соединённые с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
2.4. Основные закономерности электрохимического процесса: 1. Восстанавливаются на катоде металлы, стоящие в Электрохимическом ряду активности http://ru.wikipedia.org/wiki/ (ряд напряжений, стандартных электродных потенциалов) металлов до Тi: только из расплавов. Для менее активных металлов от Тi (включительно) до Pb- конкурирующие реакции, выделение водорода, и выделение металла в чистом виде одновременно. Не активные металлы, стоящие правее водорода легко разряжаются и восстанавливается только металл. 2. На аноде легко окисляются OH−, Cl−, Br−, I−, S2−. Тяжело окисляются (только из расплавов) PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F−. В водном растворе электролизу подвергается вода с выделением кислорода. Li→K→Ba→Sr→Ca→Na→Mg→Al→Тi→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pt→Au
| Раствор солиактивного металла и бескислородной кислотыNaCl ↔ Na++ Cl−K(-): 2H2O + 2e = H2+ 2OH−A(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2 Вывод: 2NaCl + 2H2O(электролиз) → H2+ Cl2+2NaOH
Раствор соли менее активного металла и бескислородной кислоты ZnCl2↔ Zn2++ 2Cl−K"катод"(-): Zn2++ 2e = Zn0 A"анод"(+): 2Cl− — 2e = 2Cl0 Вывод: ZnCl2(электролиз) → Zn + Cl2
Раствор соли активного металла и кислородсодержащей кислоты Na2SO4↔2Na++SO42−K(-): 2H2O + 2e = H2+ 2OH−A(+): 2H2O — 4e = O2+ 4H+ Вывод: 2H2O (электролиз) → 2H2+ O2
| Расплав соли активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl− K(-): Na+ + 1e = Na0 A(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2 Вывод: 2NaCl → (электролиз) 2Na + Cl2
Расплавгидроксида: активный металл и гидроксид-ион NaOH ↔ Na+ + OH− K(-): Na+ +1e =Na0 A(+): 4OH− −4e =2H2O + O2 Вывод: 4NaOH → (электролиз) 4Na + 2H2O + O2
Расплав соли активного металла и кислородосодержащей кислотыNa2SO4↔2Na++SO42−K(-): 2Na+ +2e =2Na0 A(+): 2SO42− −4e =2SO3+O2 Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2
|
2.5. ЕДС гальванического элемента ΔE = Eкатода - Eанода; E = E0 + [RT/(z*F)]*ln[C], где E0 – стандартный электродный потенциал, R = 8,31 Дж моль К, z – число электронов ОВР; F = 96485,34 Кл∙моль-1 С – молярная концентрация, http://www.xumuk.ru/galvanopara/



 , фосфония
, фосфония 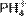 , гидроксония
, гидроксония  и их органические производные), комплексные катионы и т.д., в качестве анионов — анионы кислотного остатка различных кислот, включая комплексные анионы и т.п. Основные типы реакций солей - ионообменные, разложения, замещения.
и их органические производные), комплексные катионы и т.д., в качестве анионов — анионы кислотного остатка различных кислот, включая комплексные анионы и т.п. Основные типы реакций солей - ионообменные, разложения, замещения.


