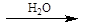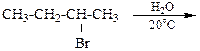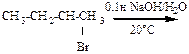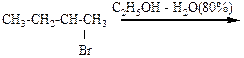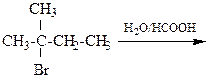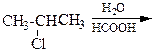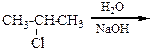Национальный исследовательский ядерный
университет «МИФИ»
Обнинский институт атомной энергетики
Факультет естественных наук
Ю.Д. Соколова, И.Г. Максимова
Сборник задач и упражнений по органической химии
Ациклические соединения
Обнинск 2010
УДК 547(076.1)
Соколова Ю.Д., Максимова И.Г. Сборник задач и упражнений по органической химии. Ациклические соединения. – Обнинск: ИАТЭ НИЯУ МИФИ, 2010. 55 с.
Пособие предназначено для работы на семинарских занятиях и выполнения домашних заданий для студентов направления 020000 «Естественные науки» специальности 020101 «Химия»
Рецензенты:
д.х.н. В.Р. Дуфлот
к.х.н. В.В.Поздеев
Темплан 2010, поз.38
© Обнинский институт атомной энергетики НИЯУ МИФИ, 2010 г.
© Ю.Д. Соколова, И.Г. Максимова 2010 г.
Введение
Предмет «Органическая химия» является достаточно объемным и фундаментальным естественно-научным курсом. При его изучении необходима систематическая подготовка, поскольку большой массив информации, химических реакций невозможно освоить за короткий промежуток времени. Курс имеет логическую структуру, основанную на многолетнем опыте преподавания в высших учебных заведениях. Пропустив небольшую часть материала, студент «выпадает» из логической цепочки и не может включиться в дальнейшую работу. Отрабатываемые на семинарах задачи по синтезам включают в себя всю информацию, полученную студентами на данный момент в рамках изучаемого курса, поэтому пропуски занятий или неподготовка к ним нарастают как снежный ком, и студенту становится сложно участвовать в работе на семинаре. Только регулярные самостоятельные занятия позволят добиться успеха.
При подготовке к семинару студенту необходимо обращать особое внимание на механизмы органических реакций, самостоятельно писать эти механизмы в целях заучивания и применять их для конкретных соединений.
При подготовке к семинарским и лабораторным занятиям студенту помимо лекций необходимо знакомиться с основной и дополнительной литературой по данному курсу и обращать внимание на различные методы получения органических соединений. Различные интерпретации тех или иных тем позволят закрепить полученные на лекциях знания и расширить кругозор в этой области. Для того, чтобы овладеть предметом в совершенстве студенту рекомендуется знакомиться с периодическими изданиями, узнавать о новейших достижениях в данной области знаний.
При решении задач по синтезу необходимо использовать рекомендации, изложенные отдельно (см. ниже). Если студент не понял какую-то часть материала, будь то химическая реакция или механизм и т.д., ему необходимо обратиться к преподавателю за разъяснением, прийти на консультацию. Непонимание небольшого «кусочка» информации может повлечь за собой непонимание дальнейшего материала. Студент должен быть пытливым, старательным, аккуратным, внимательным, любить науку, которую выбрал. Ему должно быть интересно учиться это главный залог успеха.
Алгоритм выполнения синтеза
- Прежде чем приступить к решению задач по синтезам повторите лекционный материал по теме семинара.
- Проведите анализ исходного и конечного продуктов по
- количеству атомов углерода,
- наличию функциональных групп.
- Выпишите реакции получения конечной функциональной группы.
- Выпишите реакции получения промежуточных продуктов.
- Пропишите схемы получения искомого продукта.
- Выберите оптимальную схему (с меньшим количеством этапов).
- Проверьте схему на энергетические затраты.
- Пропишите схему синтеза, указав все условия промежуточных стадий.
Планирование многостадийных синтезов
При планировании синтеза органических соединений можно использовать два методических порядка:
- синтетическое планирование;
- ретросинтетическое планирование.
Синтетическое планирование заключается в прямой схеме последовательных реакций, которые приводят в конечном итоге к получению заданного соединения.
Ретросинтетическое планирование – это планирование синтеза от конечного продукта. В этом случае пишутся реакции, позволяющие получить каждое предшествующее соединение в цепи реакций.
При планировании многостадийного синтеза следует учитывать многие факторы:
- доступность исходных веществ;
- возможность синтеза при наименьшем количестве стадий (т.к. на каждой стадии органической реакции выход редко превышает 60 - 70% от теоретического);
- однозначность протекания каждой стадии; если какая-либо реакция может протекать по нескольким направлениям, это снижает выход и затрудняет выделение целевого продукта из реакционной массы;
- агрегатное состояние образующихся в качестве промежуточных продуктов веществ; с газообразными продуктами труднее работать;
- энергетические затраты той или иной стадии процесса;
- легкость выделения, разделения и очистки продуктов реакции;
- условия техники безопасности, токсичность веществ и т.д.
Прежде чем приступить к планированию и составлению схемы реакций необходимо провести анализ исходных соединений и конечного продукта.
В большинстве предлагаемых задач встречается один из приведенных ниже вариантов:
- число атомов углерода в исходной молекуле и конечной одинаково и углеродный скелет идентичен;
- число атомов углерода в исходной молекуле и конечной одинаково, но углеродный скелет различается по строению;
- в конечной молекуле на один атом углерода больше, чем в исходной;
- в конечной молекуле на один атом углерода меньше, чем в исходной;
- в конечной молекуле в двое больше атомов углерода, чем в исходной;
- в конечной молекуле содержится 2n1 атомов углерода, где n – число атомов углерода в исходной молекуле;
- в конечной молекуле содержится 2n2 атомов углерода, где n – число атомов углерода в исходной молекуле
Рассмотрим все варианты.
Первый вариант является наиболее простым. В этом случае вводится или модифицируется функциональная группа, например,
CH3-CH2-CH=CH2→ CH3-CH2-CH(NH2)-CH3,
Во втором варианте строение молекулы может измениться при появлении карбонильной группы или кратной связи или при получении изомерного продукта, например,
a) CH2(Br)-CH2(Br)→CH3COH
 б)
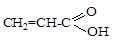
б) 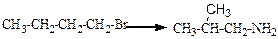
 В третьем варианте требуется удлинить углеродную цепь на один атом. Существует множество способов удлинения цепи.
В третьем варианте требуется удлинить углеродную цепь на один атом. Существует множество способов удлинения цепи.
Электронные эффекты
2.1. Укажите смещение электронной плотности и укажите эффекты
а)
| б)
CH2=CH-O-CH3
|
в)
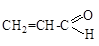
| г)
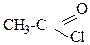
|
д)
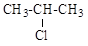
|
е)

|
|
ж) CH2=CH-Cl
| з)
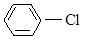
|
2.2. Укажите электронные эффекты
а)
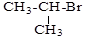
| б)
CH3-CH2-CH2-NH2
|
в)
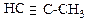
| г)
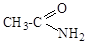
|
д)
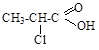
| е)
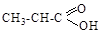
|
ж)
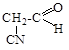
| з)
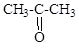
|
и)

| к)
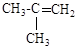
|
л)
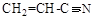
| м)
CH2=CH-Cl
|
2.3. Расположите в порядке возрастания химической активности
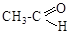

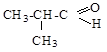
Ответ обоснуйте.
2.4. Расположите соединения по мере увеличения дипольного момента
а) CH3-CH2-CN; б) CH3-CH2-OH; в) CH3-CH2-F.
2.5. Расположите в порядке возрастания кислотных свойств следующие кислоты:
Выпишите константы диссоциации, проверьте правильность вашего ряда.
2.6. Какая из кислот является наиболее сильной
а) фторуксусная, хлоруксусная или бромуксусная; б) хлоруксусная, дихлоруксусная или трихлоруксусная?
Объясните почему.
2.7. В каком соединении активность карбонильной группы выше в уксусном альдегиде или уксусной кислоте? Ответ поясните.
2.8. Расположите в порядке возрастания кислотных свойств
2.9. Бромистый аллил и бромистый пропил имеют очень низкие t кип (70 и 71С°). В тоже время t кип бромистого винила (15.8С°) значительно ниже, чем t кип бромистого этила (38.4С°). Чем это объяснить?
2.10. Какое соединение имеет более высокую t кип : 1-бромбутен-1 или 1-бромбутен-2?
2.11. Бензальдегид содержится в эфирных маслах многих растений. Покажите, как распределена электронная плотность в молекуле бензальдегида
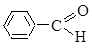
2.12. Покажите распределение электронной плотности в диеновых фрагментах в молекуле сорбиновой кислоты
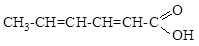
2.13. Какое влияние электронодонорное или электроноакцепторное оказывает на электронную плотность бензольного кольца каждая из функциональных групп в молекуле?
а) ванилина б) п -аминосалициловой кислоты

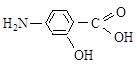
в) п -хлорфенола в) п -аминобензойной кислоты

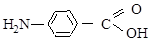
2.14. Дайте определение понятий «полярная связь», «неполярная связь». Учитывая электроотрицательность атомов, выберите наиболее полярную и наименее полярную связь. На каком из атомов углерода приведенных ниже связей электронная плотность минимальная?
а) C-O; C-H; C-N; N-O б) C-C; O-H; N-H; C-Br в) F-Br; С-F; C-H; С-N
2.15. Дайте определение понятия «поляризуемость связи». В чем заключается различие между полярностью и поляризуемостью связей? Какая из связей в каждой паре является более поляризуемой?
а) C-C и C≡C б) C-F и C-I в) C-Cl и C-I
г) С-N и C=N д) C-N и С≡N е) N-N и N=N
ж) C-O и C=O з) C-C и C-I и) С-С и C=C
к) C-F и C-Br л) C-O и С-F м) C=N и C≡N
н) C-S и C-O
Водородная связь
3.1. Некоторые из приведенных ниже соединений участвуют в образовании водородных связей, что влияет на их t кип. Укажите более высококипящее вещество в каждой паре
а) CH3COOH и CH3-COH
б) CH3-CH2OH и CH3-CH2-CH3
в) салициловый альдегид и м -гидроксибензальдегид
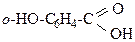

3.2. В спиртовом растворе фенола возможно существование различных водородных связей
а) б)
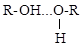
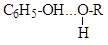
в) г)

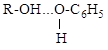
В каком случае водородная связь наиболее прочная? Ответ обоснуйте.
3.3. Фенол с диоксаном образует водородную связь
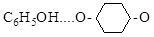
Как изменится прочность водородной связи при введении в молекулу фенола заместителей
п -CH3; п -Cl; п -NO2; п -CH3-O?
3.4. Определите, где водородная связь будет прочнее
а) метиловый спирт и диэтиловый эфир; б) этиловый эфир и диэтиловый эфир; в) н -бутиловый спирт и диэтиловый эфир.
Изомерия
5.1. Разделите предложенные соединения на пространственные и структурные. Укажите геометрические изомеры
а) CH3-CH2-CH2OH б) 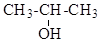
в) CH3-(CH2)2-CH3 г) 

д) CH2=CH-CH2-CH3 е) CH3-CH=CH-CH3
ж) з)

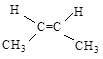
и) к)

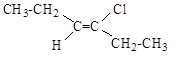
5.2. Укажите Z и E изомеры
а) б)


в) г)
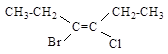

5.3. Какие из указанных ниже соединений могут обладать изомерией?
а) CH3-CH=CH2 б) CH3-CH=CH-CH3 в) СH3-C≡C-CH2-CH3
г) CH2=CH-CH=CH-CH3 д) CH2=CH-CH=CH2
е)
 ж) Cl-CH=CH2
ж) Cl-CH=CH2
з) Cl-CH=CH-CH3
5.4. Напишите структурные формулы всех изомеров пентана.
5.5. Изобразите проекции Ньюмана для следующих молекул. Назовите конформации при повороте вокруг простой C-C связи через каждые 600, делая полный круг вращения на 3600.
а) CH3-CH2Cl
б) в)

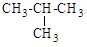
г) д)

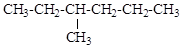
5.6. Назовите изображенное в виде проекционной формулы Ньюмана соединение по систематической номенклатуре. Изобразите частично заслоненную конформацию (анти-) и скошенную (гош-).
а) б) в)



5.7. В каких случаях возможна оптическая изомерия? Пометьте хиральный атом и нарисуйте проекции Фишера. Укажите количество изомеров и принадлежность к R- и S- классификации.
5.8. Дан моносахарид - 2,3,4-тригидроксибутаналь
1) Напишите проекционные формулы Фишера его оптически активных форм. Укажите изомеры в R-S- номенклатуре

2) Изобразите все оптические изомеры в виде проекций Ньюмана для связи C2-C3
5.9. Напишите для 2-метилпропанола-1 проекции Ньюмана для связи C1-C2, при повороте на каждые 600. Укажите на графике Е (кДж/моль) – угол поворота (град) положение каждого изомера. Изобразите проекционные формулы Фишера и назовите оптически активные изомеры в R-S- номенклатуре.
5.10. Укажите, какие из пар соединений являются энантиомерами, какие диастереомерами?
5.11. Постройте проекционные формулы Фишера в R-S конфигурации для соединений
а)

| б)
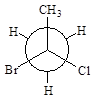
|
| в) 2-бромбутан
| г) пентанол-2
|
д)
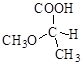
| е)

|
5.12. Определите конфигурацию энантиомеров согласно R-S-номенклатуре
а) б)




в)
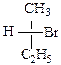
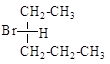
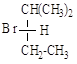
г) д)
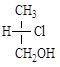



5.13. Назовите по R-S номенклатуре
а)




б)

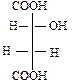
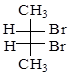
в)
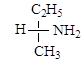



г)


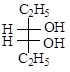
д)




е)




ж)



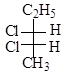
з)


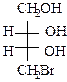
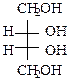 .
.
5.14. Трансформируйте проекции Ньюмана стереоизомеров 2,3-дибромбутана в проекции Фишера. Укажите среди них проекционные формулы, соответствующие а) энантиомерам, б) диастереомерам. Все ли изомеры оптически активны? Назовите изомеры по R-S-номенклатуре.
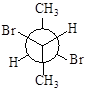

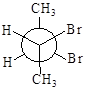 .
.
5.15. Напишите формулы стереомеров согласно Z,E-номенклатуре
а) CH3-CH=CH-CH2-CH3 б) C6H5-CH=CH-COOH
в) г)
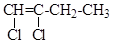

д) CH3-CH=CH-COOH
5.16. Какие из приведенных соединений могут существовать в виде мезо-формы?
а) б)
в) г)

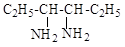
Является ли мезо-форма оптически активной? Изобразите мезо-формы в проекциях Фишера.
Алканы, алкены
6.1. По названию соединения напишите структурную формулу
6.1.1.
а) ди трет -бутилметан; б) 1-бром-2,2-диметилпропан; в) 5-изопропил-4-пропилоктан;
г) 4-бутил -2-метилоктан; д) 4,4-диметилпентен-1; е)b- втор -бутил-α-метилэтилен;
ж) α-аллил -b- втор -бутил-α,b-диметилэтилен.
6.1.2.
а) 2-метил-5- трет -бутилнонан; б) 2,2,4,4-тетраметилпентан; в) 4-метилгексен-2;
г) 1-бром-2,2-диметилпропан.
6.1.3.
а) 2,2,1,6-тетраметилоктен-4; б) α,b-ди трет -бутилэтилен; в) изопропилметилацетилен;
г) бутил- втор- бутил- трет -бутилметан; д) тетраметилметан; е) изопропилпропилэтилметан;
ж) втор -бутил-этилацетилен.
6.2. Назовите по систематической и рациональной номенклатуре соединения
а) б)
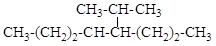
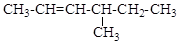
в) г)
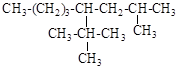

д) е)
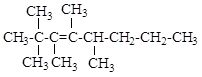
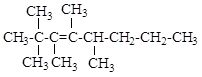 ж) з)
ж) з)


и) (CH3)3C-CH=CH-CH3
6.3. Установлено, что при хлорировании алканов при температуре 20ºС относительная скорость замещения атома водорода изменяется в порядке: третичный > вторичный > первичный (на один атом водорода составляет 5.0:3.8:1.0).
Используя эти данные, предскажите соотношение изомерных продуктов при монохлорировании
а) бутана; б) изобутана; в) 2,2,3-триметилбутана; г) 2,2,4-триметилпентана.
Используйте для расчета формулу
число первичных [Н] Х относит. скорость для первичных
число вторичных [Н] относит. скорость для вторичных
6.4. Напишите механизм хлорирования 2,3-диметилбутана при 500ºС в газовой фазе.
6.5. Напишите механизм нитрования 2-метилпропана.
6.6. Напишите механизм хлорирования пропена а) в CH3OH; б) в газовой фазе при t < 200Сº; в) в газовой фазе при t = 500Сº.
6.7. Установите строение алкилиодида, который при нагревании с иодистоводородной кислотой дает изобутан, а с Na образует 2,5-диметилгексан. Напишите уравнения реакций.
6.8. Изобутилен конденсируется с этиленом и хлористым водородом. Предложите ионный механизм этой реакции. Продуктом является 3,3-диметил-1-хлорбутан.
6.9. Напишите механизм димеризации изобутилена в присутствии H2SO4.
6.10. Объясните изменение реакционной способности в реакциях радикального присоединения в ряду этилен-пропилен-изопропилен.
6.11. Углеводороды н-гексан и гексен-3 имеют близкие t кип. Как очистить химическим путем:
а) н -гексан от гексена-3; б) гексен-3 от н -гексана.
6.12. Определите строение вещества по брутто-формуле и продуктам превращения

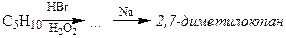
6.13. Напишите продукты, образующиеся при гидрохлорировании
а) CH2=CH-Cl; б) CH2=CH-NO2; в) CH3O-CH=CH2;
г)

6.14. Используя правило Марковникова, напишите уравнения гидрохлорирования, гидратации, сульфирования, хлорирования триметилэтилена.
6.15. Напишите продукты реакций, образующиеся при окислении в жестких условиях
а) б)


в) CH3-CH2-CH=CH-CH3
6.16. Составьте полуреакции для реакций окисления для
а) CH2=CH2; б) CH3-CH=CH-CH3; в) CH3-CH=CH2.
6.17. Напишите реакции озонолиза для
а) 2-метилгептадиена-2,5; б) мирцена (выделяют из листьев лавра) - 3,7-диметилоктадиен-1,6;
в) оцимена (составная часть эфирного масла хмеля) - 3,7-диметилоктатриен -1,3,6;
г) бисаболена (компонент лимонного масла) -
 .
.
6.18. Напишите структурные формулы алкенов, при озонолизе которых получается смесь бутанона-2 и формальдегида.
6.19. При озонолизе продукта присоединения 1 моль HBr диенового углеводорода образовался 1 моль пропаналя и 1моль 2-бромпропаналя. Какой диеновый углеводород вступил в реакцию, и по какому типу произошло присоединение?
6.20. Димеризация 2-метилбутена-2 под действием 60% ного раствора H2SO4 приводит к смеси алкенов, среди которых можно выделить два основных соединения (I и II). При озонировании алкена I образуются 3,3-диметилпентанон-2 и пропанон, а алкена II – 3-метил-4,4-диметилгексанон-2 и метаналь. Какое строение имеют алкены I и II?
6.21. Расшифруйте схему. Напишите уравнения реакций 
6.22. Из каких реагентов можно получить следующие соединения по реакции Дильса-Альдера?
6.23. Напишите уравнения диенового синтеза (реакции Дильса-Альдера)
а) 2-метилпентадиен-1,3 с малеиновым ангидридом; б) бутадиен-1,3 с гексафторбутеном;
в) бутадиена-1,3 с дицианацителеном; г) циклопентадиен с малеиновым ангидридом;
д) гексадиена-2,4 с акриловым альдегидом; е) циклопентадиена с бромистым винилом;
ж) бутадиена-1,3 с кротоновым альдегидом; з) метилдивинила с ацетилендикарбоновой кислотой;
и) гексадиен-1,3 с винилдикарбоновой кислотой.
6.24. Укажите структуры диена А и диенофила Б, из которых получен

6.25. Напишите структурные формулы транс-диенов и переведите их в цис-форму и назовите по
Z-E -номенклатуре
а) транс -гекса 2Е,4Z-диен; б ) транс -гекса 2Е,4Е-диен.
6.26. Синтезы. Получите:
1) из пентанола-1 3-хлорпентен-1;
2) из пропилена 2,3-диметилбутен-2;
3) из бутанола-2 ацетальдегид;
4) из октанола-1 3-бромоктен-1;
5) из 1-бром-3-метилбутана 2-бром-2-метилбутан;
1) из 2-метилбутана 1-бром-2-метилбутан;
7) из пропана 2-бром-2,3-диметилбутан;
8) из пропанола-1 изопропиловый спирт (используйте реакции гидроксимеркурирования и димеркурирования);
9) из бромистого этила бутанол-2 (используйте реакции гидроксимеркурирования и димеркурирования);
10) из изопропанола эпоксипропан (через реакцию Прилежаева);
11) из пропена бромистый триметилен (через реакцию Циглера);
12) из α-метилпропионата натрия следующее соединение (через реакцию Дильса-Альдера)
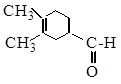
13) Расшифруйте схему

Каким (качественно) будет соотношение продуктов А и Б.
14) Из метилпропена изовалерьяновую кислоту, используя реактив Гриньяра.
15) Из пропена гексадиен-2,4 через стадию получения реактива Гриньяра.
Алкины
7.1. Назовите следующие соединения по систематической и рациональной номенклатуре:
а) в) CHºC-CH=CH2;

б) г)

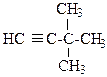
7.2. Напишите структурные формулы соединений
а) диметилацетилена; б) метилэтилацетелена; в) дитрет-бутилацетилена;
г) 3,3-диметилбутина-1; д) 3,4-диметилбутина-1; е) 3-метил-4-изобутилоктина-1.
7.3. Напишите уравнения реакций
а) гидратация пентина-2 →;
б) СН3-СH2-CºCH + [Cu(NH3)2]OH →;
в) СHºCH + CH3-COOH →;
г) циклотримеризация метилацетилена;
д) CH3-CºCH + KOH(тв) + C2H5OH →;
е) CH3-CºCH + NaNH2 →;
ж) CH3-CH2-CºC-CH2-CH3 + KMnO4 (H2O, t кип=25°С) →.
7.4. Напишите схемы последовательно протекающих реакций
а)

б)

в)
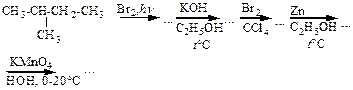
г)
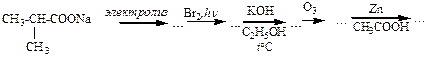 д)
д)

е)
 ж)
ж)

з)

7.5. Получите бутин-1 из бутена-1.
7.6. Получите пентин-1 из ацетилена.
7.7. Получите пентин-3 из ацетилена.
7.8. Получите гексин-1, гексин-2, гексин-3 из ацетилена.
7.9. Получите пентин-2 из пропена (через комплекс Йоцича).
7.10. Получите 4-метилпентин-2 из ацетилена (через комплекс Йоцича).
7.11. Получите 4-метилпентин-2 из 1-бром-4-метилпентана.
7.12. Получите акрилонитрил из 1,2-дибромэтана.
7.13. Получите винилацетилен из этилена.
7.14. Получите 1,4-дибромбутен-2 из ацетилена.
7.15. Получите 2-метилпентин-3-ол-2 из метилацетилена.
7.16. Получите ацетон и пропионовый альдегид из 2-метилпентана.
7.17. Получите 4-метил-пентин-2 из 1-бром-4-метилпентана.
7.18. Получите ацетальдегид из 1,2-дибромэтана.
7.19. Получите изопропиловый спирт из пропана.
7.20. Получите из бутанола-2 соединение следующего строения:
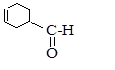
7.21. Получите пентин-1 из бутина-1.
7.22. Получите пентин-1 из бутена-1.
7.23. Получите изопрен из ацетона и ацетилена.
7.24. Получите из пропилена соединение следующего строения CHºC-CH2-O-CH2-CH=CH2.
7.25. Получите из ацетилена бутин-2-ол-1 (через комплекс Иоцича ). Все вспомогательные
органические соединения получите из исходного реактива.
7.26. Получите 2,2-диметилбутанол-1, используя реактив Гриньяря.
7.27. Получите бутинилацетат (бутин-1-илацетат) из бутина-1.
Нуклеофильное замещение
Элиминирование
8.1. В каком из соединений замещение на нуклеофил пройдет легче, а в каком труднее: 2-метил-5-бром пентан; 2-метил-3-бром пентен-2; 2-метил-4-бромбутен-2? Расположите в порядке уменьшения реакционной способности.
8.2. Расположите приведенные ниже соединения в ряд по уменьшению реакционной способности в реакциях SN1-типа.
8.3. Сравните скорости реакций в разных растворителях, оцените выходы продуктов замещения
а) (CH)3CH + H2O → (CH3)3C-OH + HCl
1) H2O 2) H2O /диоксан
б) 2C2H5Br + Na2S → (C2H5)2S + 2NaBr
1) H2O 2) ДМФА
в) (CH3)3C-Cl + H2O → (CH3)3C-OH+HCl
1) H2O 2) C2H5OH
г) CH3Br + KI → CH3I + KBr
1) H2O 2) CH3OH
8.4. Расположите соединения R-Cl в порядке уменьшения реакционной способности в реакции
R-Cl + KI 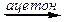 R-I + KCl,
R-I + KCl,
где R = н -C3H7; втор -C4H9; изо -C4H9; CH3.
8.5. Какая реакция замещения в каждой паре соединений будет протекать с большей скоростью?
а) CH3-CH2-CH2-Br 

б) C(H3)3C-Br 
(CH3)2CH-Br 
в) CH2=CH-Br 
CH3-CH2-Br 
г) CH2=CH-CH2-Br 
CH3-CH2-CH2-Br 
8.6. Каковы будут продукты реакций? Укажите механизм реакций
а) б)
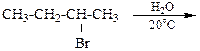
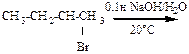
в) г)

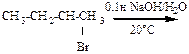
д)

е)
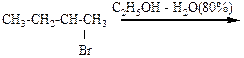
ж) з) 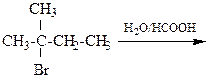

8.7. Укажите продукты реакций
а)

б)

в)

8.8. Получите алкен из 2-метил-3-бромпентана с помощью элиминирования а) по Гофману, б) по Зайцеву.
8.9. Получите алкен в качестве главного продукта из бромистого бутила.
8.10. Получите алкен в качестве главного продукта из 2-метил-2-бромбутана с использованием элиминирования а) по Гофману, б) по Зайцеву.
8.11. Предложите способ получения соединения, используя необходимые субстраты и нуклеофильные реагенты
а) CH3-CH2-CN; б) CH3-CH2-CH2NO2.
8.12. Расположите в ряд по легкости дегидратации следующие спирты, напишите уравнения реакций
а) б)
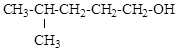
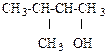
в)

8.13. Изопропил-трет-бутиловый эфир получается реакцией Вильямсона. Какие лучше взять реактивы (бромистый изопропил и трет -бутилат натрия или бромистый трет -бутил и изопропилат натрия), чтобы выход эфира был больше?
8.14. При обработке 3,3-диметилбутанола-2 85% H3PO4 получены продукты

Объясните, почему 2,3-диметилбутен-2 является основным продуктом дегидратации? Какой нужно взять растворитель, чтобы реакция пошла по 1-му случаю?
8.15. Объясните, почему в результате обработки 3-метилбутанола-2 бромистоводородной кислотой образуется 2-бром-2-метилбутан? Напишите механизм реакции.
8.16. Покажите механизм реакции. Объясните образование тетрагидрофурана при обработке 4-хлорбутанола-1 водным раствором щелочи (NaOH).
8.17. Какой из галогензамещенных алкенов будет легче подвергаться гидролизу. Ответ поясните.
а) 4- бромбутен-1; б) 3-бромбутен-1; в) 2-бромбутен-1.
8.18. Укажите продукты и механизмы реакций. Изобразите для каждой реакции проекции Ньюмана и «лесопильные козлы», укажите центр атаки нуклеофила
а) CH3-CH2-CH2-Br + NaOH 
б)

в)
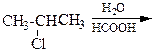
г)
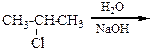
8.19. Напишите реакцию пропилхлорида со щелочью. Как изменится выход алкена при добавлении в реакционную смесь диоксана?
8.20. В какой из реакций хлористого втор -бутила с перечисленными ниже реагентами будет самый большой выход реакции замещения? Напишите эти реакции, укажите порядок
а) NaI/ ацетон; б) HOH/ спирт; в) KOH/ спирт; г) метиловый спирт.
8.21. Покажите механизм реакции дегидратации изоамилового спирта в 2-метилбутен-2.
8.22. Объясните, почему при гидратации 33-диметилбутена-1 в кислой среде образуется главным продуктом 2,3-диметилбутанол-2.
8.23. Напишите реакцию гидролиза для 2-метил-1-хлорбутана в 0,1н водном растворе NaOH
1) укажите механизм протекающих реакций;
2) изобразите проекции Ньюмана и «лесопильные козлы», укажите центр атаки нуклеофила;
3) укажите, преобладающие продукты при условии: а) 20°, б) 90°;
4) объясните образование 2-метилбутена-2 как главного продукта элиминирования.
8.24. Напишите для хлористого трет -бутила механизм Е2-элиминирования. Укажите, при каких условиях возможна реакция по Е2- механизму.
8.25. Напишите для хлористого трет -бутила механизм SN1- замещения. Укажите, при каких условиях возможна реакция по SN1-механизму. Напишите механизм Е1-элиминирования.
8.26. Для 3-метилбутанола-2 напишите реакцию дегидратации в 85% ного H3PO4. Укажите основной продукт и объясните, почему он является преобладающим продуктом.
Спирты. Эфиры
9.1. Назовите по рациональной номенклатуре
а) CH3Cl; б) CH2=CHCl; в) (CH3)



 б)
б) 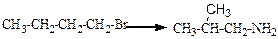
 В третьем варианте требуется удлинить углеродную цепь на один атом. Существует множество способов удлинения цепи.
В третьем варианте требуется удлинить углеродную цепь на один атом. Существует множество способов удлинения цепи.
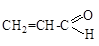
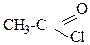
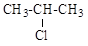

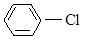
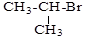
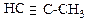
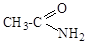
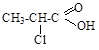
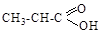
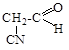
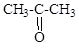

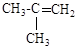
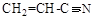
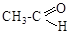

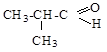
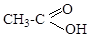

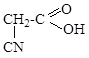
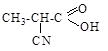

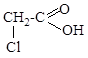
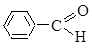
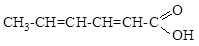

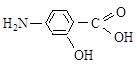

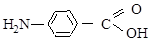
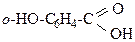

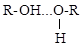
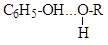

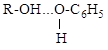
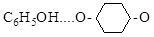
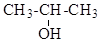



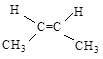

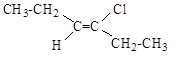


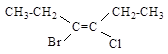

 ж) Cl-CH=CH2
ж) Cl-CH=CH2
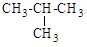

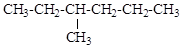









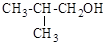

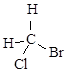


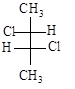


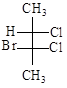
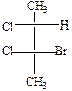


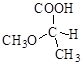





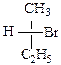
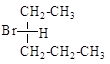
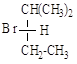
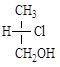








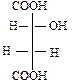
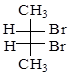
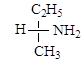





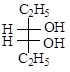











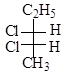


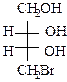
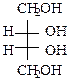 .
.

 .
.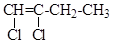

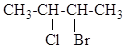
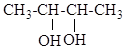

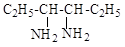
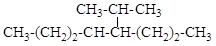
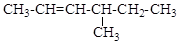
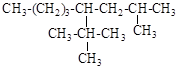

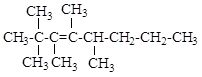



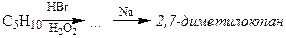


 .
.
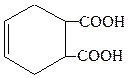


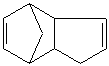
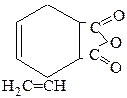





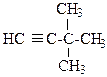


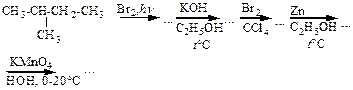
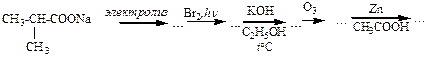 д)
д)
 ж)
ж)

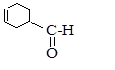
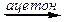 R-I + KCl,
R-I + KCl,