 При окислительно-восстановительном титровании в растворе протекают полуреакции
При окислительно-восстановительном титровании в растворе протекают полуреакции
Любой участник этих полуреакций может быть как титрантом, так и титруемым веществом.
Так, если титрантом является Ох1, то титруемое вещество – Red2 если титрант Ох2, титруемое вещество – Red1. И наоборот, в качестве титрантов могут выступать Red1, или Red2, а титруемыми веществами будут Ох2 и Ох1 соответственно.
 Для каждой полуреакции в соответствии с уравнением Нернста (влиянием ионной силы пренебрегаем)
Для каждой полуреакции в соответствии с уравнением Нернста (влиянием ионной силы пренебрегаем)
При титровании между титрантом и титруемым веществом протекает реакция

После добавления каждой порции титранта в растворе устанавливается равновесие и система приобретает потенциал Е, зависящий от соотношения концентраций исходных веществ и продуктов. Поэтому логично в качестве изменяющегося параметра при построении кривых титрования использовать потенциал системы. При равновесии потенциалы полуреакций равны E = E1 = E2 поэтому для расчета Е можно использовать и уравнение (I), и уравнение (II). При выборе уравнения руководствуются соображениями удобства и простоты вычислений. До точки эквивалентности удобно использован уравнение для полуреакции с участием титруемого вещества, после точки эквивалентности - уравнение полуреакции с участием титранта. При построении кривых ОВТ потенциал до начала титрования не рассчитывают, поскольку в исходном растворе известна концентрация только одной из сопряженных форм титруемого вещества.
 До точки эквивалентности. Пусть титруемое вещество - восстановитель, тогда
До точки эквивалентности. Пусть титруемое вещество - восстановитель, тогда
 Если титруемое вещество - окислитель, то
Если титруемое вещество - окислитель, то
 За точкой эквивалентности. Если титруемое вещество восстановитель, а титрант – окислитель, то
За точкой эквивалентности. Если титруемое вещество восстановитель, а титрант – окислитель, то
 в случае, если титрант – восстановитель,
в случае, если титрант – восстановитель,
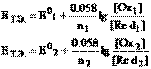 В точке эквивалентности неудобно рассчитывать потенциал ни полуреакции титранта, ни полуреакции титруемого вещества, поскольку в обоих случаях концентрация одной из сопряженных форм исчезающе мала. Чтобы не прибегать к громоздким вычислениям с использованием константы равновесия (хотя это и возможно), используем следующий несложный прием. Запишем уравнение Нернста в точке эквивалентности для каждой полуреакции
В точке эквивалентности неудобно рассчитывать потенциал ни полуреакции титранта, ни полуреакции титруемого вещества, поскольку в обоих случаях концентрация одной из сопряженных форм исчезающе мала. Чтобы не прибегать к громоздким вычислениям с использованием константы равновесия (хотя это и возможно), используем следующий несложный прием. Запишем уравнение Нернста в точке эквивалентности для каждой полуреакции
Сложим оба уравнения, предварительно умножив их на n1, и n2 соответственно

Обратим внимание на выражение под знаком логарифма. В точке эквивалентности концентрации реагирующих веществ находятся в стехиометрических отношениях:


Следовательно, величина под знаком логарифма равна 1 и

 Как видно, во все уравнения для расчета Е входят величины стандартных потенциалов. Если в процессе титрования возможно протекание конкурирующей реакции или нельзя пр енебречь ионной силой, стандартные потенциалы следует заменить формальными.
Как видно, во все уравнения для расчета Е входят величины стандартных потенциалов. Если в процессе титрования возможно протекание конкурирующей реакции или нельзя пр енебречь ионной силой, стандартные потенциалы следует заменить формальными.



 При окислительно-восстановительном титровании в растворе протекают полуреакции
При окислительно-восстановительном титровании в растворе протекают полуреакции Для каждой полуреакции в соответствии с уравнением Нернста (влиянием ионной силы пренебрегаем)
Для каждой полуреакции в соответствии с уравнением Нернста (влиянием ионной силы пренебрегаем)
 До точки эквивалентности. Пусть титруемое вещество - восстановитель, тогда
До точки эквивалентности. Пусть титруемое вещество - восстановитель, тогда Если титруемое вещество - окислитель, то
Если титруемое вещество - окислитель, то За точкой эквивалентности. Если титруемое вещество восстановитель, а титрант – окислитель, то
За точкой эквивалентности. Если титруемое вещество восстановитель, а титрант – окислитель, то в случае, если титрант – восстановитель,
в случае, если титрант – восстановитель,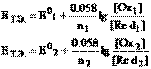 В точке эквивалентности неудобно рассчитывать потенциал ни полуреакции титранта, ни полуреакции титруемого вещества, поскольку в обоих случаях концентрация одной из сопряженных форм исчезающе мала. Чтобы не прибегать к громоздким вычислениям с использованием константы равновесия (хотя это и возможно), используем следующий несложный прием. Запишем уравнение Нернста в точке эквивалентности для каждой полуреакции
В точке эквивалентности неудобно рассчитывать потенциал ни полуреакции титранта, ни полуреакции титруемого вещества, поскольку в обоих случаях концентрация одной из сопряженных форм исчезающе мала. Чтобы не прибегать к громоздким вычислениям с использованием константы равновесия (хотя это и возможно), используем следующий несложный прием. Запишем уравнение Нернста в точке эквивалентности для каждой полуреакции



 Как видно, во все уравнения для расчета Е входят величины стандартных потенциалов. Если в процессе титрования возможно протекание конкурирующей реакции или нельзя пр енебречь ионной силой, стандартные потенциалы следует заменить формальными.
Как видно, во все уравнения для расчета Е входят величины стандартных потенциалов. Если в процессе титрования возможно протекание конкурирующей реакции или нельзя пр енебречь ионной силой, стандартные потенциалы следует заменить формальными.


