Описание атомов методом квантовых ячеек.
1) Электронные орбитали в атоме.
Итак, мы знаем, что орбиталь (или электронное облако) – место наиболее вероятного расположения электрона, "место его прописки". Если продолжить сравнивать поведение электронов с людьми, то и люди, и эти частицы могут по-разному относиться к своему "дому". Есть "домоседы", есть "бродяги", есть "вынужденные переселенцы", есть "любители компаний", которых трудно "застать дома на орбитали". Несмотря на такие с виду шутливые характеристики поведения электронов на орбиталях, подобное поведение частиц определяет многие физические и химические свойства веществ.
Рассмотрим, чем орбитали отличаются друг от друга.
Различия в размерах и энергии.
Чем ближе орбиталь к ядру, тем меньше ее размер и энергия.
 Рис. №1 Ближний к ядру электрон (фото
Рис. №1 Ближний к ядру электрон (фото
В разные моменты времени) находится на
Розовой орбитали, а более дальний электрон на
Дальней голубой орбитали.
Различия в форме

 Форма орбиталей бывает следующая:
Форма орбиталей бывает следующая:
Рис.№2 s-орбиталь Рис. №3 р-орбиталь


 (шар) (объемная восьмерка или гантель)
(шар) (объемная восьмерка или гантель)
Рис. №4 d-орбиталь Рис. №5 тоже d-орбиталь Рис.№6 f-орбиталь
("счастливый клевер) ("гантель с перехватом") (цветок)
Сколько электронов может быть на 1 орбитали.
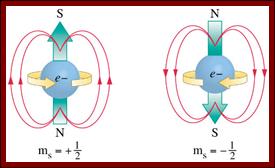 Запоминаем: орбитали могут быть пустые, с одним электроном (он называется неспаренным), с 2-мя электронами (они называются спаренными). Спаренные электроны должны вращаться в противоположные стороны вокруг своей оси (обладать противоположными спинами, чтобы не столкнуться в пространстве). Спин (от англ. "веретено") – движение ē вокруг собственной оси.
Запоминаем: орбитали могут быть пустые, с одним электроном (он называется неспаренным), с 2-мя электронами (они называются спаренными). Спаренные электроны должны вращаться в противоположные стороны вокруг своей оси (обладать противоположными спинами, чтобы не столкнуться в пространстве). Спин (от англ. "веретено") – движение ē вокруг собственной оси.
Рис. №7 Значение противоположных спинов ē на 1 орбитали
 Когда 2 электрона на 1 орбитали подходят слишком близко друг к другу, они начинают вращаться в противоположные стороны Þ возникает у каждого электрона магнитное поле (вспомните-ка явление электромагнитной индукции). Но магнитные поля 2 спаренных электронов противоположно направлены (см. стрелочки на рис.№67) Þ электроны наоборот, будут расталкиваться в пространстве
Когда 2 электрона на 1 орбитали подходят слишком близко друг к другу, они начинают вращаться в противоположные стороны Þ возникает у каждого электрона магнитное поле (вспомните-ка явление электромагнитной индукции). Но магнитные поля 2 спаренных электронов противоположно направлены (см. стрелочки на рис.№67) Þ электроны наоборот, будут расталкиваться в пространстве
Рис. №8 Спаренные электроны
На s-орбитали атома гелия.
Элементы модели
Представим орбиталь в атоме в виде клеточки или черточки – квантовой ячейки. А электроны на орбиталях будем обозначать стрелочками-векторами (вектор будет символизировать спин электрона). Таким образом, орбитали – квантовые ячейки будут выглядеть так:

Рис. № 13 Модель "квантовые ячейки".
Теперь посмотрим на иллюстрации, как надо правильно располагать электроны в ячейках согласно всем правилам, изложенным ниже:
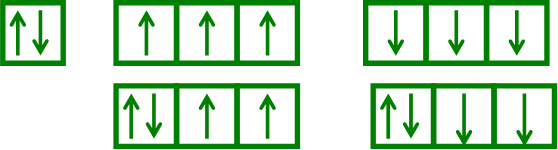
Рис. №14 Правильное расположение электронов на подуровне (учитывается принцип Паули и правило Гунда.
Следующая иллюстрация тоже очень ценная – она показывает неправильное расположение электронов на модели (здесь собраны самые типичные ошибки учеников).
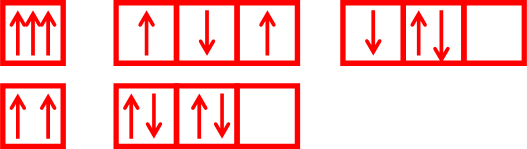
Рис. №15 Неправильные модели – в ячейках слева не выполняется запрет Паули, в ячейках в центре и справа не выполняется правило Гунда.
Задание №1 Описать атом кислорода.
Рассуждения: "О"№8Þ 8протонов в ядре. "О"Î II периодуÞ 2ē слоя. "О"Î главной подгруппе 6 группы Þ 6ē на внешнем слое.
 Строим ячейки и считаем: 1s-п/Ур (1 орбиталь Þ 1 ячейка); 2s-п/Ур (1 орбиталь Þ 1 ячейка); 2р-п/Ур (3 орбитали Þ 3 ячейки). Для удобства рекомендую все ячейки одного слоя рисовать на одном уровне (хотя в литературе и на сайтах подуровни тоже могут различаться по величине энергии, т.е. "лесенка" будет более сложной). Вот получится такая заготовка:
Строим ячейки и считаем: 1s-п/Ур (1 орбиталь Þ 1 ячейка); 2s-п/Ур (1 орбиталь Þ 1 ячейка); 2р-п/Ур (3 орбитали Þ 3 ячейки). Для удобства рекомендую все ячейки одного слоя рисовать на одном уровне (хотя в литературе и на сайтах подуровни тоже могут различаться по величине энергии, т.е. "лесенка" будет более сложной). Вот получится такая заготовка:
 Рис.№84 Заготовка
Рис.№84 Заготовка
С ячейками.
Теперь распределим в ячейках "векторы"-электроны. На внутреннем слое 2 ē, а на внешнем 6 электронов распределятся так: полностью построится 2s-подуровень (это 2 ē), а оставшиеся 4 ē окажутся на 2р-подуровне согласно правилу Гунда, внимание:

Рис.№85 Модель атома кислорода.
Задание №2 Описать атом хлора.
Рассуждения: "Cl"№17Þ 17протонов в ядре. "Cl"Î III периодуÞ 3ē слоя. "Cl"Î главной подгруппе 7 группы Þ 7ē на внешнем слое. Первый и второй слои – полные.
Строим ячейки и считаем: 1s-п/Ур (1 орбиталь Þ 1 ячейка); 2s-п/Ур (1 орбиталь Þ 1 ячейка); 2р-п/Ур (3 орбитали Þ 3 ячейки); 3s-п/Ур (1 орбиталь Þ 1 ячейка); 3р-п/Ур (3 орбитали Þ 3 ячейки); 3d-п/Ур (5 орбиталей Þ 5 ячеек);
Делаем заготовку ячеек с учетом того, что в атоме хлора уже 3 электронных слоя:

Рис.№86 Ячейки хлора
Далее заполняем полностью электронами ячейки 1 и 2 слоя, потом 3s-подуровень, а оставшиеся 5 электронов будут на 3р-подуровне (3d-подуровень будет стоять пустой, так как предыдущий подуровень неполный!)
Смотри иллюстрацию ниже!

Рис.№87 Строение атома хлора (неспаренный электрон может быть "стрелочкой вниз").
 Посмотрите еще на иллюстрации квантовых ячеек атомов:
Посмотрите еще на иллюстрации квантовых ячеек атомов:
Рис. №88 Квантовые ячейки элементов II периода.

Рис. №89 Строение атома азота
Описание атомов методом квантовых ячеек.
1) Электронные орбитали в атоме.
Итак, мы знаем, что орбиталь (или электронное облако) – место наиболее вероятного расположения электрона, "место его прописки". Если продолжить сравнивать поведение электронов с людьми, то и люди, и эти частицы могут по-разному относиться к своему "дому". Есть "домоседы", есть "бродяги", есть "вынужденные переселенцы", есть "любители компаний", которых трудно "застать дома на орбитали". Несмотря на такие с виду шутливые характеристики поведения электронов на орбиталях, подобное поведение частиц определяет многие физические и химические свойства веществ.



 Рис. №1 Ближний к ядру электрон (фото
Рис. №1 Ближний к ядру электрон (фото
 Форма орбиталей бывает следующая:
Форма орбиталей бывает следующая:

 (шар) (объемная восьмерка или гантель)
(шар) (объемная восьмерка или гантель) Запоминаем: орбитали могут быть пустые, с одним электроном (он называется неспаренным), с 2-мя электронами (они называются спаренными). Спаренные электроны должны вращаться в противоположные стороны вокруг своей оси (обладать противоположными спинами, чтобы не столкнуться в пространстве). Спин (от англ. "веретено") – движение ē вокруг собственной оси.
Запоминаем: орбитали могут быть пустые, с одним электроном (он называется неспаренным), с 2-мя электронами (они называются спаренными). Спаренные электроны должны вращаться в противоположные стороны вокруг своей оси (обладать противоположными спинами, чтобы не столкнуться в пространстве). Спин (от англ. "веретено") – движение ē вокруг собственной оси. Когда 2 электрона на 1 орбитали подходят слишком близко друг к другу, они начинают вращаться в противоположные стороны Þ возникает у каждого электрона магнитное поле (вспомните-ка явление электромагнитной индукции). Но магнитные поля 2 спаренных электронов противоположно направлены (см. стрелочки на рис.№67) Þ электроны наоборот, будут расталкиваться в пространстве
Когда 2 электрона на 1 орбитали подходят слишком близко друг к другу, они начинают вращаться в противоположные стороны Þ возникает у каждого электрона магнитное поле (вспомните-ка явление электромагнитной индукции). Но магнитные поля 2 спаренных электронов противоположно направлены (см. стрелочки на рис.№67) Þ электроны наоборот, будут расталкиваться в пространстве


 Строим ячейки и считаем: 1s-п/Ур (1 орбиталь Þ 1 ячейка); 2s-п/Ур (1 орбиталь Þ 1 ячейка); 2р-п/Ур (3 орбитали Þ 3 ячейки). Для удобства рекомендую все ячейки одного слоя рисовать на одном уровне (хотя в литературе и на сайтах подуровни тоже могут различаться по величине энергии, т.е. "лесенка" будет более сложной). Вот получится такая заготовка:
Строим ячейки и считаем: 1s-п/Ур (1 орбиталь Þ 1 ячейка); 2s-п/Ур (1 орбиталь Þ 1 ячейка); 2р-п/Ур (3 орбитали Þ 3 ячейки). Для удобства рекомендую все ячейки одного слоя рисовать на одном уровне (хотя в литературе и на сайтах подуровни тоже могут различаться по величине энергии, т.е. "лесенка" будет более сложной). Вот получится такая заготовка:









 Посмотрите еще на иллюстрации квантовых ячеек атомов:
Посмотрите еще на иллюстрации квантовых ячеек атомов:


