Общеизвестно кардинальное значение процессов адренергической медиации в регуляции кровообращения, психо-эмоционального состояния, адаптации организма к стресс-воздействиям и в контроле других функций в норме и при патологии. Важное биологическое значение катехоламинергических механизмов подчеркивается диффузным распространением норадреналин- и адреналинсодержащих структур на супрасегментарном и сегментарном уровнях мозга, высоким уровнем катехоламинов, ферментов их синтеза и деградации в ЦНС и во всех периферических тканях. Учитывая наличие обширного литературного материала, касающегося общебиологической роли адреналина и норадреналина, в настоящем разделе сконцентрированы современные данные, позволяющие с позиций морфофункциональной и рецепторной организации адренергической системы подойти к рассмотрению ее значения в регуляции болевой чувствительности и в медикаментозной аналгезии.
Практически весь норадреналин мозга концентрируется в нейронах латеральной области продолговатого мозга и моста (зоны A1-A7), т.е. в тех структурах ЦНС, раздражение которых вызывает стимуляционную аналгезию (рис.6). Выделяют две основные норадренергические системы — латеральную тегментальную и систему голубого пятна (Лиманский Ю.П., 1987; Langer S. et al., 1985; ReidJ.,1986).
Основными источниками латеральной тегментальной системы являются нейроны, локализованные в вентральной части продолговатого мозга (A1), в области ядра солитарного тракта (А3), в вентролатеральной (A5) и вентральной (А7) зонах мозга. Их аксоны восходят в составе вентрального корадренергического пути и медиального переднемозгового пучка, а в нисходящем направлении распространяются через ипсилатеральные канатики спинного мозга.
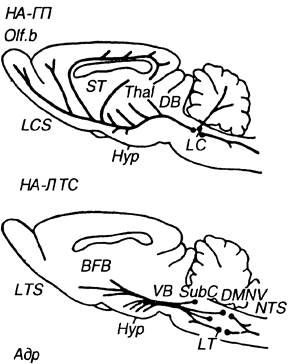
Рис. 6. Норадренергические пути мозга крысы (по Ю.П. Лиманскому, 1987). НА-ГП — норадренергическая система голубого пятна, НА-ЛТС — норадренергическая система латеральной тегментальной системы, BFB — основание переднего мозга, DB — дорсальный пучок, DMNV — дорсальное моторное ядро блуждающего нерва, Нургипоталамус, LC — голубое пятно, LCS — система голубого пятна, LT — латеральная покрышка, LTS — система латеральной покрышки, NTS — ядросолитар-ного тракта, SubC — субцеруальное ядро, Thal — таламус, VB — вентральный пучок.
Аксоны нейронов голубого пятна (зона А6) образуют три восходящих тракта, которые идут в составе дорсального катехоламинергического пучка, дорсального продолговатого пучка и медиального переднемозгового пучка. В нисходящем направлении аксоны нейронов голубого пятна проецируются через церулео-спинальный тракт, в формировании которого принимает участие и субцеруальное ядро. Волокна церулеоспинального тракта проходят через ствол мозга и далее через вентральные и вентролатеральные канатики — в спинной мозг.
Биохимически и анатомически показано, что поверхностные пластины спинного мозга имеют высокую плотность норадренергических терминалей, исходящих из катехоламиносодержащих ядер головного мозга (Hammond D., 1985; Westlund K. et al., 1983). Применение ауторадиографических и других методик (ретроградного транспорта пероксидазы хрена, иммуногистохимического определения дофамин-бета-гидроксилазы) позволило установить, что большинство норадренергических волокон нисходят в латеральных канатиках и оканчиваются преимущественно в желатинозной субстанции (II пластина) и в области моторных ядер (IV-VI пластины), т.е. в тех же зонах задних рогов спинного мозга, через которые первичные афференты передают ноцицептивные сигналы (Basbaum A. et al., 1987; Salon M. et al., 1983). Высокая концентрация норадреналинсодержащих аксональных пузырьков обнаружена также около интермедиолатерального клеточного столба на всем протяжении спинного мозга в области нейронов симпатического и парасимпатического отделов вегетативной нервной системы. Выявлено дискретное распространение нисходящих волокон: аксоны нейронов голубого пятна проецируются в сакральный отдел спинного мозга, из вентральной части продолговатого мозга — в грудной отдел (Stevens R. et al., 1982; Weslund К. et al., 1983). Распространяясь в поверхностных участках задних рогов спинного мозга нисходящие терминали образуют аксодендритные и, в меньшей степени, аксоаксональные контакты на тонких афферентных волокнах (Saton M. et al., 1983). Примечательно, что до сих пор нет четких данных об особенностях нисходящих проекций адреналин- и норадреналинсодержащих волокон.
Как уже упоминалось, в спинном мозге за восходящее распространение ноцицептивных сигналов отвечают три группы нейронов, однако конкретное участие адренергических систем в передаче болевых сигналов к структурам головного мозга практически не определено. На основании микроионофоретического анализа нейронов мезенцефалической ретикулярной формации крыс при механическом ноцицептивном раздражении, кожи задней лапы полагают, что вероятными медиаторами восходящего ноцицептивного потока в ретикулярной формации являются ацетилхолин и норадреналин (Haigler H., Spring D., 1981).
Следует подчеркнуть, что принципиально новый уровень понимания катехоламинергических механизмов был достигнут в середине XX века на основании гипотезы о существовании различных типов адренергических рецепторов — а- и бета-рецепторов, определяющих особенности реагирования разных органов на адренергические стимулы (Ahlguist R., 1948). Однако в дальнейшем вследствие накопления новых экспериментальных фактов и данных клинических наблюдений представление о гомогенных популяциях а- и бета-адренорецепторов подверглось существенной ревизии. В серии работ S. Langer (1978-1980) и других исследователей была выдвинута концепция о наличии в окончаниях норадренергических нервных волокон а-адренорецепторов, контролирующих по принципу отрицательной обратной связи выделение норадреналина в ЦНС и в периферических отделах нервной системы, и адреналина хромофинными клетками надпочечников (рис. 7). Был выявлен также механизм положительной обратной связи, функционирующей через Пресинаптические бета-адренорецепторы и способствующий высвобождению норадреналина при низкой частоте импульсации в симпатических нервах. Пресинаптические адренорецепторы стали рассматривать как один из основных механизмов "местной" регуляции адренергической передачи — регуляции высвобождения нейромедиатора самим нейромедиатором.
Пресинаптические или альфа2-адренорецепторы помимо норадренергических нервных окончаний присутствуют в тромбоцитах (их активация усиливает агрегацию тромбоцитов), почках (уменьшается секреция ренина), жировой ткани (угнетается липолиз), поджелудочной железе (тормозится секреция инсулина). Постсинаптические a1-адренорецепторы опосредуют возбуждающие реакции, они располагаются в печени (контролируют гликогенолиз), скелетной мускулатуре и матке (усиление сокращений), семявыносящем протоке (аналогичный эффект). В ЦНС и в гладкой мускулатуре сосудов выявлены а-адренорецепторы обоих типов, причем их активация сопровождается вазоконстрикцией (Adams H., 1983; Reid J., 1986). Ткани, лишенные симпатической иннервации (эритроциты, лимфоциты, мышцы матки, диафрагмы), содержат только бета-адренорецепторы. Особенности локализации разных а- адренорецепторов определяются их неодинаковой функциональной значимостью. Полагают, что через а2-рецепторы опосредуется прессорное действие экзогенных катехоламинов, через a1-рецепторы — аналогичный эффект симпатической стимуляции. Иными словами, a1-адренорецепторы это преимущественно внутрисинаптические рецепторы, они чувствительнее к норадреналину, выделяющемуся из симптических окончаний ("иннервированные" рецепторы), тогда как а2-адренорецепторы независимо от их синаптической или внесинаптической (в органах и тканях) локализации, чувствительнее к циркулирующим в крови катехоламинам ("гормональные" рецепторы) (Ariens E., Simonis A., 1983; Homey С., Graham R., 1985; Docherty J., Hyland L., 1985).
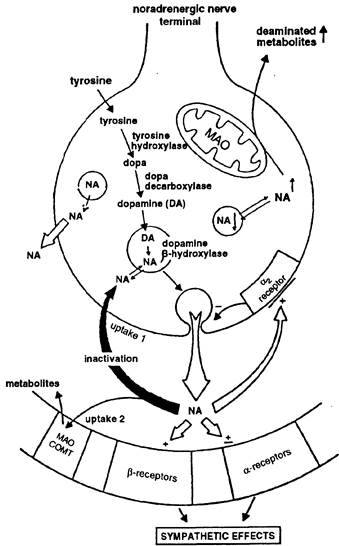
Рис. 7. Схема адренергического синапса (по M.Nial, 1989).
В пресинаптической терминали указаны этапы синтеза норадреналина из тирозина и локализация а2-адренорецепторов (ауторецепторов), контролирующих по принципу отрицательной обратной связи выделение медиатора; на постсинаптической мембране у казаны а- и бета-адренорецепторы (эффекторные рецепторы) и ферменты (МАО, СОМТ), инактивирующие норадреналин.
Идентификация а-адренорецепторов различных типов первично основывалась на их различной чувствительности к фармакологическим агонистам (табл. 2).
Наиболее избирательными агонистами a1-адренорецепторов являются метоксамин и мезатон, антагонистами — празозин, коринантин, лабеталол. Пресинаптические а2-адренорецепторы активируются клофелином и его аналогами, а-метилнорадреналином и блокируются раувольсцином, йохимбином и другими соединениями. Сами катехоламины не обладают отчетливой селективностью к определенному типу а-адренорецепторов (Adams Н., 1983; Byhmd D., 1988).
Таблица 2.
Агонисты и антагонисты а-адренорецепторов
| Агонисты
| Рецепторная селективность
| Антагонисты
|
| Метоксамин
Циразолин
Мезатон
|
а1
| Празозин
Коринантин
Лабеталол
|
| Адреналин Норадреналин
| альфа 1а2
| Феноксибензамин Фентоламин
Пипероксан
|
| Оксиметазолин Клофелин
Ксилазин
Гуанфацин Медетомидин
В-НТ 933
UK-14.304
|
альфа 2
| Толазолин
Йохимбин
Раувольсцин
Идазоксан
|
В первое время после разделения а-адренорецепторов на два типа и обозначения пресинаптических рецепторов как альфа2-рецепторов, термины "Пресинаптические" или «а1-адренорецепторы» рассматривались как синонимы. Однако еще в 1977 году S. Bentley и соавт. установили, что одна из популяций постсинаптическирх альфа-адренорецепторов сосудов активируется мезатоном и блокируется празозином, а другая группа рецепторов — активируется малыми дозами норадреналина, но не взаимодействует с альфа1-блокатором празозином. Кроме того, деструкция норадренергических терминалей после внутрижелудочкового введения 6-гидроксидофамина не изменяет связывание селективных агонистов как с альфа1-, так и альфа2-рецепторами (Sagen J., Proudfit H., 1984). Эти и многие другие факты показали, что рецепторы, обладающие свойствами, присущими альфа2-рецепторам, могут локализоваться и постсинаптически в ЦНС и ее периферических отделах, а также в тромбоцитах, почках, жировой ткани, поджелудочной железе, гладкой мускулатуре вен. Примечательно, что йохимбин одинаково активно блокирует пре- и постсинаптические альфа2-адренорецепторы (Docherty J., Hyland L., 1985), однако были созданы и высокоспецифичные антагонисты а2 -постсинаптических рецепторов, например, SKF 104078. В ЦНС максимальное содержание этих рецепторов установлено в лимбических и бульбарных структурах, их несколько меньше в других отделах головного мозга и в спинном мозге (Louis W. et al., 1982). На примере аорты крыс показано, что в периферических органах преобладают альфа1-рецепторы и лишь около 20% приходится на празозиннечувствительные альфа2-адренорецепторы (DeckerN. et al., 1984).
Таким образом, постсинаптические адренорецепторы являются смешанной популяцией альфа1- и альфа2-рецепторов, причем их возбуждение вызывает однотипный симпатомиметический эффект, например, вазоконстрикцию, но за счет разных механизмов кальциевого сопряжения актомиозинового комплекса (Exton J., 1985; Timmermans P. et al., 1987; Insel P., 1989). Начальным биохимическим процессом, связанным с активацией a1-рецепторов, является возбуждение фосфолипазы С через промежуточный протеин G и гидролиз фосфатидилинозитол-4,5-дифосфата мембраны с образованием двух внутриклеточных передатчиков — миоинозитол-1,4,5-трифосфата и 1,2-диацилглицерина (рис. 8). Первый стимулирует высвобождение Са++ из эндо- и саркоплазматического ретикулума, вызывая быстрый подъем его уровня в цитозоле, активацию протеинкиназы С и образование комплексов с регуляторным белком кальмодулином. Этот комплекс взаимодействует со специфическими и мультифункциональными кальмодулин-зависимыми протеинкиназами и протеинами, которые, изменяя свою активность, ведут к различным физиологическим эффектам. Другой внутриклеточный передатчик — 1,2-диацилглицерин — активирует Са-фосфолипидзависимую протеинкиназу, которая фосфорилирует и изменяет функциональное состояние клеточных белков. Между обоими внутриклеточными передатчиками отмечается синергизм.

Рис. 8. Схема внутриклеточных процессов, связанных с активацией a1— и бета-адренорецепторов (А) и а- адренорецепторов (Б) (по J. Exton, 1992). IN — ингибирующий гуаниновые нуклеотиды белок, SN — стимулирующий гуаниновые нуклеотиды белок, Ad Cycl — аденилатциклаза, R — регулирующий димер цАМФ-зависимой протеинкиназы, PI — фосфа-тидилинозитол, DAG — 1,2 — диацилглицерол, ICP — инозитов 1,2-циклофосфат, Х — гипотетический фермент, сопряженный с.а\- адренорецептором, М — гипотетический внутриклеточный мессенд-жер, реализующий активацию X, СаМ — кальмодулин, Са2+ — СаМ-протеинкиназа.
Возбужденные альфа2-адренорецепторы образуют комплексы с тормозными, связывающими протеины, гуаниновыми нуклеотидами (Gi). Функция этих нуклеотидов заключается в передаче внеклеточных сигналов к вторичным мессенджерам (посредникам), в частности, аденилатциклазе, и они отличаются от ГТФ-содержащих белков, обусловливающих передачу возбуждения через бета-рецепторы (Gs). В результате тормозится каталитический участок аденилатциклазы, снижается внутриклеточный уровень цАМФ, что приводит к входу внеклеточного Са и нарастанию его концентрации внутри клетки. Связь альфа2-рецепторных ответов именно с внеклеточным Са подтверждается тем, что сосудосуживающий эффект избирательных агонистов этих рецепторов (ксилазина, ВНТ 920 и других) ослабляется блокаторами медленных кальциевых каналов (Zwieten P., Timmermans P., 1987).
Разные механизмы, приводящие в итоге к одному биохимическому сдвигу — повышению содержания в клетках ионизированного кальция, обусловливают неодинаковую функциональную значимость процессов, запускаемых через разные типы постсинаптических адренорецепторов. Ответы, опосредуемые через а1- рецепторы, возникают быстро, но протекают непродолжительно при коротких стимулах, например, "пачках" нервных импульсов или быстром болюсном введении адренопозитивных соединений, они лучше проявляются в условиях ацидоза. Реакции на активацию альфа2-рецепторов постсинаптических мембран развиваются медленнее, однако дольше сохраняются и характеризуют функциональные сдвиги на такие длительные стимулы, как циркулирующие в крови эндогенные катехоламины.
ЗАКЛАДКА
Следует подчеркнуть, что симпатомиметический эффект развивается также при блокаде пресинаптических альфа2-адренорецепторов йохимбином и другими селективными антагонистами, которые увеличивают продолжительность выхода К из нервных окончаний и, удлиняя таким образом их деполяризацию, стимулируют спонтанное и индуцированное высвобождение норадреналина (Kalsnez S., Quinlan M., 1984). Так, подсчитано, что йохимбин на 60% повышает выделение норадреналина из пресинаптических терминалей в спинном мозге. Считают, что пресинаптические и постсинаптические ^-рецепторы отличаются по характеру по-стрецепторных процессов и у первых они не связаны с G -белками (Scheinin M„ MacDonald E., 1989).
Ряд новых фактов, полученных в последние годы, явились основой для дальнейшего подразделения а -адренорецепторов на подтипы, или изорецепторы. Было показано, что центральное симпатолитические действие празозина, который в 10000 -100000 раз селективнее к (^-рецепторам, реализуется не в результате их блокады, а при посредстве «г-рецепторов, поскольку это действие значительно ослабляется йохимбином (Ito Т. et al., 1988). В ряде тестов у одних и тех же лабораторных животных активность йохимбина как антагониста ад-рецепторов различалась на два порядка, что свидетельствовало о недостаточности подразделения а-адренорецепторов только на два типа (Goldberg М., Robertson D., 1983). Обнаружена отчетливая видоспецифичность в чувствительности «г-рецепторов к фармакологическим веществам, в частности, их высокий аффинитет к празозину у грызунов и низкий — у собак, быков и у людей (Bylund D., 1988).
В настоящее время доказывается существование следующих подтипов, или изорецепторов: «in-, (Xw-, и а гд-, о;2в-, «2с— и «2D-pe-цепторов (Bylund D., 1988; Bousquet Р. et al., 1989; Нап С. et al., 1990). Альфа iA-рецепторы в 20-1500 раз более чувствительны к фентоламину и WB-4101, чем «ш-рецепторы, их возбуждение способствует входу внеклеточного Са через дигидропиридинчувст-вительные каналы мембран. Реакции на возбуждение «щ-рецеп-торов опосредуются через инозитфосфолипиды, т.е. мобилизацию из депо внутриклеточного Са, и эти реакции сильно инактиви-руются хлорэтилклонидином. Обнаружено, что у крыс в аорте преобладают а^-рецепторы, в почечной артерии — «iA-рецепто-ры, в мезентериальной артерии и в портальной вене равно представлены оба изорецептора.
Альфагд-рецепторы имеют низкое сродство к празозину, но высокую чувствительность к агонисту оксиметазолину, они локализуются в поджелудочной железе крысы и в тромбоцитах человека. Празозин является избирательным антагонистом «гв-рецепто-ров, которые преобладают в легких и, наряду с а^ -рецептора ми, в корковом слое почек у новорожденных крыс. Альфагс-рецепторы присутствуют в клетках почек опоссума, они высокочувствительны к йохимбину и другим «-адренолитикам. Локализацией «2D-pe-цепторов, а также других й-изорецепторов считают мозг грызунов (Insel Р., 1989; Younq P. et al., 1989). Учитывая, что основными средствами фармакологического анализа гетерогенности адрено-рецепторов остаются празозин и йохимбин, иногда используется упрощенное подразделение а-рецепторов на "йохимбиннечувствительные" и "празозинчувствительные", что соответствет аг\- и амгизорецепторам.
В настоящее время клонированы гены и ДНК для всех известных адренорецепторов, осуществлена их очистка (Сагоп М. et al., 1989; Lefkowitz R., 1990). Выделенные адренорецепторы представлены трансмембранными белками, которые имеют молекулярную массу 64000-80000 и содержат от 413 до 515 аминокислот. Последовательность аминокислот сходна не только у разных типов адренорецепторов, но и у зрительного рецептора и М-холинорецепто-ра: все они состоят из семи доменов, пронизывающих клеточную мембрану.
Приведенная классификация изорецепторов, на наш взгляд, должна рассматриваться как гипотетическая, нуждающаяся в доказательствах и уточнениях, прежде всего с помощью фармакологических средств направленного действия. Определенные успехи в этом плане уже достигнуты, и получены избирательные антагонисты «гд-рецепторов, например, дигидроизоиндолметилимида-золины, и а2в-рецепторов — морфантридин, имилоксан. Кроме того, собственно вероятность существования изорецепторов, их видо- и органоспецифичность и функциональную гетерогенность следует, по возможности, учитывать при интерпретации нейро-фармакологических данных. В то же время, реальное и, в первую очередь, клиническое значение на современном уровне понимания адренергических процессов имеет подразделение адренорецепторов на два "базовых" типа — а\- и ад-рецепторы. По крайней мере в регуляции боли именно а2-адренорецепторы и инициируемые ими механизмы играют ведущую роль.
В настоящее время общее число фармакологических соединений, у которых выявлено центральное адренопозитивное действие, насчитывает более 100 представителей, из них около 10 используются в виде лекарственных препаратов в медицине или ветеринарии. Единой классификации адренопозитивных веществ не существует, среди многих из них наиболее обоснованной представляется классификация, предложенная W. Kobinger в 1986 г. Согласно этой классификации, с небольшими собственными и литературными дополнениями (Zonnenscheim R. et al., 1990), выделяют дериваты следующих химических групп: 1) Фенилэтилами-ны (норадреналин, адреналин, метилдофа); 2) имидазолины (кло-фелин, лофексидин, детомидин и многие другие); 3) ксилазины (ксилазин и ряд "номерных" соединений); 4) гуанидины. (гуана. бенз. гуанфацин и некоторые другие); 5) азепины (азепексол (ВНТ 933), ВНТ 920 и ряд других соединений, объединенных аббревиатурой ВНТ).
Независимо от химического строения представленные выше соединения объединяет такое общее свойство, как высокая липоидотропность, обусловливающая их хорошее проникновение в мозг и стимулирующее воздействие на адренорецепторы ЦНС. Исключение составляют норадреналин и адреналин, которые, как известно, при обычных (системных) способах введения практически не проходят через гематоэнцефалический барьер. Кроме того, подобное заданное свойство, присуще некоторым синтетическим производным, например, имидазолинам — оксиметазолину, нафазолину, St-91, использующимся в нейрофармакологических экспериментах при сравнительном анализе периферических и центральных адренергических механизмов.
По аффинности к разным типам центральных а-адренергиче-ских рецепторов рассматриваемые соединения существенно различаются (табл. 2). Так, сами катехоламины — норадреналин и адреналин — обладают одинаковым сродством к «i- и <з;2-адреноре-цепторам. Для таких соединений, как циразолин, метоксамин, мезатон характерна преимущественно ai-агонистическая активность; селективность к о:2-адренорецепторам выражена у клофели-на, ксилазина, гуанабенза, гуанфацина и некоторых других веществ. Большинство производных азепина, а также детомидин и его дериваты обладают еще большей избирательностью к оса-рецепторам и их нередко называют "суперселективными" «г-агонистами.
Эффекты, возникающие при фармакологической активации центральных адренореактивных структур, весьма многообразны и, они отражают важное биологическое значение адренергической нейромедиации в контроле физиологических функций в норме и при патологии. Общеизвестна ключевая роль этих структур в регуляции сердечно-сосудистой и эндокринной систем, психо-эмо-циональной сферы и высшей нервной деятельности, уже не вызывает сомнения их самостоятельное участие и взаимодействие с другими нейромедиаторными системами формирования боли и аналгезии. Области практического применения и широта использования отдельных представителей каждой из групп адренопозитивных соединений различны, эти данные суммированы в ряде обзоров и монографий (подробнее см.: Scheinin M., MacDonald E., 1989; Samples J., 1989; Weber M. et al„ 1990; Zwieten P., 1988; MacdonaldE.etal.,1988).
Анализируя эти данные, можно констатировать, что среди разных химических соединений, обладающих центральным адрено-позитивным эффектом, наибольшее практическое применение получили производные имидазолина, особенно их "эталонный" представитель клофелин. Клофелин — это международное название соединения 2-(2,6-дихлорфениламина) имидазолина гидрохлорид, его наиболее распространенные синонимы: катапресан, клонидин, гемитон. Несмотря на их апробацию в разных областях клинической медицины, в том числе в анестезиологии, имидазо-лины и гуанидины используются главным образом как сердечнососудистые средства, что отражает устоявшиеся представления о ведущей роли адренергических механизмов в регуляции кровообращения.
До последних лет основные фармакодинамические эффекты клофелиноподобных препаратов объясняли с позиций их избирательного взаимодействия с пресинаптическими о^-адренорецепто-рами, локализующимися в различных отделах головного и спинного мозга, но прежде всего — в ростральной части вентролате-рального отдела продолговатого мозга. Считалось доказанным, что антигипертензивное действие представителей так называемой первой генерации препаратов — клофелина и метилдофа — обусловлено снижением высвобождения норадреналина из пресинап-тических окончаний и генерализованным ослаблением активности в вазомоторных, сердечных и других симпатических нервах. Допускалось также их воздействие на центральные постсинапти-ческие «-рецепторы, приводящие к активации тормозных бульбо-спинальных нейронов. Однако, по данным экспериментов на крысах, соотношение доз клофелина, воздействующих на «г-преси-наптические и о:2-постсинаптические рецепторы, составляет 1:19, а соотношение «-пресинаптические / a i- рецепторы — примерно 1:220 (Docherty J., 1983). Иными словами, при введении клофелина в "антигипертензивных дозах" он влияет преимущественно на центральные «г-пресинаптические рецепторы и только при создании его высоких концентраций в крови и на а-адренорецепторы других типов.
В настоящее время установлено, что помимо норадреналина в ограниченном количестве дискретно расположенных нейронов в нижней части ствола мозга имеется и адреналин (Ward-Routladge С., Marsden С., 1988). Предполагается, что клофелино-подобные средства снижают артериальное давление также за счет угнетения функции этих адреналинсодержащих нейронов, активация которых сопровождается гипертензией.
Представления о рецепторном механизме действия клофелина и его аналогов определили основное направление поиска новых центральных антигипертензивных средств, заключающееся в модификации имидазольного кольца или структуры гуанидина с целью получения еще более селективных «г-адреномиметических соединений. В 70-х годах были синтезированы дериваты гуанидина, из которых гуанабенз и, особенно, гуанфацин вошли в клиническую практику в качестве антигипертензивных препаратов. Их аффинность к центральным пресинаптическим «-рецепторам выше, чем у клофелина, примерно в 10 раз, а соотношение избирательности a2/ai — в 25 раз (Seedat Y., 1985). В то же время по антигипертензивной активности они не превосходят клофелин и почти в полном объеме сохраняют его основные негативные эффекты — седативный, антисекреторный и другие. Более того, даже такое соединение, как дексмедетомидин, у которого соотношение «2/«1-рецепторного действия составляет 1:1620, принципиально не отличается по фармакологической активности от клофелина. Эти данные поставили под сомнение представление о ведущей роли пресинаптических «г-рецепторов в регуляции артериального давления и эффекте центральных антигипертензивных средств.
В конце 80-х годов появились первые данные, показывающие, что в препаратах мембран клеток продолговатого мозга разных млекопитающих клофелин и гуанидины активно взаимодействуют не только с «г-адренорецепторами, но и другими участками связывания, которые отличаются от "классических" адренорецеп-торов по локализации и биохимическим свойствам (Meeley M. et а1., 1988; Michel M„ Insel P., 1989; Zonnenscheim R. et al., 1990). Причем эти факты не удалось объяснить с позиций низко- и высо-коаффинных о'2-рецепторов, установленных ранее для адренерги-ческих агонистов и антагонистов (Asakura M. et al., 1984). Было установлено, что фенилэтиламины (норадреналин, адреналин) действуют только на адренергические рецепторы мозга и при их микроинъекциях в вентролатеральные ядра ретикулярной формации артериальное давление не изменяется, тогда как при таком же введении клофелина развивается гипотензия. Из этих ядер были получены препараты мембран клеток, в которых клофелин и норадреналин в 100% случаев имели разные участки связывания. С помощью специально созданных антител к имидазолиновым соединениям идентифицировали так называемую клофелинвытесня-ющую субстанцию (КВС), угнетающую связывание [Н ]-клофе-лина и [Н 1-йохимбина с клеточными мембранами. Эта КВС представляет собой низкомолекулярное вещество некатехоламинового непептидного строения и предположительно рассматривается в качестве эндогенного лиганда (эндазолина) имидазолин-гуаниди-новых мест связывания. Между клофелином и КВС выявлено много общего: они наиболее аффинны к имидазолиновым участкам связывания в вентролатеральном отделе продолговатого мозга, оба с одинаковой разницей взаимодействует с высоко- и низкоаффинными Ог-адренорецепторами, имеют одинаково низкую аффинность к oi-рецепторам. Однако полной идентичности между КВС и клофелином нет, поскольку селективность КВС к имидазолиновым местам связывания по крайней мере в 30 раз выше, чем к а-адренорецепторам. Было высказано предположение, что именно имидазолиновые участки мембран нейронов являются тем рецеп-торным субстратом, через который реализуется антигипертензив-ное действие клофелин- и гуанфацинподобных соединений (Emsberg Р. et al., 1988; Bousquet P. et al., 1989).
Веские доказательства в пользу этой гипотезы были получены после создания и изучения ряда новых производных имидазолина, в частности, моксонидина и рилменидина, которые обладают выраженной антигипертензивной активностью, но слабым седатив-ным и другими центральными побочными эффектами, присущими клофелину (Genissel P. et al., 1988; MontastrucJ. et al., 1989). По мнению Р. ErnsbergerHcoaBT., (1992), эти соединения дали начало новой, "второй" генерации центральных адренопозитивных средств, отличающихся меньшей аффинностью к о^-рецепторам. Так, сродство моксонидина к этим рецепторам по меньшей мере в 40 раз ниже, чем к имидазолиновым участкам связывания, или, по терминологии авторов,— к имидазолиновым рецепторам 1-го типа (Игрецепторам). В настоящее время постулируется существование Иг и Иг-рецепторов, специфичных, соответственно, для клофелина и идазоксана (Ernsberger P. et al., 1992; Miralles L. et al., 1993). Более детально изучены Игрецепторы. Они идентифицированы в продолговатом мозге быков, крыс и людей, а также в периферических тканях — почках крыс, хромаффинных клетках надпочечников быков, каротидных тельцах кошек и кроликов и в тромбоцитах человека. Их считают функционально активными и, вероятно, нейроналвными рецепторами, т.к. они отсутствуют в первичной культуре глии. Установлено, что И-рецепторы не являются разновидностью «-адренорецепторов. Моксонидин, наряду с Игрецепторами и независимо от них, взаимодействует и с а-изо-рецепторами, причем его высокое сродство к Игрецепторам не изменяется в препаратах мембран хромаффинных клеток надпочечников быков, не содержащих «г-адренорецепторы (Requnathan S. et al., 1991). Из этих клеток И-рецепторы выделены в чистом виде, они представляют собой белки с молекулярным весом 70000D (Wand H. et al., 1992), причем они не связаны с "классическими" G-белками.
Суммируя существующие представления об И-рецепторах, можно заключить, что эти рецепторы имеют собственную "топографию" в мозге и почках млекопитающих, оригинальные механизмы трансдукции нервных сигналов, уникальный лигандсвязы-вающий профиль (их специфический радиолиганд — идазоксан) и, вероятно, присущие только им молекулярно-генетические механизмы формирования. С центральными и периферическими Иг рецепторами активно взаимодействует КВС, и именно с ними связывают депрессорное действие имидазолинов в вентролатеральной области продолговатого мозга. Сравнение четырех дериватов ими-дазолина (клофелина, лофексидина, рилменидина и моксониди-на) со сходными химическими свойствами (липоидотропностью, константной диссоциации) и фармакокинетическими пераметра-ми показало отчетливую корреляцию между их аффинитетом к Игрецепторам и антигипертензивным эффектом в клинике, но не выявило подобный корреляции в отношении центральных «г-адре-норецепторов. Примечательно, что и гуанфацин характеризуется высоким сродством к «г-рецепторам, но не к И-рецепторам (LachaudV.etaL, 1989).
При сопоставлении данных радиолигандных исследований ре-цепторного связывания дериватов имидазолина и гуанидина видно, что соотношение концентраций, в которых вещество равноаффинно связывается с аг- и Игучастками мембран клеток продолговатого мозга, составляет для клофелина 3,8 (3,8/1,0 нМ), для моксонидина — 32,6 (75,0/2,3 нМ), а для гуанфацина — 0,0009 (2 3/2500,0 нМ). Несмотря на эти кардинальные отличия в рецеп-торном действии, клофелин и гуанфацин вполне сопоставимы по клинической эффективности при эссенциальной гипертензии у человека, и их разовые дозы для энтерального приема — 0,15 мг и 1 мг соответственно — весьма близки (Satar M., 1989; Weber M. et al., 1990). Поэтому пока нет серьезных аргументов против той точки зрения, что хотя Иг и «з-рецепторы это разные участки связывания, они могут определять сходные фармакологические эффекты, например, антигипертензивный, вследствие общего биохимического триггера (Zonnenschein R. et al., 1990).
Работы последних лет существенно расширили представления о механизмах боли и аналгезии, организации и иерархии ее ведущих нейрофизиологических звеньев, ключевых нейромедиатор-ных процессах и их рецепторной организации. Не вызывает сомнений, что регуляция боли является полинейрохимическим процессом, причем ведущая роль принадлежит опиоидергической системе, функциональная гетерогенность рецепторов которой легла в основу создания новых аналгетиков — агонистов-антагонистов опиатных рецепторов. Такие препараты, как налбуфин, буторфа-нол, бупренорфин превосходят традиционные морфиноподобные аналгетики по эффективности, в меньшей степени нарушают функцию дыхания, но, как и последние, обладают высоким наркоген-ным потенциалом и практически не нормализуют гемодинамику при боли. С этой точки зрения, привлекает внимание положение о полинейрохимизме боли и аналгезии, получающее все более веские подтверждения в связи с созданием селективных агонистов ГАМК, серотониновых и адренергических рецепторов. Наибольший интерес среди альтернативных нейромедиаторных систем регуляции боли представляет адренергическая система. С одной стороны, доказана ее важная роль в опиатной аналгезии и более того — самостоятельное значение в контроле ноцицепции на разных уровнях ЦНС. С другой стороны, фармакология располагает определенным набором высокоэффективных агонистов и антагонистов адренорецепторов, использующихся в качестве лекарственных препаратов. К сожалению, до сих пор адренергическая система рассматривается преимущественно как ведущая система регуляции кровообращения в норме и при многих патологических состояниях. Именно с этих позиций оцениваются современны» данные о наличии пре- и постсинаптических а-адренорецепторов их изорецепторах и их функциональных особенностях. В то ^ время становящаяся очевидной функциональная гетерогенность адренергических рецепторов показывает возможность разработки нового фундаментального положения об адренергической регуляции боли и гемодинамики при боли, создания принципиально новых болеутоляющих средств с заданным спектром действия щ определенные адренергические рецепторы, лишенных серьезных медицинских и социальных нежелательных эффектов, присущие опиоидам.
ГЛАВА II.
БОЛЕУТОЛЯЮЩЕЕ ДЕЙСТВИЕ АДРЕНОПОЗИВНЫХ СРЕДСТВ
2.1. Модуляция болевой чувствительности веществами, изменяющими адренергическую нейромедиацию
Еще в 1904 г. в исследованиях Н. Weber было показано, что аппликация адреналина на поверхность спинного мозга угнетала обусловленную термическими стимулами реакцию избегания у кошек. Позднее было подтверждено, что фенамин и другие симпа-томиметические вещества при системном введении животным и людям оказывают болеутоляющее действие (Burrill D. et al., 1944; Paalzow L., 1974), а в экспериментах установлено аналгетическое действие адреналина при микроинъекциях под оболочки спинного мозга (Priddle Н„ Andros G., 1950).
Выявление аналгетического эффекта у клофелина ознаменовало собой новый этап в развитии проблемы неопиатной лекарственной аналгезии. С конца 70-х годов и до настоящего времени проводится интенсивное изучение болеутоляющей активности и механизмов действия клофелина и клофелиноподобных соединений, получивших широкое признание в клинике в качестве анти-гипертензивных средств. Обезболивающее влияние клофелина при различных, в том числе системных способах введения, выявление у мышей (LipmanJ., Spencer P., 1979; SkingleM. et al, 1982), крыс (Хван А.А., 1987; Fielding S. et al., 1981; Hylden J. et al., 1991), кошек (Богданов Е.Г., 1987; Ossipov M. et al., 1982; Yasuoka S., Yaksh T„ 1983), собак









