Реакции обмена в растворах электролитов протекают до конца если образуются: осадки, газы, слабые электролиты, комплексные ионы.
При этом сильные электролиты записываются в виде ионов, слабые в виде молекул. К сильным электролитам относятся:
-основания, растворимые в воде (кроме NH4OH);
-сильные кислоты (H2SO4, HCI, HCIО4, HNO3 и др.);
-соли, растворимые в воде.
Например:
1. Реакции с образованием осадков
3СаС12 + 2К3РО4 = Са3(РО4)2 ↓ +6НС1,
3Са2+ + 2РO43- = Са3(РO4)2↓
При записи ионов первым записывается катион.
2. Реакции с выделением газов:
СаS + H2SO4 = CаSO4 + H2S ↑,
CаS + 2H+ = Cа2+ + H2S ↑,
3. Реакция, протекающие с образованием слабого электролита:
H2SO4 + 2NaOH = Na2 SO4 + 2H2О,
Н+ + ОН- = Н2О,
4. Реакция, протекающие с образованием комплексных ионов:
Zn(OH)2 + 2NaOH = Na2 [Zn(OH)4]
Zn(OH)2 + 2 OH- = [Zn(OH)4] 2-.
В тех случаях, когда малорастворимые вещества (или слабые электролиты) имеются как среди исходных веществ, так и среди продуктов реакции, равновесие смещается в сторону образования наименее растворимых или наименее диссоциированных веществ. Например, при нейтрализации слабой кислоты сильным основанием
CH3COOH + NaOH Û CH3COONa + H2O
CH3COOH + OH– Û CH3COO– + H2O.
в реакции участвуют два слабых электролита – слабая кислота (CH3COOH) и вода. При этом равновесие смещается в сторону образования более слабого электролита – воды, константа диссоциации которой (1,8 . 10–16) значительно меньше константы диссоциации уксусной кислоты (1,8 . 10–5). Однако до конца такая реакция протекать не будет: в растворе останется небольшое количество недиссоциированных молекул CH3COOH и ионов OH–, так что реакция раствора будет не нейтральной (как при нейтрализации сильной кислоты сильным основанием), а слабощелочной.
Аналогично при нейтрализации слабого основания сильной кислотой
2HNO3 + Mg(OH)2 ® Mg(NO3)2 + 2H2O
равновесие будет сильно смещено вправо – в сторону образования более слабого электролита (воды), но при достижении равновесия в растворе останется небольшое количество недиссоциированных молекул основания и ионов Н+; реакция раствора будет слабокислой.
ГИДРОЛИЗ СОЛЕЙ
Вода - слабый электролит и диссоциирует по уравнению:
Н2О 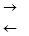 H+ + OH-
H+ + OH-
Произведение концентрации ионов водорода и ионов гидроксила на-зывается ионным произведением воды. Это величина постоянная при постоянной температуре:
[Н+] [ОН-] = 10-14 моль/л,
[Н+] = [ОН-] = 10-7 моль/л,
отсюда:
[Н+] = 10-7 моль/л - среда нейтральная,
[Н+] > 10-7 моль/л - среда кислая,
[Н+] < 10-7 моль/л - среда щелочная.
Отрицательный десятичный логарифм концентрации ионов водорода называется водородным показателем:
pН = - lg [Н+]
Тогда рН различных растворов будет иметь следующие значения: кислого рН < 7, нейтрального рН = 7, щелочного рН > 7.
Гидролизом с оли называется взаимодействие ионов растворенной соли с ионами воды, сопровождающееся изменением рН раствора. Гидролиз может происходить только тогда, когда из ионов соли и ионов воды образуются малодиссоциирующие вещества. .
1. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются.
NaCl + H2O 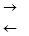
2. Гидролиз солей, образованных сильной кислотой и слабым основанием, протекает по катиону с образованием основных солей.
FeCl3 + Н2О 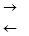 FeOHCl2 + НС1,
FeOHCl2 + НС1,
Fe3+ + НОН 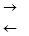 (FeOH)2+ + H+ (pH < 7),
(FeOH)2+ + H+ (pH < 7),
3. Гидролиз солей, образованных сильным основанием и слабой кислотой, протекает по аниону с образованием кислых солей.
Na2CO3 + Н2О 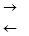 NaHCO3 + NaOH,
NaHCO3 + NaOH,
СО32- + НОН 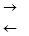 НСО3- + ОН- (рН > 7).
НСО3- + ОН- (рН > 7).
4. Соли, образованные слабым основанием и слабыми кислотами, подвергаются полному гидролизу.
2AlCl3 + 3Na2S + 6Н2О = 2Al(OH)3↓ + 3H2S ↑ + 6NaCl,
2Al 3+ + 3S2- + 6Н2О = 2Al(OH)3↓ + 3H2S ↑.



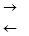 H+ + OH-
H+ + OH-


