

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Интересное:
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
| Возраст | Средняя СКФ±SD |
| 1 неделя (мальчики и девочки) | 41±15 |
| 2-8 недель (мальчики и девочки) | 66±25 |
| > 8 недель (мальчики и девочки) | 96±22 |
| 2-12 лет (мальчики и девочки) | 133±27 |
| 13-21 год (юноши) | 140±30 |
| 13-21 год (девушки) | 126±22 |
National Kidney Foundation (2002) Clinical practice guidelines for chronic kidney disease: evaluation, classification and stratification. K/DOQI clinical practice guidelines. Am J Kidney Dis 39:S1–S266
Распространенность ХБП в детстве. Большинство существующих данных относительно эпидемиологии ХБП у детей концентрируются на поздних стадиях почечной дисфункции, тогда как популяционные исследования отсутствуют. Некоторые методологически хорошо разработанные регистры по ХБП в детском возрасте ограничиваются небольшими популяциями. Наконец, прямые сравнения частоты и распространенности ХБП в детстве в различных географических областях мира трудны из-за методологических различий в изучаемых возрастных группах, характеристиках степени почечной недостаточности и классификации болезни.
В Италии (ItalKid Project) в среднем регистрируется 12,1 новых случаев ХБП 2-4 стадии (СКФ<75мл/мин/1,73м²) в год на миллион детского населения, с распространенностью 74,7/млн среди детей моложе 20 лет. В Швеции частота выявления ХБП 4-5 стадии (СКФ<30мл/мин/1,73м²) у детей от 6 месяцев до 16 лет составила в среднем 7,7 на 1 млн, распространенность - 21 на 1 млн детского населения. Аналогичные данные получены во Франции: 7,5 и 29,4-54 среди детей моложе 16 лет. В Латинской Америке, по данным Чилийского обзора, заболеваемость и распространенность составляют 5,7 и 42,5 на 1 млн лиц до 18 лет с СКФ<30мл/мин/1,73м², включая пациентов с тХПН. Во всех доступных регистрах (2-5 стадии ХБП) отмечается преобладание пациентов мужского пола. Две трети пациентов в регистре NAPRTCS и в базе данных ItalKid Project - мужчины. Это распределение отражает более высокую частоту врожденных пороков мочевой системы у мальчиков, включая обструктивную уропатию, почечную дисплазию и синдром prune belly.
|
|
По данным регистра EDTA (Европейской Ассоциации диализа и трансплантации), ежегодная заболеваемость тХПН в Европе составляла 7,1 в 1980-84 гг. и 9,9 на 1 млн детей в последующие 15 лет. В то время как, распространенность пациентов, получающих ЗПТ, увеличилась с 22,9 в 1980 до 62,1/млн. в 2000 году, что связано, в первую очередь, с увеличением долгосрочной выживаемости больных.
Заболеваемость тХПН зависит от возраста: среди детей 15-19 лет она вдвое выше, чем в возрастной группе 10-14 лет и почти в 3 раза выше, чем среди детей 0-5 лет. Исключением является возрастная группа 0-4-лет в Финляндии, где высокая ежегодная заболеваемость (15,5 на 1 млн. детей этого возраста) обусловлена большим количеством младенцев с врожденным нефротическим синдромом.
В России на 2005 году зарегистрировано 451 детей на ЗПТ или 18,8 на 1 млн детского населения. Такая распространенность тХПН среди детей отражает не низкую заболеваемость, а проблемы с обеспечением детей ЗПТ.
Хотя педиатрические пациенты с тХПН составляют лишь малую часть от общего числа больных с уремией, они предъявляют высокие требования к системе здравоохранения в связи с необходимостью не только коррекции первичных почечных нарушений, но и обеспечения нормального роста, развития и социальной адаптации.
Учитывая высокую степень инвалидизации и снижение качества жизни, сложность и высокую стоимость терапии тХПН, весьма актуальным является предотвращение ее развития у детей с нефропатиями.
Этиология ХБП. В отличие от взрослых, у которых преобладающими причинами ХБП являются сахарный диабет и артериальная гипертензия для детского возраста характерны врожденные заболевания. В развитых странах именно врожденная патология - наиболее частая причина ХБП. В развивающихся странах ХБП диагностируется на более поздних сроках и преобладают инфекционные и другие причины нефропатий.
|
|
По данным регистра NAPRTCS. (North American Pediatric Renal Transplant Cooperative Study), почти половину случаев ХБП составляют пациенты с диагнозами: обструктивная уропатия (22%), аплазия/гипоплазия/дисплазия (18%) и рефлюкс-нефропатия (8%) (см. таблицу 1.3). Структурные аномалии преобладают у детей младшего возраста, у детей старше 12 лет увеличивается распространенность гломерулонефрита (ГН). Пациенты с фокально-сегментарным гломерулосклерозом (ФСГС) составляют 8,7 % детей с ХБП, больные со всеми остальными вариантами ГН - менее 10 %.
В Италии гипоплазия почек в сочетании с урологическими нарушениями или без них является причиной 57,6% всех случаев ХБП у детей, тогда как гломерулярные заболевания составляют только 6,8% случаев. Среди пациентов с тХПН, процент гломерулярных заболеваний возрастает до 15,2%, тогда как частота гипоплазии уменьшается до 39,5%, что подчеркивает несоответствие между скоростью прогрессирования этих заболеваний.
Таблица 1.3.
Причины ХПН в детском возрасте (по данным NAPRTCS, 2005)
| Диагноз | % больных |
| Общее число больных: 6405 | |
| Обструктивная уропатия | 21,6% |
| Аплазия/гипоплазия/дисплазия почек | 17,6% |
| Другие | 14% |
| ФСГС | 8,7% |
| Рефлюкс-нефропатия | 8,3% |
| Поликистозная болезнь | 4% |
| Prune belly | 2,9% |
| Инфаркт почек | 2,4% |
| Неизвестно | 2,6% |
| ГУС | 2,1% |
| Нефрит при системной красной волчанке | 1,5% |
| Цистиноз | 1,5% |
| Наследственный нефрит | 1,5% |
| Пиело/интерстициальный нефрит | 1,3% |
| Медуллярная кистозная болезнь | 1,3% |
| Хронический гломерулонефрит | 1,2% |
| Мезангиопролиферативный ГН- 1-2типа | 1,4% |
| Болезнь Берже (Ig A-нефропатия) | 1% |
| Врожденный нефротический синдром | 1% |
| Идиопатический ГН с полулуниями | 0,7% |
| Геморрагический васкулит | 0,6% |
| Мембранозная нефропатия | 0,5% |
| Другие системные иммунные заболевания | 0,4% |
| Опухоль Вильмса | 0,4% |
| Гранулематоз Вегенера | 0,26% |
| Диабетическая нефропатия | 0,17% |
| Оксалоз | 0,09% |
| Дрэш синдром | 0,09% |
По данным регистра EDTA, гипоплазия/дисплазия и наследственные болезни являлись наиболее частыми причинами тХПН в возрастной группе 0-4 года, в то время как распространенность ГН и пиелонефрита прогрессивно увеличивается с возрастом. В Финляндии наиболее характерной причиной тХПН у детей младше 15 лет остается врожденный нефротический синдром (Финский тип). В Японии среди детского населения очень высока доля тХПН (34%) вследствие ГН (ФСГС- 60%, IgA нефропатия - 17%). ГН был наиболее частой причиной тХПН и у детей и подростков из Австралии и Новой Зеландии (42 %).
|
|
Прогрессирование ХБП. Любое тяжелое заболевание почек приводит к прогрессирующему уменьшению числа функционирующих нефронов, что проявляется снижением, а затем и утратой функции почек. С определенного момента механизмы прогрессирования поражения почек одинаковы при любом заболевании, будь то первичное гломерулярное поражение, тубуло-интерстициальный процесс или врожденные диспластические изменения паренхимы.
При утрате значительной части действующих нефронов в оставшихся возникают компенсаторные изменения гемодинамики: расширение афферентных и менее выраженное расширеннее эфферентных артериол. Это приводит к гиперперфузии, повышению гидростатического давления в капиллярах клубочков и гиперфильтрации. В результате происходит ремоделирование сосудистой стенки артериол, усугубление внутриклубочковой гипертензии, нарушение целостности базальной мембраны клубочков и утечка ультрафильтрата в мезангий, повреждение подоцитов и тубулярного эпителия. Эндотелиальные и мезангиальные клетки, подоциты, тубулярный эпителий в ответ на повреждающие факторы способны продуцировать вещества с провосполительной и просклеротической активностью (хемоаттрактанты, цитокины, факторы роста). Привлечение в очаг повреждения клеток воспаления и развитие в нем фиброза усугубляет повреждение эпителиальных структур почек, замыкая порочный круг. Итогом патологического процесса является гломерулярный склероз в сочетании со склерозом интерстиция, что является морфологическим субстратом ХПН, независимо от ее первопричины.
Течение ранних стадий ХБП вариабельно и часто непредсказуемо. В целом, для врожденных аномалий характерно более медленное прогрессирование до тХПН по сравнению с приобретенными гломерулопатиями. На скорость прогрессирования ХБП влияют различные факторы риска. Некоторые из них (ожирение, гипертензия и протеинурия) поддаются коррекции, тогда как другие (генетическая предрасположенность, раса, возраст, пол) нет.
|
|
Ожирение ассоциируется с гипертензией, альбуминурией и дислипидемией. Каждый из этих факторов может потенциально влиять на прогрессирование ХБП. Частота встречаемости ФСГС значительно выше у тучных лиц по сравнению с худощавыми. Негативное влияние ожирения на течение ХБП опосредовано гломерулярной гиперперфузией и гиперфильтрацией, развивающихся у большинства больных с ожирением.
Гипертензия и протеинурия - важные факторы риска прогрессирования первичной почечной болезни у детей и взрослых. Гипертензия усугубляет гиперперфузию и гиперфильтрацию в сохранившихся нефронах; протеинурия оказывает непосредственное повреждающее действие на подоциты и клетки канальцевого эпителия.
Семейные случаи ХБП указывают на существование генетической предрасположенности к прогрессирующим нефропатиям. Многочисленные исследования позволяют предположить связь ХБП с определенными вариантами (полиморфизмом) генов, кодирующих различные медиаторы прогрессирования ХБП, в том числе и компоненты ренин – ангиотензин-альдостероновой системы. Низкая масса тела при рождении ассоциирована с врожденным уменьшением количества нефронов в почках и последующей предрасположенностью к гипертензии и ХБП в дальнейшей жизни.
Пубертатный и ранний постпубертатным период является критическим для пациентов с ХБП, так как в это время часто происходит резкое снижение почечной функции. Возможно, это связано с участием половых гормонов в патогенезе ХБП и/или дисбалансом между остаточной массой нефронов и быстрым увеличением размеров тела.
Регистр NAPRTCS идентифицировал следующие лабораторные маркеры высокого риска достижения тХПН (p<0,001): альбумин сыворотки < 4 г/%, неорганический фосфор > 5,5 мг/%, кальций < 9,5 мг/%, мочевина крови > 20 мг/%, гематокрита < 33%. Таким образом, в группу высокого риска входят пациенты с уже имеющимся снижением фильтрации, анемией и гипоальбуминемией (вследствие протеинурии или дистрофических изменений).
Прогноз у детей с ХБП. Хотя за истекшие 40 лет произошло существенное увеличение долгосрочного выживания детей и подростков с тХПН: в развитых странах общая (на диализе и после трансплантации) 10-летняя выживаемость достигает лишь 80% и летальность по возрастам все еще в 30-150 раз выше, чем среди детей без тХПН. Примечательно, что диализ связывается с заметно более высоким риском смерти по сравнению с почечной трансплантацией, поэтому пациенты, длительно ожидающие трансплантации, имеют худший прогноз. Оценка причин смерти отражает повышенный риск сердечно-сосудистой патологии и высокую распространенность гипертрофии левого желудочка и дислипидемии среди детей на ЗПТ. Педиатрические пациенты с первичным гломрулонефритом или с кистозной наследственной или врожденной патологией имеют самую большую 5-летнюю выживаемость в отличие от больных с тХПН в результате вторичного ГН или васкулита. Среди детей раннего возраста на диализе смертность выше, чем у старших детей, что, вероятно, связано с сопутствующей патологией. В нашей стране все еще недостаточна обеспеченность детей и взрослых ЗПТ всех видов (гемодиализ, перитонеальный диализ, трансплантация почки), что существенно отягощает прогноз для детей с ХБП. В этой связи особенно актуальными становятся задачи:
|
|
· выявления ХБП на ранней стадии,
· обеспечения адекватной специфической терапии гломерулярных и негломерулярных заболеваний почек,
· своевременного назначения лечения, направленного на замедление прогрессирования ХБП. Терапия ингибиторами ангиотензин-конвертирующего фермента (иАПФ) или блокаторами рецепторов ангиотензина II (БРА) замедляет прогрессирование почечной недостаточности. Эти фармацевтические агенты понижают системное и интрагломерулярное давление крови и уменьшают протеинурию. Они непосредственно влияют на воспалительные процессы и образование фиброзной ткани в почке. Питание также является важным терапевтическим инструментом для торможения прогрессирования ХПН.
· при возникновении ХПН тщательной коррекции метаболических нарушений и предотвращения задержки роста и развития ребенка.
Глава 2
Гипертензия у детей с ХБП
Артериальная гипертензия (АГ) – одно из наиболее частых осложнений при ХБП у детей, которое выявляется у 63% больных уже на первой стадии ХБП, а при ХБП 4-5 стадии более 80% детей страдают артериальной гипертензией, причем более чем в половине случаев она носит характер неконтролируемой. АГ является одной из главных причин прогрессирования ХПН и сердечно-сосудистой смертности при начале ХПН в детском возрасте.
Эффективная антигипертензивная терапия позволяет замедлить прогрессирование ХБП, предотвращает поражение органов-мишеней и тем самым увеличивает почечную и общую выживаемость больных с ХПН, начавшейся в детском возрасте.
Гипертензия, ассоциированная с ХБП, реализуется посредством комплекса разнообразных патофизиологических механизмов. Уровень АД определяется величиной сердечного выброса и общего сосудистого сопротивления (Рис.2.1). При ХПН нормальные механизмы их ауторегуляции заменяются патологической активацией и/или подавлением различных регуляторных систем (нервной, эндокринной, паракринной)
Активация ренин-ангиотензин-альдостероновой системы (РААС) играет центральную роль в развитии ренальной гипертензии. Любое повреждение паренхимы почек (склероз, кисты, рубцы, микроангиопатические повреждения, тубуло- интерстициальное или гломерулярное воспаление) вызывает нарушение перфузии гломерул и повышает секрецию ренина. Гиперренинемия ведет к ангиотензин II-зависимой вазоконстрикции, а также альдостерон-зависимой задержке натрия. Таким образом, повышается и общее периферическое сопротивление, и объем циркулирующей крови. У 90% больных с тХПН АГ носит объем- зависимый характер и у 10% ведущим является повышение активности РАС. Кроме того, высокий уровень ангиотензина II запускает процессы воспаления, гипертрофии миокарда, эндотелиального повреждения, пролиферацию мезангиальных клеток и интерстициальный фиброз.
Существенное влияние на объем внеклеточной жидкости и АД оказывает не контролируемое потребление натрия с пищей. Задержка натрия при ХБП может быть обусловлена как снижением СКФ, так и повышением его реабсорбции в канальцах, не зависящим и не зависящим от активации РААС (при гломерулонефритах с нефротическим синдромом).
У детей с АГ на диализе диурез обычно меньше, чем у нормотензивных пациентов того же возраста, а междиализная прибавка веса умеренно коррелирует с междиализным повышением АД (r=0,41). Нефрэктомия у детей на диализе с ренинзависимой АГ снижает среднее АД, а гипертензия приобретает объем-зависимый характер.
Важным механизмом АГ является повышение активности симпатической нервной системы, отмечающееся у больных с ХБП и особенно при ХПН. Лежащие в основе этого феномена механизмы пока не ясны и могут включать афферентные сигналы от почек, допаминергические нарушения и аккумуляцию лептина. Не только блокада b-рецепторов, но и ингибиция ангиотензин- превращающего фермента (АПФ) может уменьшать симпатическую гиперактивацию при ХБП. Представляется, что ренальная ишемия любого происхождения (в том числе локальная) вызывает симпатическую гиперактивацию.
Препараты, используемые в терапии больных при ХБП, могут вызывать ятрогенную артериальную гипертензию. Например, применение эритропоэтина в течение нескольких недель приводит к подъему АД у 20% больных. Глюкокортикоиды вызывают задержку жидкости за счет их минералокортикоидной активности. Циклоспорин А вызывает повышение гломерулярных афферентных артериол и гиперплазии юкстагломерулярного аппарата с последующим повышенным высвобождением ренина и ангиотензина II.
Таким образом, все дети с ХБП находятся в группе риска по развитию АГ. К группе высокого риска относятся больные с тХПН, реципиенты почечного трансплантата, больные с быстропрогрессирующим гломерулонефритом.
Ранняя диагностика АГ представляется чрезвычайно важной задачей для предупреждения отдаленных последствий гипертензии. С этой целью необходимо применение активных скрининговых методов, так как клинические симптомы АГ часто отсутствуют.
Простейшим скрининговым методом выявления АГ является регулярное измерение артериального давления, по меньшей мере, при каждом осмотре пациента врачом. Диагноз АГ правомерен, если не менее чем при 3-х клинических измерениях АД выше 95 перцентиля для данного возраста и роста. (Приложение 1.).В настоящее время широкое распространение получил метод 24-часового (суточного) мониторирования артериального давления (СМАД). Это исследование позволяет диагностировать «скрытую гипертензию», т.е. не выявляемую при разовых клинических измерениях АД, например, в ночное время, исключить гипертензию «белого халата», которая встречается даже у детей, длительно находящихся в стационаре. В последнем случае целесообразно проведение СМАД амбулаторно, когда ребенок на протяжении исследования находится в привычной ему домашней обстановке.
Проведение СМАД показано всем детям с ХБП ежегодно. В случае выявления АГ необходимо также проведение офтальмологического осмотра (для оценки состояния сосудов сетчатки) и эхокардиографии (для исключения систолической и диастолической дисфункции, оценки степени гипертрофии миокарда). В дальнейшем эти исследования должны выполняться не реже 1 раза в год.
Основной целью антигипертензивной терапии является предупреждение повреждения органов-мишеней (особенно гипертрофии левого желудочка) и замедление прогрессирования ХБП. Всем детям с ХБП, осложненной АГ, показана антигипертензивная терапия до достижения уровня АД ниже 90 перцентиля для данного возраста и роста.
Терапия АГ включает в себя коррекцию образа жизни и диеты и медикаментозное лечение.
В рационе детей с ХБП, осложненной АГ, прежде всего, необходимо ограничить потребление натрия до 1-2 г/сут. Пища готовится без добавления соли, которая выдается дозировано для досаливания еды в тарелке, должны быть исключены все продукты с высоким содержанием натрия (консервы, колбасные изделия, ржаной хлеб и т.п.). Такого рода ограничения часто тяжело переносятся пациентами, но, неконтролируемое потребление натрия значительно снижает эффективность медикаментозной антигипертензивной терапии.
Ожирение не характерно для детей с ХБП и обычно связано с лечением стероидами. Постепенное снижение массы тела на фоне низкокалорийной диеты и дозированных физических нагрузок способствует нормализации АД. На практике применение низкокалорийной диеты затруднено из-за уже имеющихся у детей с ХБП диетических ограничений, и она редко оказывается эффективной. Тем не менее, у тучных детей с задержкой натрия может быть полезна комбинированная низкокалорийная диета с пониженным содержанием натрия.
У больных с АГ, получающих ЗПТ, изменение диализного режима может улучшить контроль АД до начала фармакологического лечения. В большинстве случаев, у диализных больных можно добиться нормализации показателей АД адекватной продолжительностью диализа, тщательным контролем баланса внеклеточной жидкости, более агрессивным достижением сухого веса. Считается, что сокращение натрия в диете в сочетании с низким натрием в диализате сравнимо по эффективности с увеличением диализного времени и позволяет добиться умеренного снижения АД.
На всех стадиях ХБП основой антигипертензивной терапии является фармакологическое лечение. Контроль АД ниже 90 перцентиля может быть достигнут монотерапией не более чем у 75% детей с ХБП 2-ой стадии. У остальных больных необходимо применение 2-х и более лекарственных препаратов. У детей с тХПН трудно достичь адекватного контроля АД, у 50% детей на диализе наблюдается неконтролируемая гипертензия.
У детей с АГ рекомендуется начинать лечение с одного препарата в низкой или средней терапевтической дозе и постепенно повышать ее до достижения контроля АД. При отсутствии достаточного эффекта от монотерапии показано использование комбинации из 2-х и более препаратов. Исключение - неотложные состояния при АГ, такие как гипертонический криз, гипертоническая энцефалопатия, когда лечение следует начинать с внутривенного введения препаратов до достижения клинического эффекта.
В настоящее время в терапии артериальной гипертензии используется широкий спектр лекарственных средств (Табл.2.1).
В первую очередь применяются препараты следующих групп:
· Ингибиторы ангиотензин-превращающего фермента (иАПФ)
· Блокаторы рецепторов к ангиотензину II (БРА)
· Блокаторы кальциевых каналов
· β - адреноблокаторы
· диуретики
К препаратам резерва относятся:
· α β – адреноблокаторы
· центральные α – антагонисты
· периферические α - антагонисты
· периферические вазодилататоры.
У детей с хронической патологией почек начинать терапию наиболее целесообразно с иАПФ или БРА. Эти препараты не только обладают гипотензивным действием, но и замедляют прогрессирование почечной недостаточности более эффективно, чем препараты других фармакологических групп. Ренопротективный эффект блокады РААС обусловлен снижением внутриклубочковой гипертензии путем избирательной дилатации эфферентной артериолы, снижением протеинурии, а также ослаблением провоспалительного и просклеротического действия ангиотензина II. Дополнительный эффект блокады РААС заключается в снижении симпатической гиперактивности.
Поскольку протеинурия является независимым фактором прогрессирования ХБП, пациенты с ХБП и протеинурией должны получать блокаторы РААС даже при отсутствии АГ. Не выявлено отчетливых преимуществ применения БРА перед иАПФ. Если протеинурия сохраняется на фоне монотерапии, то возможно применение комбинации иАПФ и БРА, так как это сочетание эффективно для уменьшения протеинурии и замедления прогрессирования ХБП.
Применение ингибиторов АПФ и БРА противопоказано пациентам со снижением СКФ ≤ 20 мл/мин, при гиперкалиемии, и при двустороннем стенозе почечных артерий. При назначении препаратов этих групп детям с ХБП 3-4 стадии необходимо контролировать уровень азотемии и калия после начала терапии и при каждом повышении дозы. Терапия комбинацией иАПФ и БРА повышает риск падения клубочковой фильтрации и гиперкалиемии. У детей с ХПН целесообразным может быть применение фозиноприла (моноприла), т.к. этот препарат (в отличие от других и АПФ) метаболизируется в основном в печени, а не выводится с мочой и более безопасен для больных с существенным нарушением почечных функций. Отмечено, что кашель, индуцированный иАПФ, у детей встречается реже, чем у взрослых; при возникновении этого побочного эффекта возможна замена иАПФ на БРА.
b-блокаторы – препараты второй линии для лечения детей с почечной гипертензией. b-блокаторы должны с осторожностью использоваться при сердечной недостаточности, а также у больных сахарным диабетом из-за негативных метаболических эффектов. Неселективные b-блокаторы противопоказаны при заболеваниях легких, сопровождающихся бронхообструкцией. У грудных детей хороший эффект оказывает назначение пропранолола. Ретардированная форма этого препарата позволяет назначать его 1 раз в день у старших детей. Предпочтительнее назначение селективных b1-блокаторов, например атенолола, который также обладает пролонгированным действием.
Применение b-блокаторов показано при наличии симптомов гиперактивации симпатической нервной системы: тахикардии, вазоконстрикции, высокого сердечного.
Блокаторы кальциевых каналов (БКК) используются как дополнительная терапия у детей с резистентной гипертензией. Дигидропиридиновые препараты (нифедипин, амлодипин и т.д.) действуют главным образом как вазодилататоры. Дозы амлодипина разработаны для педиатрии и не требуют коррекции в зависимости от почечной функции, однако дигидропиридиновые БКК (нифедипин) повышают внутриклубочковое давление и могут повышать протеинурию, не оказывая, следовательно, ренопротективного действия. Недигидропиридиновые БКК (производные фенилалкиламина - верапамил, бензодиазепина - дилтиазем) обладают дополнительным антипротеин- урическим эффектом.
В исследованиях у пожилых больных с сахарным диабетом 2 типа, недигдропиридиновые БКК показали себя как действенное средство в снижении протеинурии и АД и замедлении прогрессирование ХБП, их эффективность в этом отношении оказалась сравнима с иАПФ - лизиноприлом. Поскольку среди детей подобных исследований не проводилось, в детском возрасте недигдропиридиновые БКК должны применяться с осторожностью, учитывая их побочные эффекты (удлинение интервала PQ, брадиаритмии).
В исследованиях у больных с сахарным диабетом, АГ и протеинурией комбинация иАПФ с дигидропиридиновым БКК III поколения – манидипином - оказывала дополнительный антипротеинурический эффект по сравнению с монотерапией иАПФ. Показано благоприятное воздействие манидипина на почечную гемодинамику и протеинурию.
Внутривенное введение никардипина является методом выбора для лечения гипертонического криза, особенно в тех случаях, когда почечная функция не известна или быстро изменяется. Этот препарат может безопасно использоваться даже у очень маленьких детей с АГ.
Диуретики показаны, прежде всего, пациентам с задержкой натрия, гиперволемией и отеками и не являются препаратами первой линии в терапии АГ у детей с ХБП. Необходимо помнить, что тиазидные диуретики становятся малоэффективными при СКФ<60 мл/мин´1,73м², и вовсе неэффективны при СКФ<30 мл/мин´1,73м². Поэтому для лечения больных с ХБП 4 и 5 стадии предпочтительнее использовать фуросемид. Антагонисты минералкортикоидных рецепторов (спиронолактон) оказывают синэргическое действие с антагонистами РААС, однако потенциальный риск гиперкалиемии ограничивает их применение.
Монотерапия диуретиками не должна использоваться для лечения АГ у детей с ХБП, но они могут применяться в комбинации с антигипертензивными препаратами всех других групп. Добавление диуретиков к иАПФ в качестве 2-го препарата показано больным без протеинурии. Фиксированное сочетание антагонистов РААС с тиазидными диуретиками может использоваться у подростков, но не подходит маленьким детям, когда требуется частая коррекция дозы препарата. Применение диуретиков не показано детям с гипо- и диспластическими нарушениями, проявляющимися соль-теряющими нефропатиями.
К тиазидовым диуретикам относится индапамид (арифон), однако в терапевтических дозах его гипотензивный эффект обусловлен не столько диуретическим, сколько вазодилатирующим действием (за счет ограничения поступления кальция в гладкомышечные клетки сосудистой стенки). Индапамид сохраняет эффективность и при снижении СКФ до 30 мл/мин и менее. Максимальный антигипертензивный эффект индапамида достигается через 2-4 недели регулярного применения.
Другие средства используются при лечении АГ значительно реже, что главным образом обусловлено их тяжелыми побочными эффектами. Так, при назначении a-блокаторов (празозин) необходим контроль за опорожнением мочевого пузыря, возможно развитие феномена Рейно. a-агонисты центрального действия (клонидин) оказывают эффект путем сокращения выброса медиаторов симпатических нервов. Основная проблема применения этих средств – рикошетная гипертензия после отмены препарата. Вазодилататор, такие как гидралазин и миноксидил, мало подходят для длительной терапии больных с ХБП, вследствие меньшей эффективности и возможной задержки натрия и воды.
Можно предложить следующую схему подбора антигипертензивной терапии:
1. Назначение блокаторов РААС (иАПФ или БРА). У пациентов с высокой протеинурией возможно использование комбинации иАПФ+БРА, однако у больных с ХПН необходимо помнить об опасности снижения клубочковой фильтрации и гиперкалиемии!
У пациентов с СКФ < 20 мл/мин антигипертензивную терапию целесообразно начинать с негидропиридиновых блокаторов кальциевых каналов.
2. При отсутствии эффекта от монотерапии, показано назначение 2-го препарата. Предпочтительнее сочетать иАПФ/БРА с блокаторами кальциевых каналов или с диуретиками, БКК - с b-блокаторами.
3. При необходимости дальнейшего усиления терапии целесообразно использовать комбинации иАПФ/БРА+БКК+диуретики, БКК+b-блокаторы+диуретики.
4. Если при использовании комбинаций из 3-х препаратов не удается достичь адекватного контроля АГ, применяются препараты группы резерва (αβ – адреноблокаторы, центральные α-агонисты, периферические α-антагонисты, вазодилататоры)
5. У детей до года лучше использовать антигипертензивные препараты короткого действия (например, пропранолол вместо атенолола, каптоприл вместо эналаприла). После стабилизации состояния возможен переход на препараты пролонгированного действия.
Лечение гипертонического криза. Гипертонический криз – быстрый подъем АД до уровня, значительно превышающего средний, характерный для данного больного. Гипертонический криз несет угрозу острой гипертонической энцефалопатии, судорог, острой левожелудочковой недостаточности и является потенциально опасным для жизни состоянием. При лечении гипертонического криза следует стремиться к постепенному (за 24-48 часов) снижению АД до исходного уровня.
При отсутствии осложнений гипертонического криза, при быстром подъеме АД показан прием нифедипина, каптоприла сублингвально, фуросемида внутрь.
В терапии гипертонического криза с поражением органов-мишеней целесообразно применять парентеральное введение антигипертензивных препаратов быстрого действия. Препаратом выбора является лабеталол (внутривенно). При наличии противопоказаний (астма, сердечная недостаточность, атриовентрикулярная блокада 2-3 ст.) можно использовать нитропруссид натрия. При недостаточной эффективности одного препарата возможно совместное применение лабеталола и нитропруссида натрия, или длительной внутривенной инфузии гидралазина. У пациентов с гиперволемией целесообразно парентеральное назначение петлевых диуретиков (фуросемида внутривенно струйно или капельно).
У диализных пациентов с гипертоническим кризом необходимо проведение гемофильтрации для удаления излишков жидкости.
При чрезмерно быстром или выраженном снижении АД показано внутривенное введение плазмозамещающих растворов.
После достижения контроля АД показано назначение пероральных антигипертензивных препаратов короткого действия с последующим постепенным переходом на препараты пролонгированного действия для постоянной терапии АГ.
Таким образом, для предотвращения значительного ухудшения функции почек, сердечно-сосудистой патологии и смертности, связанной с высоким АД, у детей с ХБП необходим адекватный контроль АД и активные скрининговые мероприятия по выявлению АГ. При лечении больных с АГ не должны игнорироваться рекомендации по диете и модификации образа жизни, особенно у детей с ожирением и больных на гемодиализе. У детей с ХБП препаратами первого ряда считаются иАПФ и БРА. При необходимости, терапия должна дополняться диуретиками, блокаторами кальциевых каналов, b-блокаторами в зависимости от особенностей течения заболевания у конкретного пациента. Для лечения гипертонических кризов показано применение быстро действующих препаратов с коротким периодом выведения, что позволяет точно подобрать дозу и быстро корригировать ее по мере изменения клинической ситуации.
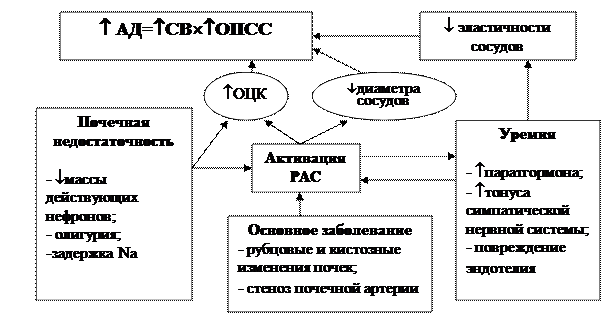
СВ – сердечный выброс; ОПСС – общее периферическое сосудистое сопротивление; РАС – ренин-ангиотензиновая система.
Рисунок № 2.1. Физиологические механизмы гипертензии при хронических болезнях почек Pediatr Nephrol. 2008 March; 23(3): 363–371.
Таблица 2.1.
|
|
|

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!