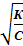РАВНОВЕСИЕ В РАСТВОРАХ СЛАБЫХ ЭЛЕКТРОЛИТОВ.
ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА
[Фридрих Вильгельм Оствальд (1853-1932). Немецкий физикохимик и философ,известен трудами по теории растворов электролитов, химической кинетики. Получил Нобелевскую премию в 1909 году за работы в области химического катализа]
Ф.В. Оствальд в 1888 году применил к рассмотрению процесса диссоциации закон действующих масс. Это позволило ему вывести математическую зависимость между константой диссоциации электролита (К) и степенью диссоциации (α). Повторим ход его рассуждений.
Рассмотрим диссоциацию плавиковой кислоты: HF ↔ H + + F‾. Обозначим молярную концентрацию электролита в растворе через с. Учитывая, что α – это доля распавшихся на ионы молекул, концентрация ионов СH = СF = C∙α. Концентрация недиссоциированных молекул HF: СHF = C(1 – α). Подставим эти величины в выражение для константы диссоциации и получим:
К = 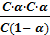 =
= 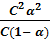 =
= 
Полученное выражение является математическим выражением закона разбавления Оствальда. При α ‹‹ 1 уравнение упрощается:
К = С α2.
Отсюда можно определить степень диссоциации слабого электролита в растворе данной концентрации:
α = 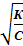
Поскольку величина К от концентрации не зависит, из уравнения следует:
с разбавлением раствора, т.е. с уменьшением концентрации степень диссоциации слабого электролита увеличивается.
(Подчеркнём, что закон Оствальда выражает не зависимость константы диссоциации (К) от концентрации электролита (с) (при фиксированных условиях константа диссоциации данного электролита является, разумеется, постоянной величиной), а зависимость степени диссоциации (α) электролита от его концентрации).
Закон разбавления Оствальда играет важную роль при изучении свойств электролитов. Так, например, закон разбавления Оствальда позволяет более точно разделить все электролиты на две группы:
Электролиты, поведение которых подчиняется закону разбавления являются слабыми электролитами.
Электролиты, поведение которых не подчиняется закону разбавления являются сильными электролитами.
При рассмотрении диссоциации кислот и оснований мы познакомимся с применением этого закона к теории электролитов.
Влияние общего иона на процесс электролитической диссоциации слабого электролита
Рассмотрим диссоциацию уксусной кислоты в водном растворе. В растворе устанавливается равновесие:
СН3СООН ↔ СН3СОО- + Н+.
Добавим к раствору сильно ионизированную соляную кислоту:
HCl → H+ + Cl-
Добавляемый электролит имеет общий ион (Н+) с рассматриваемым диссоциирующим веществом. Это приводит к смещению равновесия диссоциации уксусной кислоты в сторону образования молекул кислоты. Ионы водорода образованные из HCl совершенно идентичны тем, которые возникают при диссоциации уксусной кислоты, и их воздействие, называемое влиянием общих ионов, заключается в том, что они подавляют ионизацию уксусной кислоты.
С особым случаем влияния одинаковых ионов мы познакомимся при изучении буферных растворов.
РАВНОВЕСИЕ В РАСТВОРАХ СЛАБЫХ ЭЛЕКТРОЛИТОВ.
ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА
[Фридрих Вильгельм Оствальд (1853-1932). Немецкий физикохимик и философ,известен трудами по теории растворов электролитов, химической кинетики. Получил Нобелевскую премию в 1909 году за работы в области химического катализа]
Ф.В. Оствальд в 1888 году применил к рассмотрению процесса диссоциации закон действующих масс. Это позволило ему вывести математическую зависимость между константой диссоциации электролита (К) и степенью диссоциации (α). Повторим ход его рассуждений.
Рассмотрим диссоциацию плавиковой кислоты: HF ↔ H + + F‾. Обозначим молярную концентрацию электролита в растворе через с. Учитывая, что α – это доля распавшихся на ионы молекул, концентрация ионов СH = СF = C∙α. Концентрация недиссоциированных молекул HF: СHF = C(1 – α). Подставим эти величины в выражение для константы диссоциации и получим:
К = 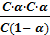 =
= 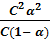 =
= 
Полученное выражение является математическим выражением закона разбавления Оствальда. При α ‹‹ 1 уравнение упрощается:
К = С α2.
Отсюда можно определить степень диссоциации слабого электролита в растворе данной концентрации:
α = 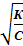
Поскольку величина К от концентрации не зависит, из уравнения следует:
с разбавлением раствора, т.е. с уменьшением концентрации степень диссоциации слабого электролита увеличивается.
(Подчеркнём, что закон Оствальда выражает не зависимость константы диссоциации (К) от концентрации электролита (с) (при фиксированных условиях константа диссоциации данного электролита является, разумеется, постоянной величиной), а зависимость степени диссоциации (α) электролита от его концентрации).
Закон разбавления Оствальда играет важную роль при изучении свойств электролитов. Так, например, закон разбавления Оствальда позволяет более точно разделить все электролиты на две группы:
Электролиты, поведение которых подчиняется закону разбавления являются слабыми электролитами.
Электролиты, поведение которых не подчиняется закону разбавления являются сильными электролитами.
При рассмотрении диссоциации кислот и оснований мы познакомимся с применением этого закона к теории электролитов.
Влияние общего иона на процесс электролитической диссоциации слабого электролита
Рассмотрим диссоциацию уксусной кислоты в водном растворе. В растворе устанавливается равновесие:
СН3СООН ↔ СН3СОО- + Н+.
Добавим к раствору сильно ионизированную соляную кислоту:
HCl → H+ + Cl-
Добавляемый электролит имеет общий ион (Н+) с рассматриваемым диссоциирующим веществом. Это приводит к смещению равновесия диссоциации уксусной кислоты в сторону образования молекул кислоты. Ионы водорода образованные из HCl совершенно идентичны тем, которые возникают при диссоциации уксусной кислоты, и их воздействие, называемое влиянием общих ионов, заключается в том, что они подавляют ионизацию уксусной кислоты.
С особым случаем влияния одинаковых ионов мы познакомимся при изучении буферных растворов.



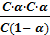 =
= 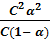 =
=