

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...
Топ:
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Оснащения врачебно-сестринской бригады.
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Интересное:
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
ПРАКТИКУМ
ПО ОБЩЕЙ ХИМИИ
Под редакцией профессора Ореховой А.И.
Рекомендовано Учебно-мето-дическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
(УМО-265 12.05.06)
Екатеринбург, 2009
Практикум по общей химии для студентов всех факультетов. Изд. П, переработанное и дополненное./ Под редакцией проф. Ореховой А.И. – Екатеринбург: УГМА, 2009.
При подготовке врачей большое внимание уделяется теоретическому и практическому изучению многих разделов химии. Химия, как основа всех биологических процессов, входит в число наук, составляющих фундамент медицины. Химические методы исследования и анализа постоянно применяются в диагностике заболеваний и при профилактических обследованиях. Химический синтез является основой для изготовления лекарств. В данном практическом руководстве приведены лабораторные работы, помогающие освоению теоретических основ химии. Практикум написан в соответствии с программой по курсу общей химии для студентов медицинских институтов.
В составлении практикума принимали участие:
Р.П.Лелекова
И.И.Ильяшевич
В.Е.Кротов
Г.Н.Моисеева
Т.М.Вовнова
Т.А.Афанасьева
© Уральская государственная медицинская академия, 2009
СОДЕРЖАНИЕ
Предисловие............................................................................ 5
РАБОТА 1. Определение эквивалента металла................. 6
РАБОТА 2. Приготовление раствора определенной
концентрации........................................................................ 9
РАБОТА 3. Измерение теплового эффекта
реакции нейтрализации....................................................... 12
РАБОТА 4. Скорость химической реакции....................... 15
|
|
РАБОТА 5. Химическое равновесие.................................... 18
РАБОТА 6. Получение комплексных соединений............ 21
РАБОТА 7. Окислительно-восстановительные свойства
соединений марганца........................................................... 24
РАБОТА 8. Буферные системы............................................ 27
РАБОТА 9. Поверхностные явления. Адсорбция.............. 32
РАБОТА 10. Хроматография................................................ 36
РАБОТА 11. Структурообразование, изоэлектрическая
точка белков.......................................................................... 43
РАБОТА 12. Химические свойства металлов и сплавов.. 48
РАБОТА 13. Метод комплексонометрии. Определение
общей жесткости воды (для медико-профилактического
факультета)............................................................................. 51
РАБОТА 14. Метод комплексонометрии. Определение
содержания кальция в плазме крови (для лечебно-профилактического и педиатрического факультетов) 54
РАБОТА 15. Метод комплексонометрии. Определение
содержания кальция в слюне (для стоматологического
факультета).............................................................................. 57
РАБОТА 16. Метод оксидиметрии. Определение
окисляемости воды методом перманганатометрии
(для медико-профилактического факультета)....................... 60
РАБОТА 17. Метод оксидиметрии. Определение
массовой доли пероксида водорода в растворе
методом перманганатометрии (для лечебно-профилактического и педиатрического факультетов) 63
РАБОТА 18. Метод йодометрии. Определение
содержания аскорбиновой кислоты в препарате
(для лечебно-профилактического, стоматологического,
педиатрического факультетов).............................................. 66
РАБОТА 19. Метод йодометрии. Определение
содержания свободного хлора в воде (для медико-профилактического факультета) 68
РАБОТА 20. Фотоколориметрия. Определение
содержания Fe (III) в минерализованной плазме крови
(для лечебно-профилактического и педиатрического
факультетов)........................................................................... 70
РАБОТА 21. Фотоколориметрия. Определение
содержания Fe (III) в питьевой воде (для медико-профилактического факультета) 72
|
|
РАБОТА 22. Потенциометрический метод
определения нитратов в овощах и фруктах
(для медико-профилактического факультета)....................... 74
РАБОТА 23. Определение активной и общей
кислотности желудочного сока методом
потенциометрического титрования (для лечебно-профилактического и педиатрического факультетов) 78
РАБОТА 24. Теория произведения растворимости.
Образование осадков в организме человека и их
растворение............................................................................ 81
РАБОТА25. Получение дисперсных систем....................... 84
РАБОТА 26. Сравнительная устойчивость и методы
осаждения различных дисперсных систем........................ 88
РАБОТА 27. Растворы электролитов. Методы
определения рН биологических жидкостей...................... 94
РАБОТА 28. Метод кондуктометрии. Определение
электрической проводимости желудочного сока............. 98
ПРЕДИСЛОВИЕ
Практикум содержит информацию о подготовке и проведении лабораторно-практических занятий по 10 темам.
К каждому занятию предпослано краткое обоснование изучения данной темы для формирования будущего специалиста-медика; указывается цель занятия, где дается представление о том, какие знания и умения должен приобрести студент на занятии. Контрольные вопросы ориентируют студента в самостоятельной работе с литературой, помогают лучше усвоить материал.
При подготовке к занятию рекомендуется пользоваться следующей литературой:
1. Ю.А.Ершов, В.А.Попков, А.С.Берлянд. Общая химия. М.: Высшая школа, 1993.
2. А.С.Ленский. Введение в бионеорганическую и биофизическую химию. М.: Высшая школа, 1989.
3. М.И.Равич-Щербо, В.В.Новиков. Физическая и коллоидная химия. М.: Высшая школа, 1980.
4. А.В.Бабков и др. Практикум по общей химии с элементами количественного анализа. М.: Высшая школа, 1978.
5. А.И.Орехова, Р.П.Лелекова. Задачи и упражнения по общей и бионеорганической химии. Под ред. А.И.Ореховой. Екатеринбург: УГМА, 2007.
6. В.И.Слесарев. Химия. Основы химии живого. С.-Пб.: Химиздат, 2000.
Письменное задание к занятию включает в себя вопросы и задачи для проверки усвоения материала, в то же время обязательное выполнение домашнего задания – это одна из форм самостоятельной работы студентов.
Лабораторная работа представлена описанием опытов и методическим указанием к их проведению. Лабораторная работа выполняется каждым студентом индивидуально. Для более глубокого осмысления лабораторной работы и экономии времени на занятии необходимо в процессе подготовки к занятию прочитать описание опытов, заготовить таблицы.
|
|
МЕТАЛЛА
Закон эквивалентов является одним из основных законов химии; используется при приготовлении реактивов и количественном определении веществ титриметрическим методом.
Закон эквивалентов имеет большое значение при анализе чистоты лекарственных препаратов, анализе питьевых и сточных вод, различных биологических жидкостей, при диагностике и контроле за ходом лечения ряда заболеваний.
ЦЕЛЬ ЗАНЯТИЯ:
Усвоить понятие эквивалента, ознакомиться с практическим расчетом эквивалента металла на основании экспериментальных данных по выделению им водорода из раствора кислоты.
Задание:
Проведите экспериментальное определение эквивалента металла по выделению им водорода из раствора кислоты. По величине эквивалента и его степени окисления назовите металл. Составьте отчет.
ФОРМА ОТЧЕТА
Название работы
| Масса металла, г | Показания бюретки, мл | Объем Н2, мл | Т, К | Давление, мм рт ст. | Объем Н2 (н.у.), мл | ЭМе, г/моль | Относительная ошибка, % | ||||
| до реакции | после реакции | атмосферное | нас. пара воды | Н2 | эксперимент. | теоретич. | |||||
Уравнение химической реакции:
Формулы для расчетов:
ЛИТЕРАТУРА:
4. С. 27-32.
ОПРЕДЕЛЕННОЙ КОНЦЕНТРАЦИИ
Важной характеристикой раствора является его концентрация. Многие лекарственные препараты используются в виде растворов определенной концентрации. Пищевые продукты характеризуются различным количественным содержанием компонентов. Нормальная жизнедеятельность организма невозможна без поддержания постоянной концентрации компонентов во внутриклеточных и тканевых жидкостях организма. Знание этой темы необходимо при изучении биохимии, физиологии, фармакологии, клинических и санитарно-гигиенических дисциплин.
Цель занятия:
Научиться пользоваться мерной посудой (мерные колбы, пипетки, бюретки). Научиться готовить растворы путем разбавления. Научиться титровать.
|
|
Задание:
1. Рассчитайте объем исходной концентрированной кислоты, необходимый для приготовления более разбавленного раствора.
2. Приготовьте заданный раствор.
3. Установите точную концентрацию приготовленного раствора.
Методические указания к выполнению работы:
1. Получите конкретное задание от преподавателя. Запишите в отчете.
2. Измерьте в цилиндре ареометром плотность исходного концентрированного раствора. Запишите в отчете.
3. По таблице справочника установите массовую долю (ώ, %) кислоты. Запишите в отчете.
4. Рассчитайте по формулам: сколько мл исходной концентрированной кислоты потребуется для приготовления раствора заданной концентрации в заданном объеме. Формулы:

В результате разбавления масса растворенного вещества не изменяется, следовательно:

5. Проверьте результат расчета у преподавателя.
6. Отмерьте с помощью бюретки (на столе общего пользования) рассчитанный объем кислоты в мерную колбу.
7. Разбавьте дистиллированной водой, перемешайте. Долейте дистиллированной водой до метки. Снова перемешайте.
8. Перенесите пипеткой в три конические колбы по 10 мл приготовленного раствора кислоты. Добавьте в них по 1-2 капли фенолфталеина.
9. Приведите бюретку в рабочее состояние. Заполните ее титрованным раствором щелочи.
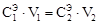 10. Оттитруйте три пробы приготовленного раствора кислоты. Конец титрования определите по появлению слабо розового окрашивания. Результаты занесите в табл. 2.
10. Оттитруйте три пробы приготовленного раствора кислоты. Конец титрования определите по появлению слабо розового окрашивания. Результаты занесите в табл. 2.
11. Исходя из закона эквивалентов, по формуле
рассчитайте точную молярную концентрацию эквивалента приготовленного раствора кислоты (точность: три значащих цифры после запятой). Результаты расчета занесите в отчет.
 12. Сделайте вывод о точности приготовленного Вами раствора кислоты. Для этого рассчитайте относительную ошибку приготовления:
12. Сделайте вывод о точности приготовленного Вами раствора кислоты. Для этого рассчитайте относительную ошибку приготовления:
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Почему для растворов кислот НСl, НNO3 молярная и молярная концентрации эквивалента совпадают, а для Н2SO4 и Н3РО4 нет?
2. Во сколько раз молярная концентрация эквивалента выше молярной концентрации для растворов Са(NO3)2, АlCl3, Fe2(SO4)3?
3. Запишите формулы расчета титра раствора, если известна его молярная концентрация эквивалента.
4. Выразите состояние эквивалентности при взаимодействии растворов всеми возможными способами.
5. Что такое титрование? С какой целью проводится?
Таблица 2
| Исходная кислота | Приготовленный раствор кислоты | Результаты титрования | Концентрация по результатам титрования | Относительная ошибка | |||||
| ρ, г/мл | ω % | V, мл | V, мл | Сэ, моль экв/л | Vк-ты, мл | Vщ , мл | Vщ , мл | Сэ, моль экв/л | ω, % |
|
|
ЛИТЕРАТУРА:
1. С. 48-49; 2. С. 94-96; 4. С. 77-93, 98-103, 109-110; 5. С. 38-47; 6. С. 135-139.
Таблица 3
| Наименование величины | |||
| Масса калориметрического стакана, m, г | |||
| Концентрация растворов, С, моль/л | |||
| Объем каждого раствора, V, мл | |||
| Температура основания, tосн., оС | |||
| Температура кислоты, tк., оС | |||
| Начальная температура, t1=0,5(tосн.+tк.), оС | |||
| Температура нейтрализации, t2, оС | |||
| Общая масса растворов, m2 = 2Vρ, г | |||
| Энтальпия нейтрализации, ∆Нонейтр., Дж/моль |
По результатам опытов вычислите энтальпию нейтрализации 1 моля кислоты (основания) по формуле:
 ;
;
где Δ t = t2 – t1
C – теплоемкость калориметрической жидкости и всех соприкасающихся с ней частей калориметра: стакана, мешалки, термометра:
С = ΣСi·mi, так что С = С1·m1 + C2·m2
Удельная теплоемкость стекла (Ст) равна 0,753 Дж/г·град, раствора (Ср) – 4,184 Дж/г·град, ρ – плотность раствора – 1 г/мл, V и С – объем и молярная концентрация кислоты (основания).
ВЫВОДЫ:
1. Объясните, почему реакция нейтрализации 1 моля любой сильной одноосновной кислоты (НС1, HNO3 и т.п.) сильными основаниями (NaOH, KOH и т.п.) в достаточно разбавленных водных растворах сопровождается почти одинаковым экзотермическим тепловым эффектом, при 298 К незначительно отклоняющимся от -55,900, при 291 К -57,363 кДж/моль.
2. Объясните, почему для слабых электролитов в реакции нейтрализации выделяется значительно меньшее количество теплоты.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Исходя из значений ΔНо реакций:
MgO k + 2H+aq = Mg2+aq + H2O ж, ΔНо1 = -145,6 кДж
Н2О ж = Н+aq + OH-aq ΔHo2 = 57,5 кДж,
вычислите значение ΔНо3 для реакции растворения оксида магния в воде:
MgOk + H2Oж = Mg2+aq + 2OH-aq, ΔHo3
Cокращение «aq» обозначает разбавленный водный раствор.
2. Используя значения стандартных энтальпий образования СО2 и MgO, равных соответственно -393,5 и -601,8 кДж/моль, вычислите ΔНо реакции: 2Mgk + CO2 г = 2MgOk + Cт
3. Вычислите стандартное изменение энтальпии реакции:
Ст + 2Н2 г + ½ О2 г = СН3ОНж, если стандартные энтальпии сгорания С, Н2 и СН3ОН равны соответственно -395, -286, -712 кДж/моль.
ЛИТЕРАТУРА:
1. С.16-21; 2. С. 17-22; 4. С. 51-56; 5. С. 6-14; 6. С. 73-84.
СОЕДИНЕНИЙ
Комплексные соединения – наиболее обширный и разнообразный класс соединений. Они широко распространены в природе, играют важную роль в биологических процессах. Микроэлементы Со, Мо, Си, Мn и др. в организме в основном находятся в виде комплексных соединений. Различные ферменты, витамины, гормоны представляют собой комплексные соединения. Комплексные соединения находят разнообразное практическое применение. Так, образование хелатных комплексов используется при умягчении жесткой воды, растворении камней в почках, выведении металлов-ядов из организма. Знание темы «Комплексные соединения» необходимо при изучении биохимии, фармакологии, судебной медицины, гигиенических и некоторых клинических дисциплин.
Цель занятия:
Изучить способы получения комплексных соединений. Научиться записывать формулы комплексных соединений, называть их, классифицировать, показывать образование связей в комплексных ионах.
Задание:
Выполните пять лабораторных опытов, ответьте по каждому опыту на следующие вопросы:
1. Напишите уравнение реакции получения комплексного иона.
2. Рассчитайте заряд комплексного иона.
3. Рассчитайте степень окисления комплексообразователя.
4. Укажите координационное число.
5. Укажите лиганды.
6. Объясните механизм процесса комплексообразования и тип гибридизации центрального атома.
7. Укажите класс комплексного соединения.
8. Назовите комплексное соединение.
9. Оформите отчет по теме. Сделайте вывод о методах получения комплексных соединений.
Методические указания к выполнению работы:
Опыт 1. Получение комплексного соединения меди [Сu(H2O)4]SO4
Поместите в пробирку несколько кристаллов сульфата меди (белый порошок). Добавьте несколько капель воды. Наблюдайте появление голубой окраски комплексного соединения.
Опыт 2. Получение комплексного соединения меди [Cu(NH3)4]SO4
К 3-4 каплям сульфата меди (II) по каплям добавьте раствор аммиака до образования осадка основной соли меди (CuOH)2SO4. К осадку прилейте избыток раствора аммиака. Наблюдайте растворение осадка и получение сине-фиолетового раствора, содержащего комплексные ионы [Cu(NH3)4]2+.
Опыт 3. Получение внутрикомплексного соединения кобальта (II)
Поместите в пробирку несколько кристаллов карбоната кобальта (II). Добавьте на кончике шпателя глютаминовой кислоты. Прилейте к содержимому пробирки 4-5 капель воды и нагрейте на спиртовке до окончания выделения углекислого газа. Получившийся розовый раствор указывает на образование глютамата кобальта (II).
Опыт 4. Получение комплексного соединения ртути K2[HgI4]
К 3-4 каплям нитрата ртути (II) добавьте раствор иодида калия до образования ярко-красного осадка иодида ртути (II). К полученному осадку прилейте избыток иодида калия до растворения образовавшегося осадка и появления желтоватого раствора, содержащего ионы [HgI4]2-.
Опыт 5. Получение комплексного соединения алюминия Na3[Al(OH)6]
К 3-4 каплям раствора сульфата алюминия по каплям добавьте раствор NaOH до образования белого осадка гидроксида алюминия. К осадку прилейте избыток раствора NaOH. Наблюдайте растворение осадка с образованием раствора комплексного соединения.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Какие соединения называются комплексными?
2. Какова структура комплексного соединения?
3. Как определяется заряд комплексного иона, комплексообразователя?
4. Как определяется координационное число комплексообразователя?
5. Какие частицы могут выполнять роль комплексообразователя? лиганда?
6. Каков характер связей в комплексных соединениях? Их поведение в растворах.
7. По каким признакам классифицируются комплексные соединения?
8. Номенклатура комплексных соединений.
Таблица 6
| Формула соли, название | Класс | Уравнение реакции | Заряд комплексного иона | Степень окисления комплексообразователя | Координационное число комплексообразователя | Тип гибридизации |
ЛИТЕРАТУРА:
1. С. 191-203; 2. С. 219-227; 5. С. 24-26; 6. С. 243-261.
РАБОТА 8. БУФЕРНЫЕ СИСТЕМЫ
Нормальная жизнедеятельность организма невозможна без поддержания постоянных характеристик (температура, давление, концентрация веществ) во внутриклеточных и тканевых жидкостях организма. Значительные изменения рН любых биологических систем и особенно крови могут привести к гибели всего организма. Отсюда понятна огромная важность для организма поддержания величины рН в заданных природой пределах. В процессе обучения студент-медик с темой «буферные системы» встречается при изучении следующих предметов: биохимии, микробиологии, биологии, гистологии, нормальной анатомии, патологической физиологии, гигиены труда и питания, оперативной хирургии, факультативной терапии и пр. В практической работе знания, полученные по этой теме, могут быть использованы в случае нарушения кислотно-щелочного равновесии при различных сердечно-сосудистых заболеваниях. При ишемической болезни сердца закономерным является возникновение ацидоза (сдвиг рН в кислую сторону).
Исследования смещения кислотно-щелочного равновесия при заболеваниях печени (цирроз) и т.д. показали на смещение рН в щелочную область (алкалоз).
Кислотно-щелочное равновесие внутренних сред организма определяет в ряде случаев восприимчивость организма к инфекционным заболеваниям.
ЦЕЛЬ ЗАНЯТИЯ:
Освоить расчет состава буферных растворов с заданным рН. Научиться готовить буферные растворы. Овладеть практическими навыками измерения рН потенциометрическим методом и определения буферной емкости растворов.
ЗАДАНИЕ:
Выполните два лабораторных опыта и составьте отчет.
1. Рассчитайте состав (объем соли и кислоты) для приготовления 60 мл ацетатного буферного раствора с заданным значением рН.
2. Приготовьте и определите рН буферного раствора.
3. Определите буферную емкость приготовленного раствора по кислоте и по основанию.
Таблица 8
| рН буферной системы | Данные расчета | |||||
| задано | рН по прибору | ΔрН | 
| 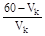
| Vk, мл | Vc, мл |
2. Поясните причину отклонений рН от заданного значения.
ОПЫТ 2. Определение буферной емкости по кислоте и основанию
В один чистый стакан с помощью мерного цилиндра налейте 30 мл приготовленного буферного раствора и добавьте из бюретки 3 мл 0,1 М раствора соляной (азотной) кислоты. В другой стакан отмерьте тоже 30 мл буферного раствора и добавьте 3 мл 0,1 М раствора гидроксида натрия. Содержимое каждого стакана перемешайте и определите рН на рН-метре. Результаты занесите в таблицу 9. По полученным данным рассчитайте буферную емкость по кислоте и основанию. Результаты расчета занесите в таблицу 9. Формула расчета:
 ,
,
где: νэ – число моль эквивалентов кислоты или основания;
V - объем буферного раствора, л.
Таблица 9
| № пп | рН буферной системы | рН после до-бавления щелочи | рН после до-бавления кислоты | ΔрН | νэ кислоты или щелочи | соотношение νс/νк | В по кислоте или по основанию |
| 1. | ///////////// | ||||||
| 2. | ///////////// |
ВЫВОДЫ:
1. Дайте подробный расчет буферной емкости по кислоте и основанию.
2. Какая буферная емкость больше (по кислоте или основанию) и почему?
3. Напишите уравнения реакций, отражающих механизм буферного действия.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Понятие буферных систем, их состав и классификация.
2. Расчет рН и рОН буферного раствора.
3. Механизм буферного действия систем.
4. Факторы, влияющие на величину рН буферного раствора.
5. Буферная емкость.
6. Факторы, влияющие на буферную емкость.
7. Буферные системы в организме человека и их соотношение в норме.
ОБРАЗЕЦ ОТВЕТА НА КОНТРОЛЬНЫЕ ВОПРОСЫ:
ВОПРОС: Буферный раствор приготовлен из 200 мл раствора дигидрофосфата натрия СЭ = 0,05 моль экв/л и 100 мл раствора гидрофосфата натрия СЭ = 0,1 моль экв/л. Рассчитайте водородный показатель этой буферной системы. Сравните буферную емкость по кислоте и по основанию. 
ОТВЕТ: 1. Вычислим значение рН буферной системы:

 , ν = С·V(л) ν = С·V
, ν = С·V(л) ν = С·V
 pH = 6,8
pH = 6,8
2. Сравним буферную емкость. Буферная емкость раствора зависит от соотношения компонентов (соли и кислоты). Известно, что, если νс = νк, то Вк = Восн. = Вmax. Ион Н2РО4- играет роль кислоты, ион НРО42- играет роль основания.
 моль экв; νНРО42- = 0,01 моль экв
моль экв; νНРО42- = 0,01 моль экв
Т.к. νс = νк, то Вк = Восн.. У данного буферного раствора рН = 6,8, буферные емкости по основанию и кислоте одинаковы.
ВОПРОС: Рассчитайте буферную емкость по кислоте, если после добавления к 500 мл ацетатной буферной системе 5 мл 0,05 М раствора НС1 рН изменился на 0,5.
ОТВЕТ:  , νэ = Сэ·V(л)
, νэ = Сэ·V(л)
 моль экв/л
моль экв/л
Буферная емкость по кислоте составляет 10-3 моль экв/л.
ВОПРОС: Какой объем 0,1 М раствора аммиака и 0,1 М раствора хлорида аммония необходимо взять для приготовления 200 мл буферного раствора, рОН которого 5,76?
 .
.
ОТВЕТ: 1. Определим соотношение компонентов смеси:
NH3·H2O + NH4Cl – буферная система второго типа.
 ; ν = С∙V
; ν = С∙V

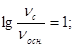

2. Вычислим объем растворов соли и основания, необходимые для приготовления 200 мл буферной смеси:
Vc + Vосн. = 200 мл; Vосн. = 200-Vс;  ;
;
Vc = 182 мл; Vосн. = 200-182 = 18 мл
Для приготовления 200 мл буферного раствора с рОН = 5,76 необходимо смешать 182 мл 0,1 М раствора хлорида аммония и 18 мл 0,1 М раствора аммиака.
ЛИТЕРАТУРА:
1. С. 108-119; 2. С. 155-160; 3. С. 90-100; 5. С. 77-81; 6. С. 197-207.
АДСОРБЦИЯ
Актуальность темы обусловлена тем, что адсорбция широко распространена и играет важную роль в жизнедеятельности растительных и животных организмов. Процессы фотосинтеза, питания, обмена веществ характеризуются явлениями адсорбции на первых этапах превращений веществ. Так, первые стадии действия ферментов сводятся к адсорбции субстрата на поверхности ферментного комплекса.
Явления адсорбции нашли практическое применение при лечении инфекционных заболеваний (активированный уголь способен удерживать болезнетворные микроорганизмы – возбудители дизентерии, брюшного тифа и др.), выведении из организма ядовитых веществ и токсинов, очистке питьевой воды. Теория адсорбции объясняет возникновение некоторых болезней в организме человека (кессонная болезнь). Основанная на явлении адсорбции хроматография используется не только как метод анализа и идентификации веществ, но и при изготовлении лекарственных препаратов, инъекционных растворов.
В процессе обучения студент-медик с темой «Адсорбция» может встретиться при изучении следующих дисциплин: физика, фармакология, кожно-венерические болезни, судебная медицина, реаниматология, психиатрия, хирургия, охрана окружающей среды, гигиена.
ЦЕЛЬ ЗАНЯТИЯ:
Расширить и закрепить знания по теоретическим основам физико-химии поверхностных явлений. Овладеть техникой измерения величины поверхностного натяжения жидкостей методом сталагмометрии. Исследовать влияние химической природы веществ на их поверхностную активность. Изучить зависимость адсорбции от природы адсорбента и растворителя.
ЗАДАНИЕ:
Выполните четыре лабораторных опыта и составьте отчет.
Работа 10. хроматография
Хроматографические методы находят широкое применение в клинической практике. Хроматографию на бумаге и тонкослойную хроматографию используют для определения аминокислот, углеводов, нуклеотидов, кетокислот и гормонов и др. в биологических жидкостях (сыворотка крови, моча, слюна, пот) или в экстракте из тканей в норме и при различных патологических состояниях. Методом хроматографии на бумаге установлены состав и содержание некоторых веществ при заболеваниях с нарушением азотистого обмена, например, при болезнях печени, почек, недостаточности витаминов, психических заболеваниях, вызванных токсическим действием отдельных аминокислот.
Аминоизомасляная кислота впервые была открыта в моче при помощи бумажной хроматографии. Эта аминокислота встречается в больших количествах у отдельных индивидуумов (семейный признак), она найдена примерно у 5-10 % населения.
Аминоацидурия хроматографически определяется при почечной коме и некрозах печени, злокачественных новообразованиях, нефритах, ожогах, голодании. Обнаружение на хроматограммах в моче детей аргининянтарной кислоты (АЯК) впервые позволило описать и выяснить патогенез наследственного психического заболевания детей, названного аргининянтарной ацидурией. Высокое содержание АЯК в цереброспинальной жидкости вызывает отравление центральной нервной системы. Тонкослойную хроматографию на оксиде алюминия и силикогеле используют для качественного и количественного определения гормонов коры надпочечника (17-кетостероидов) и половых гормонов (андростерона и эстрогенов) в плазме, крови и моче. Этот метод применяют для ранней диагностики беременности и гормональных заболеваний.
Сочетание электрофореза и бумажной хроматографии впервые позволило установить различие в аминокислотном составе нормального гемоглобина человека и гемоглобина больных серповидноклеточной анемией, положив начало изучению болезненных процессов, совершающихся на молекулярном уровне.
Хроматография оказалась незаменимой для изучения патогенеза болезней, протекающих с нарушением различных других сторон обмена веществ, что открыло новые диагностические возможности и указало пути рациональной терапии некоторых заболеваний. Широкое применение находит хроматография в судебно-медицинской экспертизе.
ЦЕЛЬ ЗАНЯТИЯ:
1. Освоить экспериментальные методы разделения красителей с помощью метода бумажной хроматографии.
2. Освоить экспериментальный метод разделения ионов методом колоночной хроматографии.
3. Освоить экспериментальный метод разделения компонентов мочи на анионите.
4. Научиться оценивать разделение компонентов с помощью расчета отношения скоростей их перемещения к скорости перемещения фронта растворителя (величина Rf).
5. Научиться идентифицировать вещество на основании сопоставления скоростей и перемещения его и «свидетеля» по слою сорбента.
6. Научиться качественно оценивать разделение компонентов, близких по химической природе.
ЗАДАНИЕ:
Выполните четыре опыта, дайте оценку использованных методов по механизму и технике выполнения, объясните положение окрашенных зон в бумажной и колоночной хроматографии, рассчитайте Rf у компонентов смеси и у «свидетелей». Напишите схему ионного обмена при поглощении и элюировании, подтвердите выделение ионов ОН- в растворе при поглощении и С1- в элюате, оформите отчет.
ОПЫТ 2.
а) Разделение красителей методом бумажной
Хроматографии
В стакан (100-150 мл) налейте 0,1 М раствор NaOH. Фильтровальную бумагу вырежьте полоской 30 мм и укрепите на проволоке. Простым карандашом нанесите стартовую линию на расстоянии 3 см от нижнего края полоски и финишную линию для растворителя на расстоянии от стартовой линии 7-8 см. На стартовой линии отметьте карандашом центры для четырех капель. Хорошо отточенными спичками нанесите чистые красители в отмеченные центры в следующей последовательности от левого края бумаги: 1) тимоловосиний; 2) метилкрасный; 3) фуксин.
На предметное стекло нанесите по 1 капле фуксина и метилкрасного и 2 капли тимоловосинего красителя, а затем чистой спичкой перемешайте капли и также нанесите смесь на подготовленную бумажную полоску. Затем опустите бумажную полоску с нанесенными каплями в стакан с раствором 0,01 М NaOH таким образом, чтобы проволока лежала на краях стакана. Когда фронт растворителя достигнет финишной прямой, выньте полоску из стакана и аккуратно подсушите над электроплиткой. Проведите параллельные прямые из центра капель до финишной прямой и замерьте это расстояние до центра каждого цветного пятна. Заполните такую же таблицу, как в опыте 1.  Учитывая, что формула фуксина
Учитывая, что формула фуксина
или: R(NH2)+3Cl-
 тимолового синего
тимолового синего
или: R/−SO3H(α1)
 и метилового красного СООН
и метилового красного СООН
или: R//−COOH(α2),
объясните распределение цветных пятен, если бумага отрицательно заряжена.
б) Разделение сахаров методом круговой бумажной
Хроматографии
Выполнение: в фильтре диаметром 12-13 см вырежьте от края к центру полоску шириной 4-5 мм и отогните ее под прямым углом к плоскости фильтра. На расстоянии 0,5 см от центра фильтра по кругу нанесите капилляром раствор смеси сахаров и растворы чистых сахаров («свидетели»). Места нанесения капель (старт) отметьте предварительно карандашом. Капли аккуратно подсушите над электроплиткой. В чашку Петри налейте 10 мл смеси растворителей: бутанол-ацетон-вода (соотношение 7:2:1) и сверху поместите фильтр, погрузив вырезанный сектор в растворитель. Бумагу прижмите второй чашкой Петри. Когда фронт жидкости дойдет до края чашки, бумагу высушите и проявите сахар анилинфталатом. Зарисуйте хроматограмму. Данные занесите в табл. 12, как в опыте 1.
1. Дайте оценку использованного метода распределения по механизму и технике выполнения.
2. Укажите, какие из растворителей выполняют роль подвижных и неподвижных.
3. Укажите, какой компонент смеси обладает большей подвижностью и почему.
в) Разделение α-аминокислот методом радиальной бумажной хроматографии
Радиальную хроматографию проводят на бумаге в чашке Петри. Растворитель перемещается от центра к периферии и захватывает аминокислоты, которые распределяются на концентрических кругах и обнаруживаются после высушивания бумаги и обработки нингидриновым реактивом.
Выполнение: в фильтре диаметром 12-13 см вырежьте в центре отверстие диаметром 1,0 см. Простым карандашом разделите круг на четыре части и поместите его на ножку из фильтровальной бумаги в виде трубочки высотой 2 см, вставленной в отверстие диска. Диск держите за края, чтобы избежать появления пальцев на хроматограмме.
Отступив от центра 1 см в каждом секторе, отмерьте карандашом растворы индивидуальных α-аминокислот (1,2,3) и раствор их смеси (4). Бумагу просушите на воздухе в течение 10 мин.
На дно чашки Петри налейте 10 мл раствора смеси растворителей: бутанол-уксусная кислота-вода (соотношение 4:1:1) и сверху поместите фильтр, чтобы ножка упиралась в дно.
<|
|
|

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!